54.
В твёрдом состоянии и в водных растворах при рН от 4,0 до 9,0 аминокислоты присутствуют в виде внутренних солей ( биполярных ионов).
При рН меньше 4,0 (сильно кислая реакция среды) будет заторможена диссоциация карбоксильной группы и соединение будет нести «+» заряд.
Увеличение рН больше 10,0 будет тормозить связывание протона аминогруппой и соединение будет иметь суммарный «-» заряд
Для каждой аминокислоты существует такое значение рН, при котором биполярный ион пребывает в равновесии с катионной и анионной формами.
Это значение рН называется изоэлектрической точкой аминокислоты (р I).
Вследствие того, что способность к ионизации у карбоксильной группы несколько выше, чем у аминогруппы, величина рI у биполярного иона несколько меньше 7 лежит в интервале от 6,3 до 5,5 ( слабо кислая реакция среды).
Следует также иметь ввиду, что на ионизацию карбоксильной и аминогруппы оказывают влияние и другие группировки молекулы, в связи с чем р I для каждой аминокислоты индивидуально.
Кислотно-основные свойства аминокислот:
Появление в радикале аминокислот других группировок, способных к ионизации, резко меняет поведение аминокислот в растворах.
Кислые аминокислоты в растворах могут находиться в виде биполярного иона, аниона и дианиона, а также в виде катиона в зависимости от реакции среды:
Основные аминокислоты в зависимости от рН среды могут находится в растворе в виде биполярного иона, катиона, дикатиона, а также аниона.
55.
Аминокислоты, являясь амфотерными соединениями, способны взаимодействовать и с кислотами, и с основаниями с образованием солей:
Аминокислоты реагируют с Cu(OH)2 подобно многоатомным спиртам, образуя хелатные комплексы:
Взаимодействие с формальдегидом:
Данная реакция может быть использована для количественного определения аминокислот в исследуемом растворе
56.
57.
Белки (протеины) – полипептиды, являющиеся продуктами поликонденсации альфа аминокислот.
Реакции, характерные одновременно для амино- и карбоксильной группы(переаминирование)
В результате образуется новая амино- и новая оксокислота.
Данная реакция идёт в присутствие ферментов трансаминаз и кофермента перидоксальфосфата.
Первичная структура пептидов и белков
Для каждого отдельного белка или полипептида характерна своя, присущая только ему, последовательность соединения АК остатков в полипептидной цепи и эту уникальную последовательность соединения АК остатков полипептидной цепи принято называть первичной структурой белка.
Стабилизация первичной структуры осуществляется за счёт ковалентной пептидной связи между АК остатками.
Cвязь между атомами азота и углерода в группировке
характер вследствие π-р -сопряжения неподелённой пары электронов атома азота и пи-электронов двойной углерод-кислородной связи.
Её длина уменьшается до 0,132 нм вместо обычных 0,146 нм.
Этот частично двойной характер связи значительно ограничивает возможность вращения вокруг её оси, в результате чего группировка атомов
приобретает жёсткую плоскую пространственную структуру, в которой атомы кислорода и водорода расположены в транс - положении относительно оси - С-N – связи.
Точно также атомы соседних АК остатков, вместе с присоединёнными к ним радикалами АК, оказываются в транс – положении по отношению друг к другу.
За счёт возможности вращения вокруг осей –С –С – связей полипептидная цепь в целом может приобретать различную пространственную структуру, хотя вращение вокруг осей этих связей и носит ограниченный характер из-за стерических эффектов, создаваемых радикалами АК.
58.
59.
Нуклеиновые кислоты являются высокомолекулярными органическими соединениями. Существует два типа НК: рибонуклеиновые кислоты (РНК) и дезоксирибонуклеиновые кислоты (ДНК). Эти соединения играют важную роль в биологических системах, начиная с вирусов и заканчивая клетками высших животных, участвуя в хранении (ДНК) и реализации (РНК) генетической информации.
Следует иметь ввиду, что одни НК не могут быть достаточно стабильными хранителями генетической информации, и тем более, одни они не в состоянии обеспечить перевод этой информации в конкретные биологические структуры: клетки, ткани, органы. Даже вирусы представляют собой комплекс НК и белков, т.е. нуклеопротеидный комплекс.
Молекулы НК являются самыми большими биологическими полимерами. Так молекулярная масса РНК может достигать 10 – 14 *106 ,а молекулярная масса ДНК – 1010- 1011.
Длина такой молекулы ДНК может доходить до 8см при диаметре всего в 2 нм (соотношение длины молекулы и её диаметра приближается к 107).
Такая молекула крайне нестабильна и в отсутствии стабилизирующих её белков легко разламывается.
При всех своих гигантских размерах молекулы НК устроены сравнительно просто: они, подобно белкам, состоят из весьма ограниченного числа мономерных единиц, соединённых в длинные неразветвлённые полимерные цепи.
При полном гидролизе НК в гидролизате могут быть обнаружены соединения трёх типов:
фосфорная кислота; углевод ( рибоза или дезоксирибоза) органические соединения, представляющие собой различные производные гетероциклов пурина или пиримидина.
На долю аденина (А), гуанина (Г), цитозина (Ц) и тимина (Т) приходится 99 -98% от общего их количества.
Эти основания получили название главных азотистых оснований ДНК
Минорные азотистые основания –это редко встречающиеся азотистые основания. Они составляют 1 -2% в составе ДНК и до 15% в составе РНК.
По своей химической природе они обычно являются метилированными или гидроксиметилированными производными главных азотистых оснований.
Азотистые основания пиримидинового или пуринового ряда, имеющие в своём составе кислород, могут существовать в двух формах: лактамной (оксо-форма) и лактимной (гидрокси-форма).
В составе НК азотистые основания всегда присутствуют в лактамной форме.
Нуклеозидами называются N-гликозиды, образованные нуклеиновыми основаниями и рибозой (или дезоксирибозой).
Нуклеозиды, будучи N-гликозидами, устойчивы к гидролизу в слабощелочной среде, но расщепляются в кислой.
Пуриновые нуклеозиды гидролизуются очень легко, пиримидиновые труднее (только в сильнокислой среде и при сильном нагревании).
Нуклеотиды- это фосфаты нуклеозидов.
Важнейшим веществом в клетках живых организмов является аденозинтрифосфорная кислота или аденозинтрифосфат (АТФ). Это вещество относится к группе нуклеозидтрифосфатов и играет ведущую роль в процессах метаболизма в живых клетках, являясь для них незаменимым источником энергии.
Такая роль обусловлена тем, что благодаря наличию двух высокоэнергетических связей, АТФ выступает источником энергии для многих физиологических и биохимических процессов, требующих больших энергозатрат. Такими процессами являются все реакции синтеза сложных веществ в организме. Это, прежде всего, активный перенос молекул через клеточные мембраны, включая участие в создании межмембранного электрического потенциала, и осуществление сокращения мышц.
Никотинамидадениндинуклеотд (НАД+). Участвует в процессах окисления-восстановления. Пример участия в биохимических реакциях- реакция окисления спиртовых групп в альдегидные (окисление ретинола в ретиналь).
60.
Первичная структура НК
В процессе образования полинуклеотида 2 мононуклеотида соединяются друг с другом за счёт взаимодействия остатка фосфорной кислоты одного мононуклеотида у С5 с гидроксильной группой у С3 –рибозы (или дезоксирибозы) второго мононуклеотида:
После выделения молекулы воды 2 мононуклеотида оказываются соединёнными сложноэфирной связью между остатком фосфорной кислоты одного мононуклеотида и С3-рибозы другого. Такая связь часто называется фосфодиэфирной связью, поскольку остаток фосфорной кислоты образует 2 сложноэфирные связи-с остатком углевода своего мононуклеотида и остатком пентозы другого.
Образовавшийся нуклеотид имеет на одном конце остаток фосфорной кислоты, а на другом - свободный гидроксил у С3- рибозы.
За счёт их может идти присоединение следующих мононуклеотидов, т.е. существует принципиальная основа для образования полимера – полинуклеотида.
Количество мономерных звеньев в полимерной цепи может достигать 108 -109 единиц.
Мононуклеотиды связаны в полинуклеотид последовательно так, что разветвлённых структур не образуется.
Последовательность соединения мононуклеотидов в полинуклеотид носит название первичной структуры НК.
Полинуклеотидная цепь имеет начало и окончание.
Началом считается тот конец полинуклеотида, на котором находится или свободная гидроксильная группа С5-рибозы, или же остаток фосфорной кислоты, связанный с этим гидроксилом.
Окончанием полинуклеотида считается его конец, содержащий или свободный гидроксил у С3- пентозы или же остаток фосфорной кислоты, связанный с этим гидроксилом.
5, 3,- прямое направление
3, 5, - обратное направление
Полинуклеотидную цепь принято изображать в виде последовательности сокращённых названий азотистых оснований, входящих в её состав нуклеотидов:
Изучение нуклеотидного состава ДНК показало, что:
- количество пиримидинов в молекуле эквивалентно количеству пуринов ( Т+Ц=А+Г );
- А = Т;
- Г = Ц ;
- А + Ц = Г + Т.
Тем не менее ДНК каждого отдельного вида животного, растения или микроорганизма обладает характерным для данного вида составом, который не зависит от возраста, условий роста, различных факторов развития и т.д.
В то же время ДНК, выделенная из различных клеток или органов животного, имеет одинаковый состав, характерный для данного вида.
Вторичная структура ДНК
Согласно современным представлениям молекула ДНК представляет собой не одиночную, а двойную полинуклеотидную цепь, спиралеобразно скрученную в пространстве. Углеводно-фосфатные основы цепей расположены по периферии структуры, а азотистые основания упакованы внутри неё.
Азотистые основания одной цепи взаимодействуют с азотистыми основаниями другой цепи за счёт образования водородных связей между ними. Азотистое основание тимин одной цепи всегда взаимодействует с аденином другой, а цитозин одной цепи взаимодействует с гуанином в другой цепи.
Стэкинг-взаимодействие
-суть его состоит в том, что плоскости азотистых оснований молекулы ДНК, перпендикулярные длинной оси молекулы и параллельные друг другу, образуют внутри спирали что-то вроде монетного столбика. Каждое из азотистых оснований взаимодействует с выше и ниже лежащим азотистым основанием за счёт своих делокализованных систем пи-электронов.
В результата вся молекула оказывается «прошитой» по длине особым типом связей, которые получили название стекинг –взаимодействия.
Поскольку все азотистые основания одной полинуклеотидной цепи ДНК комплементарны азотистым основаниям её цепи, то и в целом одна полинуклеотидая цепь комплементарна другой цепи.
Регулярная пространственная структура, возникающая в результате взаимодействия двух антипараллельных комплементарных полинуклеотидных цепей и представляющая собой двойную правозакрученную спираль, носит название вторичной структуры ДНК.
В отличие от ДНК молекулы РНК не имеют каких-либо выраженных закономерностей в отношении количественного состава входящих в них азотистых оснований.
К тому же молекулы РНК состоят из одной полинуклеотидной цепи и выраженной вторичной структуры на всём протяжении молекулы РНК не имеют.
В качестве элементов вторичной структуры РНК обычно рассматривают так называемые «шпильки», представляющие собой участки одной и той же полинуклеотидной цепи, перегнутые в пространстве и закрученные сами на себя. Стабилизация таких структур осуществляется за счёт водородных связей между азотистыми основаниями восходящего и нисходящего участков полинуклеотидной цепи.
Полной комплементарности между восходящим и нисходящим участками в полинуклеотидной цепи в такой шпильке нет и структура её не так регулярна и прочна, как аналогичная структура ДНК, но тем не менее в некоторых классах молекул РНК в образовании такого рода элементов вторичной структуры может участвовать до 60% всех мононуклеотидных остатков.
В то время как состав и структура ДНК постоянны для клеток данного организма, молекулу РНК даже в пределах одной и той же клетки гетерогенны по структуре и составу. Кроме того, они выполняют различные функции в сложном процессе реализации генетической информации. По функциональному принципу клеточные РНК можно разделить на 4 класса:
Ø Рибосомальная РНК – входит в состав рибосом, клеточных органелл, на которых происходит сборка полипептидных цепей белков в процессе их биосинтеза. На долю рРНК приходится 60-65% всей клеточной РНК.
Ø Информационная(матричная РНК).Функция этого класса РНК- перенос генетической информации из ядра к месту синтеза белка- рибосомам. Она составляет 5% от всей клеточной РНК.
Ø Транспортная РНК- её функция состоит в отборе и транспортировке аминокислот из цитоплазмы к рибосомам. Т-РНК составляет до 10% всей клеточной РНК.
Ø Ядерная РНК. Эта фракция состоит главным образом из предшественников молекул первых трёх классов РНК, образующихся в процессе синтеза РНК на ДНК. Эта фракция составляет около 20% всей клеточной РНК.
61.
Липиды — обширная группа природных органических соединений, включающая жиры и жироподобные вещества. Молекулы простых липидов состоят из спирта и жирных кислот,
сложных — из спирта, высокомолекулярных жирных кислот и других компонентов. Содержатся во всех живых клетках.
Общее свойство всех липидов – не растворимость в воде и хорошая растворимость в неполярных органических растворителях: диэтиловом эфире, трихлорметане (хлороформе), тетрахлорметане (четыреххлористом углероде), бензоле и т.п.
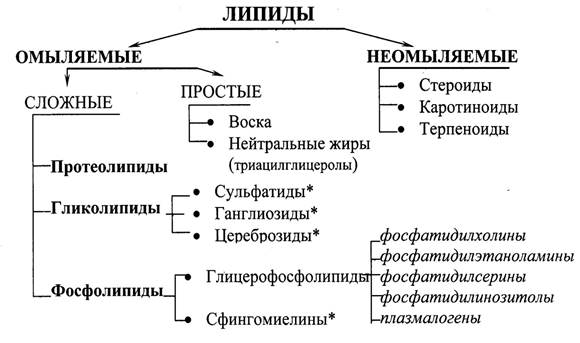
62.
Фосфолипиды- липиды, отщепляющие фосфорную кислоту при гидролизе.
Их основу составляют фосфоглицериды и некоторые сфинголипиды.
Фосфолипиды характеризуюся достаточно высоким содержанием ненасыщенных кислот.
Фосфоглицериды ( глицерофосфолипиды)- производные глицеро-3-фосфата, главный липидный компонент клеточных мембран. Они сопутствуют жирам пище и служат источником фосфорной кислоты, необходимой для жизни человека.
Общее строение L-глицерофосфолипидов следующее:
63.
К стероидам относится обширный класс природных веществ, в основе молекул которых лежит конденсированный остов, называемый стераном.
Наиболее распространенным среди многочисленных биологических соединений стероидной природы является холестерин. Холестерин – одноатомный спирт (холестерол); он проявляет свойства вторичного спирта и алкена.
Около 30% холестерина в организме содержится в свободном виде, остальное количество – в составе ацилхолестеринов, т.е. сложных эфиров с высшими карбоновыми кислотами, как насыщенными (пальмитиновой и стеариновой), так и ненасыщенными, т.е. в виде ацилхолестеринов.
Общее содержание холестерина в организме человека составляет 210–250 г.
В больших количествах он содержится в головном и спинном мозге, является компонентом биомембран.
Важнейшая биохимическая функция холестерина обусловлена тем, что он играет роль промежуточного продукта в синтезе многих соединений стероидной природы: в плаценте, семенниках, желтом теле и надпочечниках происходит превращение холестерина в гормон прогестерон, который является начальным субстратом сложной цепи биосинтеза стероидных половых гормонов и кортикостероидов
Другие пути использования холестерина в организме связаны с образованием витамина D и необходимых для пищеварения желчных кислот, например, холевой кислоты.
Триацилглицерины и холестерин под действием специфических ферментов (липопротеинлипаза) высвобождаются из хиломикронов и затем потребляются жировой тканью, печенью, сердцем и другими органами.
При некоторых нарушениях обмена веществ или высокой концентрации холестерина в крови происходит их отложение на стенках сосудов (атеросклероз), в том числе в артериях сердечной мышцы (ишемическая болезнь сердца и инфаркт миокарда).
Стероидные гормоны образуются на основе холестерина. В эту группу физиологически активных веществ относят половые гормоны, глюкокортикоиды, минералокортикоиды.
Механизм действия гормонов стероидной природы используют в силовых видах спорта: тяжелая атлетика, бодибилдинг, пауэрлифтинг, кроссфит. Он связан с активизацией биологического синтеза белка, что важно для наращивания мышечной массы.
Стероиды изменяют процесс регенерации мускулов. Если у обычного человека после силовых тренировок на восстановления мышечных волокон уходит от 48 часов, то у тех, кто принимает анаболические стероиды около суток.
Особенность механизма действия стероидных гормонов следующая:
· активные вещества легко приникают через мембрану клетки и начинают взаимодействовать со специфическими клеточными рецепторами, в результате чего образуется функциональный комплекс «гормон-рецептор», который перемещается в ядро;
· в ядре комплекс распадется, и гормон взаимодействует с ДНК, за счет чего активируется процесс транскрипции (переписывание информации о структуре белка с участка молекулы ДНК на матричную РНК);
· одновременно активируется процесс синтеза рибосомальной РНК для образования дополнительных рибосом (органелл, в которых синтезируются белки), из них формируются полисомы;
· на основе матричной РНК в рибосомах запускается синтез белка, а полисомы позволяют одновременно синтезировать несколько белковых молекул.
Стероидные гормоны надпочечников выполняют в организме важные функции:
· Кортизол играет ключевую роль в обеспечении обмена веществ, регулирует артериальное давление. Популярное название этого гормона «гормон стресса». Переживание, голодание, недосыпание, волнение и другие стрессовые ситуации вызывают повышенную секрецию этого гормона, чтобы организм под влиянием активного вещества мог справиться со стрессом.
· Кортикостерон обеспечивает организм энергией. Он помогает расщеплению белков и превращению аминокислот в сложные углеводы, которые являются источником энергии. Кроме этого, он помогает вырабатывать гликоген в качестве энергетического резерва.
· Альдостерон важен для поддержания артериального давления, контролирует количество ионов калия и натрия.
Гормональную регуляцию важнейших процессов жизнедеятельности осуществляют не только вещества надпочечников, но и половые стероиды:
· Мужские половые гормоны или андрогены отвечают за формирование и проявление вторичных половых признаков, развитие мышечной системы, сексуальное поведение, детородную функцию.
· В женском организме ведущая роль принадлежит эстрогенам. Они обеспечивают формирование и функциональность женской репродуктивной системы, проявление вторичных половых признаков.
54.
В твёрдом состоянии и в водных растворах при рН от 4,0 до 9,0 аминокислоты присутствуют в виде внутренних солей ( биполярных ионов).
При рН меньше 4,0 (сильно кислая реакция среды) будет заторможена диссоциация карбоксильной группы и соединение будет нести «+» заряд.
Увеличение рН больше 10,0 будет тормозить связывание протона аминогруппой и соединение будет иметь суммарный «-» заряд
Для каждой аминокислоты существует такое значение рН, при котором биполярный ион пребывает в равновесии с катионной и анионной формами.
Это значение рН называется изоэлектрической точкой аминокислоты (р I).
Вследствие того, что способность к ионизации у карбоксильной группы несколько выше, чем у аминогруппы, величина рI у биполярного иона несколько меньше 7 лежит в интервале от 6,3 до 5,5 ( слабо кислая реакция среды).
Следует также иметь ввиду, что на ионизацию карбоксильной и аминогруппы оказывают влияние и другие группировки молекулы, в связи с чем р I для каждой аминокислоты индивидуально.
Кислотно-основные свойства аминокислот:
Появление в радикале аминокислот других группировок, способных к ионизации, резко меняет поведение аминокислот в растворах.
Кислые аминокислоты в растворах могут находиться в виде биполярного иона, аниона и дианиона, а также в виде катиона в зависимости от реакции среды:
Основные аминокислоты в зависимости от рН среды могут находится в растворе в виде биполярного иона, катиона, дикатиона, а также аниона.
55.
Аминокислоты, являясь амфотерными соединениями, способны взаимодействовать и с кислотами, и с основаниями с образованием солей:
Аминокислоты реагируют с Cu(OH)2 подобно многоатомным спиртам, образуя хелатные комплексы:
Взаимодействие с формальдегидом:
Данная реакция может быть использована для количественного определения аминокислот в исследуемом растворе
56.
57.
Белки (протеины) – полипептиды, являющиеся продуктами поликонденсации альфа аминокислот.
Реакции, характерные одновременно для амино- и карбоксильной группы(переаминирование)
В результате образуется новая амино- и новая оксокислота.
Данная реакция идёт в присутствие ферментов трансаминаз и кофермента перидоксальфосфата.
Взаимодействие аминокислот друг с другом
В результате образуется дипептид, характерной чертой которого является наличие свободных - NH2 и -COOH групп, а это означает, что полученный дипептид может реагировать с другой молекулой аминокислоты с образованием трипептида, тетрапептида …и полипептида.
Следовательно, возникает возможность получения полимерного соединения, мономерными единицами которого являются остатки аминокислот.
Если записать полипептид в общем виде, то можно убедиться, что соединение построено из регулярно повторяющихся группировок
Линейный набор этих группировок и образует остов полимера.
К среднему атому каждой такой группировки, являющемуся α- углеродным атомом аминокислотного остатка, присоединён боковой радикал той или иной аминокислоты.
Именно поэтому различия в свойствах отдельных полипептидов определяются не структурой остова полипептидной цепи, а набором имеющихся аминокислотных радикалов.
В структуре любого полимера на одном конце полипептидной цепи находится свободная - NH2, в связи с чем его принято называть N-концом, а на другом конце молекулы имеется свободная -COOH группа, поэтому его принято называть С-концом.
Началом полипептидной цепи считается N-конец, а окончанием
С-конец. За прямое направление полипептидной цепи принято считать направление N-С, а за обратное С-N.
Название полипептида строится исходя из названий входящих в его состав аминокислотных остатков.
Перечисление остатков ведётся с N-конца, причём, если карбоксильная группа АК участвует в образовании пептидной связи, то в названии АК окончание меняется на «-ил».
Если же АК остаток в составе полипептида сохраняет свою -COOH группу, окончание в названии АК не меняется.
В связи с тем, что полимеры могут содержать большое количество аминокислотных остатков, часто прибегают к сокращённой записи их названий, например:
NН2-Ала-Фен-Сер………..Цис-СООН
Не существует какой-либо чёткой границы между соединениями, относящимися к полипептидам или белкам. В качестве условного критерия используется величина их молекулярной массы:
если она выше 5000 – белки;
если молекулярной масса меньше 5000-полипептиды.
Структуры пептидов и белков:
При изучении структуры пептида решают 3 главных вопроса:
Какие АК и в каком количестве входят в состав его молекулы?
В какой последовательности соединены эти АК в полипептиде?
Каково пространственное расположение полипептидной цепи, т.е. какова её конформация?
Для решения первого вопроса полипептид подвергают гидролизу – расщеплению до отдельных аминокислот. В ходе гидролиза происходит разрыв пептидных связей с участием молекул воды.
Пептидная связь, являясь прочной ковалентной связью, в отсутствие катализатора почти не расщепляется водой даже при длительном кипячении.
Добавление кислот или щелочей значительно ускоряет процесс( кислотный или щелочной гидролиз).
Дата: 2019-02-02, просмотров: 352.