газов Н2S и СО2
Ведение буровых работ на месторождениях с наличием в пластовых флюидах сероводорода требует разработки специальных технических средств, материалов и технологических мероприятий, так как проявления сероводорода создают ряд серьезных проблем.
1) Прежде всего это опасность отравления для персонала и окружающей среды. Сероводород- сильный яд, поражающий нервную систему, попадая в легкие, он растворяется в крови и соединяется с гемоглобином. Предельно допустимая концентрация сероводорода в воздухе очень низка - 10 мг/м3, а в смеси с углеводородами - 3 мг/м3.
Сероводород тяжелее воздуха ( относительная плотность 1,17 ), он легко воспламеняется и в смеси с воздухом взрывается.
Нижний и верхний пределы взрывоопасной концентрации сероводорода с воздухом составляют 4,3-45 % ( объемных).
2) Ухудшение качества раствора. Являясь слабой кислотой и обладая восстановительными свойствами, сероводород может изменять физико- химические условия среды и взаимодействовать с компонентами бурового раствора, вызывая в растворах, содержащих твердую фазу, особенно глину, загустевание, а в некоторых системах ( растворы на основе КССБ ) и необратимое повышение водоотдачи.
3) Коррозия оборудования. Сероводород может привести к образованию сульфидной окалины и высвобождению атомарного водорода. Атомарный водород может вызвать сульфидное растрескивание и катастрофически быстрое разрушение бурильных, обсадных, насосно- компрессорных труб и оборудования.
В упрощенном виде механизм коррозии можно записать следующим образом:
Fe3O4 + 6 H2S ® 3 FeS2+ 4 H2O + 2 H2
фактически протекают три различных типа коррозии:
а) Газ Н2S разрушает примеси, которые концентрируются на границе кристаллов, что приводит к точечной коррозии;
б) Сульфид железа образует осадок неравномерно, что приводит к образованию гальванической пары и делает возможным быструю коррозию;
в) Образующийся атомарный водород вследствие очень малого размера свободно мигрирует в структуру решетки металла. Комбинация с металлом приводит к увеличению объема и внезапному катастрофическому разрушению металла.
Сульфидно- коррозионное растрескивание происходит внезапно на относительно неповрежденных частях оборудования. Вследствие этого очень сложно заранее предугадать возможность и место разрушения такого вида. Основными внешними факторами, влияющими на скорость разрушения металла являются: концентрация и парциальное давление сероводорода, общее давление, температура и скорость движения коррозионной среды.
Основные методы борьбы с сероводородной агрессией заключается в следующем:
1) поддержание достаточного гидростатического давления на пласты с целью предотвращения поступления Н2S в скважину;
2) поддержание необходимой щелочности ( рН >11,5 ) для быстрой нейтрализации сероводорода путем образования водорастворимых сульфидов:
Н2S + NaOH= NaHS + H2O;
3) связывание сероводорода в нерастворимые сульфиды
Для связывания сероводорода используются:
а) диоксид водорода - Н2О2 + Н2S= ¯ S + 2 H2O
б) диоксид марганца - MnO2 + NaOH= Na2MnO3+ H2O
Na2MnO3 + 2 Н2S + H2O= ¯ Mn S + ¯ S+ 2 H2O+2 Na OH
в) карбонат цинка - Н2S + NaOH= NaHS + H2O
NaHS + ZnCO3= ¯ZnS + NaHCO3
г) оксиды железа - Fe3O4+ 6H2S = ¯ 3 FeS2+ 4 H2O+ 2 H2
при рН < 7 и
при рН= 8-10 Fe3O4+4 H2S = ¯ 3 FeS+ 4 H2O+S
Диоксид углерода ( СО2) - попадает в раствор при водо и газопроявлениях. Присутствие карбонатных ( СО3- - ) и бикарбонатных ( НСО3-) ионов нарушает реологию растворов на водной основе вследствие склонности бентонита к флокуляции при снижении щелочности.
Фильтрационные свойства также ухудшаются.
Ухудшение реологических свойств может затруднить управление скважиной.
Присутствие карбонатов может привести к коррозии за счет образования карбонатной окалины.
Диоксид углерода в водной среде может образовывать угольную кислоту, карбонатную окалину и вызвать чрезмерную точечную коррозию и растрескивание.
СО2 + Н2О= Н2СО3
Н2СО3 + Fe++= FeCO3¯ + H2
Основные методы борьбы заключаются в следующем:
1) удаление газа из раствора с помощью дегазатора
2) Увеличение рН до 10 для того, чтобы предотвратить кислотную коррозию
3) Добавление источника кальция для осаждения карбонатных ионов.
Обработка может производиться путем комбинированного применения извести [Cа(ОН)2] и гипса ( СаSO4) или только извести. Обработку можно производить также с использованием СаСl2.
Действие СО2 на растворы на нефтяной основе очень незначительно.
П р и м е р: Расчет необходимого количества нейтрализатора
для связывания Н2S при поступлении в скважину
1 м3 пластового флюида
V0 - объем поступившего пластового флюида в скважину, м3- 1 м3
Содержание газа в пластовом флюиде - 480 м3
(исходя из газового фактора 480)
V1 -количество Н2S в газе при содержании его 25 % - 120 м3
1 г×моль Н2S= 34 г занимает объем 24,415 л
Количество Н2S G 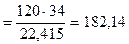 кг
кг
Максимальная поглотительная способность ЖС-7 в растворе равна: аm=0,4 кг/кг
Следовательно для связывания 182,14 кг Н2S необходимо:
q= 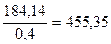 кг ЖС-7
кг ЖС-7
Коэффициент скорости реакции связывания Н2S ЖС-7 равен
К=0,468 м3/кг×час
Тогда время реакции связывания будет равно:
 часа
часа
Однако сероводород начнет выделяться из нефти на глубине 1200 м. Время движения пачки от 1200 м до устья при Qн=18 л/с ( или 65 м3/час) и площади затрубного пространства 0,022 м2 будет равно:
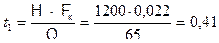 часа
часа
т.е. фактическое время движения пачки до устья меньше требуемого времени нейтрализации ( 0,56 час.).
Определяем необходимое количество нейтрализатора для полного связывания Н2S за время 0,41 часа по формуле:
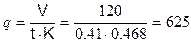 кг
кг
Если считать, что выделившейся газ диффундирует в растворе на расстояние 230 м от пачки пластового флюида, т. е. рассеян в 5 м3 бурового раствора, тогда содержание нейтрализатора должно быть 125 кг в 1 м3 бурового раствора.
Обычно добавляется больше, т. е. практически нейтрализация может быть полной.
Дата: 2019-02-02, просмотров: 467.