Химический состав Вселенной Земли и земной коры. Образование и распространенность химических элементов.
Химический состав Вселенной:
75%- водород
25%- гелий
<1%- другие газы
Большинство химических реакций происходит за счет термоядерного синтеза, топливом которого является водород. В условиях высокого давления в Звезде идет термоядерный синтез => идет образование новых химических элементов.
Степень распространения ядер во Вселенной обусловлена процессами их образования. Наиболее распространенная термоядерная реакция — превращение водорода в гелий, сопровождающееся выделением огромной энергии.
Реакция синтеза ядер не останавливается на образовании гелия. Этот элемент может «сгорать» с образованием ядер углерода, кислорода, неона, которые в результате захвата ядер гелия преобразуются в ядра магния, кремния, серы, аргона и кальция. Такие реакции происходят только в наиболее массивных звездах.
· Чем выше масса хим.элемента , тем реже он встречается во Вселенной
Хим. Состав земной коры существенно отличается от состава Вселенной. 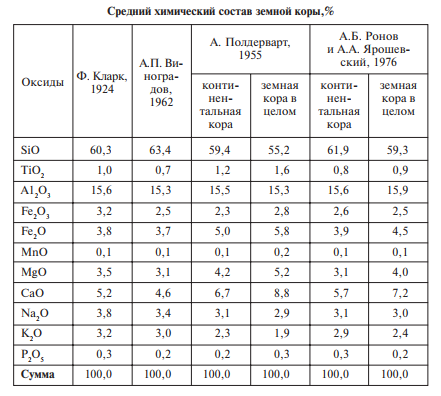
· из двух соседних элементов таблицы Менделеева содержание в земной коре четного элемента обычно больше.
Как следует из данных, приведенных в таблице, колебания в цифрах разных ученых не меняют общую картину. В составе земной коры резко преобладают кислород и кремний, которые составляют примерно 3 / 4 всей массы коры.
Первые же обобщения химического состава земной коры показали, что соотношения элементов не случайны. Прежде всего, имеется четко выраженная тенденция к уменьшению содержания элементов по мере возрастания их порядкового номера в таблице Менделеева, т. е. массы атома.
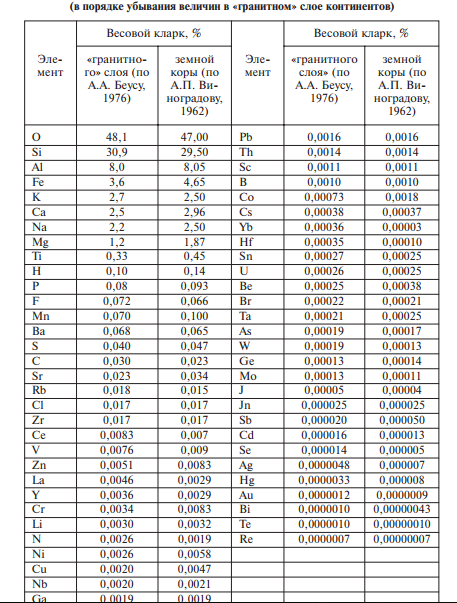
Главная геохимическая особенность земной коры — необычайно высокий кларк кислорода. Ничего подобного не обнаружено ни на Солнце, ни на других звездах. Объяснение этого замечательного явления связано не со строением ядра кислорода, а со способностью этого элемента образовывать очень прочные связи с кремнием, алюминием и некоторыми другими элементами.
Классификация химических элементов по В.И. Вернадскому, А.П. Виноградову, В.В. Добровольскому
Кларки живого вещества впервые привел В. И. Вернадский, затем уточнил А. П. Виноградов и дополнил В. В. Добровольский и др.
1)Воздушные мигранты (98,8%): О-70%; С-8%; Н-10,5%; N-0,3%
2)Водные мигранты (1,2%)
- макроэлементы: Са, К, Si, Mg, P, S, Na, Cl, Fe
- микроэлементы: Mn, Al, Zn, Sr, Ti...
3)Обнаружены в организмах без учета точной количественной величины (кларки не установлены): He, Ne, Ar, Sc, Kr, Nb, Rh, Pd, In, Te, Xe, Ta, Tl, Bi, Th.
4)Не обнаружены в организмах Ru, Hf, Re, Os, Ir, Po, Ac и в земной коре Tc, At, Fr.
Кларково число (Кларк элемента) - число, выражающее среднее содержание химических элементов.
Закономерности концентрации химических элементов в живых организмах и интенсивность биологического поглощения( коэффициент биологического поглощения факторы его определяющие). Ряды биологического поглощения.
Закономерности концентрации элементов в живом веществе:
1. Кларки концентрации элементов в живом веществе уменьшаются с ростом атомной массы.
2. Организмы - кислородные существа.
3. Живое образует органическое вещество из газов. После смерти органическое вещество вновь превращается в газы.
4. Интенсивность захвата элемента живыми организмами зависит от подвижности, а не от кларка
Интенсивность биологического поглащения .
Кларки концентрации элементов в живом веществе называются биофильностью.
Чтобы оценить интенсивность биологического поглощения элемента, надо величину его содержания в растениях сравнить с содержанием в источнике, из которого этот элемент поступает. За исключением элементов-газов — углерода, кислорода, водорода, поступающих в живое вещество из атмосферы, источником большей части элементов в наземной растительности служит земная кора. Исходя из этого, Б.Б. Полынов (1943) предложил характеризовать интенсивность биологического поглощения химического элемента частным от деления его содержания в золе (lx) на содержание в горных породах(nx). Этот показатель А.П. Перельман (1956) назвал коэффициентом биологического поглощения (Ах). Степень интенсивности не зависит от массы этого элемента, захваченной приростом растительности.
Ах= Ix/nx
Ax зависит от :
1)От свойства элемента (от биофильностью элемента)- насколько элемент вообще необходим живому
2)От особенностей физиологии организма - насколько данному организму необходим конкретны элемент
3)От доступности элемента
- в какой форме он находится
-какие природные условия на конкретной территории (климат, увлажнение )
-концентрация элемента (много его или мало )
Ряды биологического поглощения.
Главным источником элементов в растениях являются почвы. По степени накопления элементов растениями, мерилом которой является коэффициент биологического поглощения Ах или отношение содержания элемента в золе растений к содержанию этого элемента в почве или породе, А.И. Перельман выделил пять рядов.
1) Энергично накопляемые элементы: P, S, Cl, l
2)Сильно накопляемые: Ca, K, Mg, Na, Zn, Ag
3)Группы слабого накопления и среднего захвата: Mn, Ba, Cu, Ni, Co, Mo, As, Cd, Be, Hg, Se
4)Группы слабого захвата: Fe, Si, F, V
5)Группы слабого и очень слабого захвата: Ti, Cr, Pb, Al
Кларки Мирового океана
Основную массу водной оболочки Земли образуют соленые воды Мирового океана. Их объем примерно равен 1370 млн км3, в то время как объем всех вод суши (включая ледники и подземные воды до глубины 5 км) менее 90 млн км3. Так как океанические воды составляют около 93 % всех вод географической оболочки, можно считать, что их химический состав определяет основные черты состава гидросферы в целом.
Химические элементы в гидросфере, так же как и в земной коре, представлены разнообразными формами нахождения, геохимия которых неодинакова. Наиболее характерные для гидросферы формы – простые и сложные ионы, а также молекулы, находящиеся в состоянии сильно разбавленных растворов. Весьма распространены ионы, сорбционно связанные с частицами коллоидных и субколлоидных размеров, находящиеся в морской воде в виде тонкой взвеси. Третью группу форм составляют элементы, входящие в состав мертвого органического вещества. Значительная масса химических элементов связана в живых организмах, населяющих Мировой океан. Элементы могут переходить из одной формы нахождения в
другую. Например, ион, находящийся в растворе, может быть сорбирован частицей взвеси и в дальнейшем разделяет судьбу взвешенных частиц и не подчиняется законам растворов.
Еще в середине прошлого века ученые обнаружили замечательную геохимическую особенность океанической воды. Эта особенность заключается в том, что, несмотря на колебания солености, соотношение главных ионов остается постоянным. Солевой состав океана является своего рода геохимической константой.
Содержание растворимых форм химических элементов в Мировом океане
Состав речных вод
Обратимся к источникам поступления растворимых соединений в Мировой океан. Его объем беспрестанно пополняется за счет речного стока, который оценивается величиной 37 тыс. км3 в год и стока ледников
(около 7 тыс. км3 в год). Следовательно, менее чем за 50 тыс. лет в океан поступает столько же воды, сколько в нем имеется в настоящее время. Разумеется, круговорот воды обеспечивает примерно постоянный объем океана. Вместе с водой поступают растворенные вещества. Геохимия морских и речных вод неразрывно связана. Вовлечение рассеянных элементов в водную миграцию на суше является первым этапом этого взаимодействия.
В речных водах содержатся разнообразные растворимые формы химических элементов. Текучие воды на поверхности суши обычно имеют величину рН от 4,5 до 8,5. При таких значениях рН многие металлы (цинк, хром, медь, бериллий, свинец, кадмий, никель, кобальт и др.) могут находиться в растворенном состоянии в форме ионов, выпадать в осадок и вновь переходить в раствор. Но их фактическое содержание в природных водах так незначительно, что регулирующее действие рН не сказывается.
Концентрация металлов в чистой речной воде часто ниже их содержания в растворах после осаждения гидроксидов. В некоторых случаях, когда образуются ничтожно малые количества нерастворимых гидроксидов металлов, они находятся в виде субколлоидных сгустков, которые не выпадают в осадок, а в состоянии разбавленных коллоидных растворов активно мигрируют. В то же время находящиеся в растворе элементы могут активно сорбироваться гелями соединений макроэлементов (в первую очередь гидроксидами железа), высокодисперсными частицами глин и осаждаться в таких условиях, в которых теоретически этого не должно быть.
Значительная часть рассеянных металлов присутствует в природных водах не в виде простых ионов, а в форме комплексных соединений. В этом случае устойчивость элементов в растворе сильно возрастает и не ограничивается теми щелочно-кислотны-ми и окислительно-восстановительными условиями, в которых может находиться в растворе простой ион. Весьма важное значение для водной миграции имеют комплексные органические, особенно внутрикомплексные (хелатные) соединения металлов.
Биогеохимический цикл азота
Азот и его соединения играют в жизни биосферы такую же важную и незаменимую роль, как и углерод. Биофильность азота сравнима с биофильностью углерода. Индекс биогенного обогащения почв по отношению к земной коре, а растений по отношению к почвам составляет для азота 1000 и 10000 соответственно (Ковда, 1985).
Основным резервуаром азота в биосфере также является воздушная оболочка. Около 80% всех запасов азота сосредоточено в атмосфере планеты, что связано с направлением биогеохимических потоков соединений азота, образующихся при денитрификации. Основной формой, в которой содержится азот в атмосфере, является молекулярная – N2. В качестве несущественной примеси в атмосфере содержатся различные оксидные соединения азота NOx, а также аммиак NH3. Последний в условиях земной атмосферы наиболее неустойчив и легко окисляется. В то же время, величина окислительно-восстановительного потенциала в атмосфере недостаточна и для устойчивого существования оксидных форм азота, потому его свободная молекулярная форма и является основной.
Первичный азот в атмосфере, вероятно, появился в результате процессов дегазации верхней мантии и из вулканических выделений. Фотохимические реакции в высоких слоях атмосферы приводят к образованию соединений азота и заметному поступлению их на сушу и в океан с атмосферными осадками (3-8 кг/га аммонийного азота в год и 1,5-6 кг/га нитратного). Этот азот также включается в общий биогеохимический поток растворенных соединений, мигрирующих с водными массами, участвует в почвообразовательных процессах и в формировании биомассы растений.
В отличие от углерода, атмосферный азот в силу устойчивости молекулы не может напрямую использоваться высшими растениями. Поэтому ключевую роль в биологическом круговороте азота играют организмы-фиксаторы. Это микроорганизмы нескольких различных групп, обладающие способностью путём прямой фиксации непосредственно извлекать азот из атмосферы и, в конечном счёте, связывать его в почве. К ним относятся:
некоторые свободноживущие почвенные бактерии;
симбионтные клубеньковые бактерии (существующие в симбиозе с бобовыми);
цианобионты, которые также бывают симбионтами грибов, мхов, папоротников, а иногда и высших растений.
Зольность биомассы
Количество зольных элементов от общей массы
[Пример по таблице: аркт.тундра =(7,8*100)/500=1,56%]
5. Интенсивность образования органического вещества
Прирост/ продолжительность вегетации
[Пример по таблице: аркт.тундра=100/1=1 т/мес]
Химический состав Вселенной Земли и земной коры. Образование и распространенность химических элементов.
Химический состав Вселенной:
75%- водород
25%- гелий
<1%- другие газы
Большинство химических реакций происходит за счет термоядерного синтеза, топливом которого является водород. В условиях высокого давления в Звезде идет термоядерный синтез => идет образование новых химических элементов.
Степень распространения ядер во Вселенной обусловлена процессами их образования. Наиболее распространенная термоядерная реакция — превращение водорода в гелий, сопровождающееся выделением огромной энергии.
Реакция синтеза ядер не останавливается на образовании гелия. Этот элемент может «сгорать» с образованием ядер углерода, кислорода, неона, которые в результате захвата ядер гелия преобразуются в ядра магния, кремния, серы, аргона и кальция. Такие реакции происходят только в наиболее массивных звездах.
· Чем выше масса хим.элемента , тем реже он встречается во Вселенной
Хим. Состав земной коры существенно отличается от состава Вселенной. 
· из двух соседних элементов таблицы Менделеева содержание в земной коре четного элемента обычно больше.
Как следует из данных, приведенных в таблице, колебания в цифрах разных ученых не меняют общую картину. В составе земной коры резко преобладают кислород и кремний, которые составляют примерно 3 / 4 всей массы коры.
Первые же обобщения химического состава земной коры показали, что соотношения элементов не случайны. Прежде всего, имеется четко выраженная тенденция к уменьшению содержания элементов по мере возрастания их порядкового номера в таблице Менделеева, т. е. массы атома.

Главная геохимическая особенность земной коры — необычайно высокий кларк кислорода. Ничего подобного не обнаружено ни на Солнце, ни на других звездах. Объяснение этого замечательного явления связано не со строением ядра кислорода, а со способностью этого элемента образовывать очень прочные связи с кремнием, алюминием и некоторыми другими элементами.
Формы химических элементов по В.И Вернадскому; классификация химических элементов по М.В. Гольдшмиту и В.И Вернадскому.
В.И. Вернадский выделил главные четыре формы нахождения химических элементов в земной коре и на ее поверхности:
1. горные породы и минералы (в тч. Природные воды и газы)
2. магмы (силикатные расплавы)
3. рассеянное состояние
Рассеянные элементы — химические элементы, которые практически не встречаются в природе в виде самостоятельных минералов и концентрированных залежей, а встречаются лишь в виде примесей в различных минералах.( рубидий, кадмий, скандий, галлий, индий, таллий, германий, гафний, ванадий, селен, теллур, рений), встречающихся в природе главным образом в виде примеси в различных минералах и извлекаемых попутно из руд других металлов или полезных ископаемых (углей, солей, фосфоритов и пр.).
4. живое вещество.
Классификация химических элементов по Вернадскому:
В основу своей классификации Вернадский положил 4 принципа, определяющих историю элементов в земной коре: химическую активность, участие в циклических процессах в биосфере, преобладание рассеянного состояния, высокая радиоактивность. Им были выделены группы:
· благородных газов (Не, Ne, Ar, Kr, Хе);
· благородных металлов (Ru, Rh, Pd, Os, Ir, Pt, Au, Ag);
· циклических элементов (Н, Na, К, Cu, Mg, Ca, Zn, В, Al, С, Si, Ti, Zr, Pb, N, Р, V, О, S, Cr, Mo, F, Cl, Mn, Fe, Co, Ni и др.);
· рассеянных элементов (Li, Rb, Cs, Sc, Y, Ga, In, Tl, Br, J);
· сильнорадиоактивных элементов (Po, Rn, Ra, Ac, Th, Pa, U);
· элементов редких земель (La, Ce, Pr, Nd, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu).
Класссификация химических элементов по Гольдшмидту:
Наиболее широко применяемая классификация. Элементы сгруппированы на основе их способности формировать естественные ассоциации в природных процессах. Это определяется рядом факторов:
1. Строение электронных оболочек, обуславливающее химические свойства элементов.
2. Положение элементов на кривой атомных объёмов.
3. Химическое «сродство» к тем или иным конкретным элементам, т.е. преимущественная склонность именно с этими определёнными элементами образовывать соединения (может измеряться значениями энергии образования определённых типов их соединений, например, оксидных).
· Сидерофильные - Fe, Co, Ni, Mo, Ru, Rh, Pd, Re, Os, Ir, Pt. Ассоциируют с железом. Все принадлежат к элементам с достраивающимися d-оболочками. Занимают промежуточное положение между лито- и халькофильными: минимумы на кривой атомных объёмов, промежуточные значения энергии образования кислородных соединений. В равной мере распространены и в оксидных, и в сульфидных ассоциациях.
· Атмофильные – все инертные газы, N, H. Все являются газами, свойственно по преимуществу атомарное или молекулярное (вне соединений) состояние (видимость того, что Н представляет исключение, связана с тем, что атомарный водород теряется, рассеиваясь в космическом пространстве).
· Халькофильные (или тиофильные, «любящие» серу) – S, Cu, Zn, Ga, Ge, As, Se, Ag, Cd, In, Sn, Sb, Te, Au, Hg, Tl, Pb, Bi, Po). Те, которые ассоциируют преимущественно с медью и серой. Это – сера и её аналоги (селен, теллур), а также элементы, преимущественно склонные образовывать не оксидные, а сульфидные соединения. Для последних характерны 18-электронные внешние оболочки катионов, расположение на восходящих участках кривых атомных объёмов. Величины энергии образования кислородных соединений низкие. Некоторые способны существовать в самородном виде.
· Литофильные - Li, Be, B, O, F, Na, Mg, Al, Si, P, Cl, K, Ca, Sc, Ti, V, Cr, Mn, Br, Rb, Sr, Y, Zr, Nb, I, Cs, Ba, TR, Hf, Ta, W, At, Fr, Ra, Ac, Th, Pa, U. Включены кислород и галогены, а также ассоциирующие с ними элементы, то есть преимущественно образующие кислородные и галоидные соединения. Последние – это те, которые расположены на пиках и нисходящих участках кривых атомных объёмов, а также имеют максимальные величины энергии образования оксидных соединений.
Дата: 2019-02-02, просмотров: 501.