| Приход | кг | % | Расход | кг | % |
| 1 | 2 | 3 | 4 | 5 | 6 |
| Природный газ | СО2 = 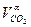 ·100· ρСО2 ·100· ρСО2
| ||||
| СН4 = СН4 ·ρСН4 | Н2О = 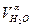 ·100· ρН2О ·100· ρН2О
| ||||
| С2Н6 = С2Н6 ·ρС2Н6 | N2 = 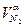 ·100· ρN2 ·100· ρN2
| ||||
| С3Н8 = С3Н8 ·ρС3Н8 | О2 = 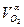 ·100· ρО2 ·100· ρО2
| ||||
| С4Н10 = С4Н10 ·ρС4Н10 | SО2 = 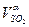 ·100· ρSО2 ·100· ρSО2
| ||||
| С5Н12 = С5Н12 ·ρС5Н12 | |||||
| СО2 = СО2 ·ρСО2 | |||||
| Окончание табл.. 2.4 | |||||
| 1 | 2 | 3 | 4 | 5 | 6 |
| N2 = N2 ·ρN2 | |||||
| Н2О = Н2О·ρН2О | |||||
| Воздух | |||||
| N2 = Lα·100·0,79·ρN2 | |||||
| O2 = Lα·100·0,21·ρO2 | |||||
| H2O = 0,16·d·Lα·ρH2O | |||||
| Итого: | 100 | Итого: | 100 | ||
Материальный баланс процесса горения твердого и жидкого топлива составляется на 100 кг топлива по следующей форме (табл. 2.5).
Таблица 2.5
Материальный баланс процесса горения твердого и жидкого топлива
| Приход | кг | % | Расход | кг | % |
| Топливо | 100 | Зола (шлак) | АР | ||
| Воздух | Продукты горения | ||||
| N2 = Lα·100·0,79·ρN2 | СО2 = 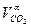 ·100· ρСО2 ·100· ρСО2
| ||||
| O2 = Lα·100·0,21·ρO2 | Н2О = 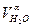 ·100· ρН2О ·100· ρН2О
| ||||
| H2O = 0,16·d·Lα·ρH2O | SО2 = 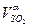 ·100· ρSО2 ·100· ρSО2
| ||||
N2 = 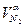 ·100· ρN2 ·100· ρN2
| |||||
О2 = 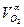 ·100· ρО2 ·100· ρО2
| |||||
| Итого: | 100 | Итого: | 100 |
Плотности некоторых газов приведены в прил.16.
Температура горения рассчитывается следующим образом. В начале считается общая энтальпия продуктов сгорания, кДж/нм3
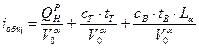 ; (2.47)
; (2.47)
теплосодержание (энтальпия) с учетом потерь, кДж/нм3
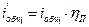 . (2.48)
. (2.48)
Действительная температура горения определяется по i – t– диаграмме (прил. 14) или аналитически.
Аналитически расчет температуры горения производится следующим образом.
Для расчета задаются приблизительной температурой горения tтеор, и при этой температуре вычисляют теплосодержание дымовых газов, кДж/нм3, с использованием таблицы теплоемкостей (прил.11)
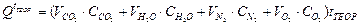 (2.49)
(2.49)
Если, например, вычисленное значение 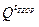 больше, чем
больше, чем 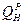 топлива, то tТЕОР ниже принятого первоначального значения, и следует задаться более низким значением tТЕОР. Если вновь вычисленное значение
топлива, то tТЕОР ниже принятого первоначального значения, и следует задаться более низким значением tТЕОР. Если вновь вычисленное значение 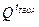 теперь меньше чем
теперь меньше чем 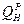 , то температуру определяют методом интерполяции.
, то температуру определяют методом интерполяции.
Пример расчета. Задаемся температурой горения tТЕОР = 1900 оС
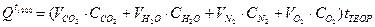 = =(1,029·2,407 + 2,164·1,9424 + 7,61·1,4759 + 1,11·1,5618) ·1900 = =37400кДж/нм3
= =(1,029·2,407 + 2,164·1,9424 + 7,61·1,4759 + 1,11·1,5618) ·1900 = =37400кДж/нм3
Найденная величина 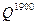 >
> 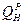 = 36200 кДж/нм3, следовательно, нужно задать более низкую температуру.
= 36200 кДж/нм3, следовательно, нужно задать более низкую температуру.
Задаемся tТЕОР = 1800 оС
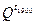 = (1,029·2,3916 + 2,164·1,9414 + 7,61·1,4688 + 1,11·1,5524) ·1800 = = 35100 кДж/нм3
= (1,029·2,3916 + 2,164·1,9414 + 7,61·1,4688 + 1,11·1,5524) ·1800 = = 35100 кДж/нм3
Найденная величина 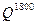 <
< 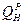 , следовательно, tТЕОР выше 1800оС и она определяется путем интерполяции:
, следовательно, tТЕОР выше 1800оС и она определяется путем интерполяции:
37400 – 1900 оС
35100 – 1800 оС
2300 – 100 оС
36200 – 35100 = 1100
Х – 1100
100 – 2300
Х= 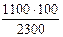 =47,8 оС = 1800 + 47,8 1848 оС
=47,8 оС = 1800 + 47,8 1848 оС
2.4.2. Расчет эффективной теплоемкости керамических материалов
Эффективная теплоемкость керамических материалов и изделий (С) может быть рассчитана по следующей формуле, кДж/(кг·К):
С = (С1·к1+С2·к2+С3·к3+…..Сi·кi)/100, (2.50)
где С1, С2, С3, Сi – теплоемкости оксидов, содержащихся в керамическом материале (изделий); кДж/(кг·К);
к1, к2, к3, кi – содержание оксидов в керамическом материале (изделии), мас., %.
Теплоемкость основных оксидов, определяющих химический состав керамических материалов и изделий, приведена в табл. 2.6.
Таблица 2.6
Дата: 2019-02-02, просмотров: 304.