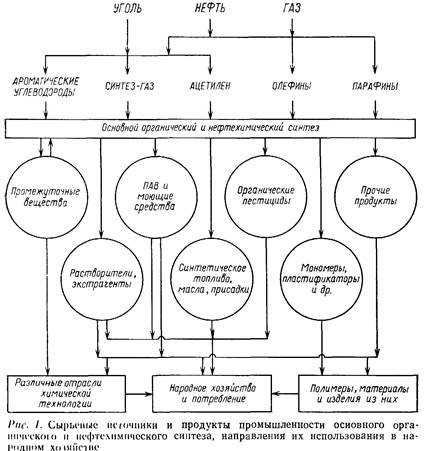
Продукты этой отрасли промышленности отличаются большим многообразием строения, свойств и областей применения. Это различные углеводороды, хлор- и фторпроизводные, спирты и фенолы, простые эфиры, альдегиды и кетоны, карбоновые кислоты и их производные (сложные эфиры, ангидриды, нитрилы и др.), амины и нитросоединения, вещества, содержащие серу и фосфор, и т. д. По назначению все они подразделяются на две группы: промежуточные продукты для синтеза других веществ в этой же или других отраслях органической технологии и продукты целевого применения в разных отраслях народного хозяйства [11].
Промежуточные продукты. Многие вещества, почти не имеющие целевого применения в народном хозяйстве, производят главным образом для того, чтобы на их основе синтезировать другие ценные соединения. Это — промежуточные продукты органического синтеза. Так, основную массу 1,2-дихлорэтана производят для последующей переработки в винилхлорид:
+ Сl2
СН2=СН2 → С1СН2—СН2С1 → СН2=СНС1.
—HCI
То же самое относится ко многим другим хлорпроизводным, альдегидам, олефиноксидам и прочим продуктам.
Роль, масштабы производства и ассортимент промежуточных продуктов очень велики, так как синтез даже сравнительно простых, а тем более сложных органических соединений из парафинов, олефинов и других соединений протекает через ряд промежуточных стадий [1].
Мономеры и исходные вещества для полимерных материалов [1]. Их производство занимает одно из самых важных мест в основном органическом и нефтехимическом синтезе, обеспечивающем сырьем промышленность пластических масс, синтетического каучука, синтетических лаков, клеев, пленочных материалов, волокон.
Все синтетические полимеры получают двумя основными способами—полимеризацией и поликонденсацией. Для первой из , этих реакций требуются мономеры, т. е. вещества, способные под влиянием тепла, света, облучения или катализаторов соединяться друг с другом без выделения каких-либо низкомолекулярных соединений и давать длинные цепи полимера с теми же элементарными звеньями, как в исходном мономере:
X
I
n СН2=СНХ —► [—СН2—СН—]n
Сополимеризация двух или более разных мономеров дает полимеры, макромолекулы которых состоят из чередующихся в различном порядке звеньев исходных мономеров:
nХ + mY —> —X—Y—X—X—Y—X—Y—Y—X—X—X— и т. д.
При поликонденсации, как правило, выделяется низкомолекулярное вещество (Н20, HCI и др.), а состав образующихся полимеров отличается от состава взятых реагентов. Последние поэтому правильнее называть не мономерами, а исходными веществами для синтеза поликонденсационных полимеров. Чтобы
происходил непрерывный рост макромолекулы, исходные вещества должны иметь не менее двух функциональных групп, способных реагировать друг с другом. Так, при образовании полиэфиров взаимодействуют гидрокси- и карбоксигруппы.
Среди полимеризующихся мономеров наибольшее значение получили соединения с двойной углерод-углеродной связью. Hs таких мономеров отметим моноолефины (этилен, пропилен, изобутен), диены (бутадиен-1,3 и изопрен, являющийся основой при получении каучука) и стирол. Важны также виниловые и различные галогенсодержащие мономеры: винилацетат СН2=СН— ОСОСНз, винилхлорид СН2=СНС1, акриловые мономеры, например акрилонитрил CH2=CHCN, метилметакрилат СН2= С(СН3)СООСН3. Исходные вещества для поликонденсационных процессов принадлежат к разнообразным ди- и полифункциональным соединениям. Это — фосген СОС12, дикарбоновые кислоты, их ангидриды и хлорангидриды, а также ряд поликарбоновых кислот и их ангидридов, гликоли и полигликоли, диамины.
НОСН2—СН(ОН)—СН2ОН С(СН2ОН)4 H2N—(CH2)e—NH2
глицерин пентаэритрит гексаметилендиамин
Фенол, формальдегид, меламин, их гомологи и аналоги приобрели большое значение для производства фенолоальдегидных.. карбамино- и меламиноформальдегидных полимеров. Ряд дихлорпроизводных С1(СН2)2С1, кремнийорганических соединений R2SiCl2 и диизоцианатов OC=NRN=CO применяют для производства полисульфидов, силоксановых полимеров, полиуретанов.
При реакциях полимеризации и поликонденсации очень важное значение имеет чистота реагентов. Содержащиеся в них примеси могут ингибировать реакцию или обрывать рост цепи молекулы при полимеризации, нарушать нужное соотношение исходных веществ при поликонденсации, приводя к полимерам со слишком малой молекулярной массой и пониженными техническими показателями. В этом отношении к продуктам основного органического и нефтехимического синтеза предъявляют очень высокие требования, причем чистота мономеров нередко должна соответствовать содержанию основного вещества 99,8-— 99,9 % и более.
Пластификаторы и другие вспомогательные вещества для полимерных материалов. В производстве синтетических полимеров и изделий из них наряду с мономерами и исходными веществами большую роль играют пластификаторы и другие вспомогательные вещества, которые способствуют процессу синтеза или улучшают технические свойства получаемых полимеров и изделий.
Пластификаторами (или мягчителями) называют вещества, добавляемые к некоторым полимерам в количестве до 30—40 % для улучшения их пластических, эластических свойств. Это необходимо, во-первых, при переработке полимеров прессованием, вальцеванием и другими методами, для чего полимеры должны быть достаточно текучими, и, во-вторых, при эксплуатации готовых изделий, которые должны отличаться достаточной эластичностью, не растрескиваться при хранении и работе и т. п. Основные требования к пластификаторам — совместимость с полимером и низкая летучесть, определяющие качество изделий и длительность их службы без потери пластификатора.
Одной из важнейших групп пластификаторов являются высококипящие сложные эфиры, например дибутил- и диоктил-фталаты, трикрезилфосфат, некоторые эфиры высших спиртов с дикарбоновыми кислотами или высших карбоновых кислот с двухатомными спиртами. В качестве мягчителей для синтетических каучуков наряду с минеральными маслами применяют синтетические продукты — алкилароматические углеводороды, низшие полиолефины и др.
Промышленность основного органического и нефтехимического синтеза производит также другие вспомогательные вещества, используемые в технологии полимеров: инициаторы и катализаторы, ускоряющие полимеризацию, регуляторы и ингибиторы, ограничивающие рост цепи или вообще препятствующие полимеризации, стабилизаторы, позволяющие избежать разложения полимерных материалов при эксплуатации изделий.
Синтетические поверхностно-активные и моющие вещества [11]. Поверхностно-активные свойства появляются у органических веществ, содержащих в молекуле гидрофобную группу и наряду с ней гидрофильную (полярную) группировку, способную к сольватации водой. В обычном мыле — натриевой соли стеариновой или пальмитиновой кислоты RCOONa роль этих групп выполняют соответственно длинная углеводородная цепь и карбоксилатная группа.
Ввиду такой особенности строения поверхностно-активное вещество (ПАВ) концентрируется на поверхности раздела фаз, ориентируясь своей гидрофобной группой к масляно-жировому компоненту системы, а гидрофильной — к воде. В результате значительно уменьшается поверхностное натяжение, что способствует хорошему смачиванию материала и переходу загрязнений в воду. Поверхностно-активные вещества обладают также эмульгирующими и диспергирующими свойствами, пенообразующей способностью.
Поверхностно-активные и моющие вещества особенно широка применяют в быту для стирки тканей и изделий из них и чистки различных предметов. В текстильной промышленности их используют для обработки тканей перед крашением, для мойки шерсти и волокна, в машиностроении и металлообработке — при резании металлов, для очистки деталей от масел и механических загрязнений, в парфюмерной промышленности — как компоненты туалетного мыла и косметических средств. В химической технологии они служат эмульгаторами при гетерофазных реакциях (в особенности при эмульсионной полимеризации), для изготовления стабильных эмульсий пестицидов, используемых в. быту и сельском хозяйстве. Поверхностно-активные вещества все шире применяют при флотации руд, в производстве пенобетонов и других строительных материалов, в нефтяной промышленности, где использование ПАВ позволяет существенно повысить выработку месторождений.
Поверхностно-активные и моющие вещества разделяют на ионогенные и неионогенные, отличающиеся наличием или отсутствием групп, способных к диссоциации в водных растворах. Ионогенные вещества в свою очередь бывают анионо-и катионоактивными [11], в которых поверхностно-активные свойства определяются соответственно анионом или катионом, образующимся при диссоциации.
К анионоактивным веществам относятся наиболее важные промышленные моющие вещества, в том числе мыла — обычное и получаемое из синтетических жирных кислот (активная часть молекулы — группа RCOO-). Такие ПАВ имеют щелочную реакцию и способствуют разрушению тканей, дают с солями магния и кальция нерастворимые соли, что снижает их моющие свойства в жесткой воде, проявляют активность лишь при значительной концентрации в воде. Эти недостатки в значительной степени отсутствуют у современных синтетических анионоактивных веществ, большинство которых представляют собой натриевые соли органических сульфокислот и кислых эфиров серной кислоты. К их числу принадлежат алкиларенсульфонаты RC6H4S02ONa, алкилсульфонаты RS02ONa и алкилсульфаты ROS02ONa с алкильными группами С12—C18.
Катионоактивные моющие вещества имеют сравнительно-небольшое практическое значение. Они чаще всего представляют собой соли аминов или четвертичных аммониевых оснований, например соль алкилбензилтриметиламмония [RC6H4CH2N(CH3)3]+C1-
В последние годы начали все шире использовать неионогенные моющие вещества. Их синтезируют из этиленоксида и различных органических соединений — карбоновых кислот, спиртов, аминов и других веществ с активными атомами водорода. Гидрофильные свойства им придает оксиэтильная цепь, например R(OCH2CH2)nOH.
В целях улучшения моющих свойств и уменьшения расхода поверхностно-активное вещество смешивают с различными добавками; эти композиции называются моющими средствами (в отличие от моющих веществ). В их рецептуру (например, стиральных порошков) входят фосфат, пирофосфат или гексамета-фосфат натрия, силикат, сульфат и карбонат натрия, пербораты, карбоксиметилцеллюлоза (Целл. — OCH2COONa). Одни из них добавляют для создания слабощелочной среды или улучшения коллоидной структуры раствора, другие служат отбеливателями либо предотвращают обратное отложение загрязнений на ткани.
Поскольку поверхностно-активные вещества после их употребления попадают в сточные воды, важным требованием является высокая степень их биоразлагаемоcти, т. е. способности к окислению в безвредные вещества под влиянием микроорганизмов, находящихся в естественных водоемах. Это налагает определенные ограничения на строение входящего в состав ПАВ углеводородного остатка, который не должен быть разветвленным.
Синтетическое топливо, смазочные масла и добавки к ним. Многие продукты основного органического и нефтехимического синтеза имеют важное значение в автомобильном транспорте, авиации, ракетной технике и других областях. К ним относятся синтетические моторные и ракетные топлива, смазочные масла, присадки, улучшающие свойства топлив и масел, антифризы, препятствующие замерзанию охлаждающих жидкостей, тормозные и гидравлические жидкости [1].
В свое время органический синтез решил проблему получения углеводородов из СО и Н2, что позволило производить жидкое топливо из угля. Затем для двигателей внутреннего сгорания потребовалось высокооктановое топливо, и был осуществлен синтез изопарафинов, особенно изооктана (СН3)2СНСН2С(СНз)з. В качестве высокооктановых компонентов моторных топлив применяют изопропилбензол С6Н5СН(СН3)2, а в последнее время становятся перспективными метанол, грег-бутилметиловый эфир (СНз)зСОСН3 и др.
В настоящее время для синтетического топлива имеется новый потребитель — ракетная техника. В жидкостных ракетных системах используют синтетические горючие (метанол, этанол, этиламины, диметилгидразин, некоторые металлорганические соединения), имеющие существенные преимущества перед углеводородными горючими.
Смазочные масла до сих пор получают большей частью из нефти, однако развитие новой техники предъявляет все более высокие требования, которым минеральные масла не в состоянии удовлетворить. Эксплуатация двигателей в широком интервале температур (от —60 до 300°С и выше), возможность их запуска при низкой температуре, высокие нагрузки при большом числе оборотов потребовали создания синтетических смазочных масел. Они должны быть малолетучими, не вызывать коррозию металлов, не застывать при низкой температуре, достаточно противостоять окислению и термическому разложению. Ценным качеством смазочных масел является малая зависимость вязкости от температуры. К специальным маслам предъявляют требования высокой теплостойкости, обеспечивающей возможность длительной работы при 300—400°С.
Синтетические смазочные масла принадлежат к нескольким группам органических соединений, из которых важнейшими являются следующие: синтетические углеводороды (низшие полимеры олефинов и алкилированные ароматические углеводороды), сложные эфиры двухосновных карбоновых кислот и высших одноатомных спиртов, а также высших монокарбоновых кислот и многоатомных спиртов; высококипящие фторуглероды и фторхлоруглероды (в них атомы водорода полностью замещены на галоген); кремнийорганические полимеры с силоксано-вой связью Si—О—Si.
Все большее значение приобретают различные присадки, повышающие эксплуатационные качества топлив и масел и их стабильность при хранении. Антиокислительные присадки к топливу и смазочным маслам, а также к полимерам (например, алкилированные фенолы) замедляют цепные реакции автоокисления. Другие присадки понижают температуру застывания масел (депрессоры), улучшают их вязкостные свойства (вязкостные присадки), препятствуют коррозии металлов (ингибиторы коррозии) и т. д.
Растворители и экстрагенты. До недавнего времени выбор растворителей и экстрагентов был весьма ограничен — главным образом бензин, бензол и этанол. С развитием промышленности и всего народного хозяйства потребовались вещества с различной специфической растворяющей и экстрагирующей способностью по отношению к соединениям разных классов. Синтетические растворители должны, кроме того, был дешевыми, легко доступными и мало токсичными. Температура кипения их не должна быть слишком низка во избежание чрезмерных потерь и не должна быть слишком высока, чтобы их можно было регенерировать путем отгонки. В ряде случаев удалось синтезировать растворители с пониженной пожароопасностью и даже сов.сем негорючие.
В настоящее время растворители и экстрагенты применяют очень широко: для выделения ароматических углеводородов из продуктов переработки нефти, в процессах азеотропной и экстрактивной перегонки, для извлечения жиров и масел из природных веществ [1]. В химической промышленности их часто используют, например, для очистки и перекристаллизации, как абсорбенты газов и паров (ацетилена и летучих веществ, уносимых газами), при синтезе полимеров (особенно в лакокрасочной промышленности). В машиностроении и металлообработке растворителями обезжиривают и очищают детали. В сельском хозяйстве растворители нужны при употреблении пестицидов. При помощи экстрагентов-комплексообразователей выделяют соединения урана, редких и рассеянных элементов из руд.
Синтетические растворители и экстрагенты могут принадлежать к различным группам органических соединений. Это - хлорпроизводные углеводородов (тетрахлорметан, дихлорметан, три- и тетрахлорэтилен), спирты (этанол, пропанол, бутанолы, пентанолы), целлозольвы, простые эфиры (диэтиловый, диизо-пропиловый и высшие), кетоны (ацетон, метилэтилкетон, изо-бутилметилкетон), сложные эфиры (этил-, бутил- и пентилаце-тат), а также диметилформамид HCON(CH3)2, диметилсульфоксид (CH3)2SO и др.
Пестициды и химические средства защиты растений. Пестицидами (или ядохимикатами) называют вещества, обладающие токсичными свойствами по отношению к тем или иным живым организмам — от бактерий и грибков до растений и вредных животных. Значительная часть пестицидов применяется в сельском хозяйстве в качестве химических средств защиты растений; кроме того, их используют в быту, для борьбы с распространителями болезней и эпидемий, для уничтожения вредителей на складах, в трюмах кораблей, в жилых зданиях и т. д. Применение пестицидов в сельском хозяйстве позволяет избежать многих болезней полевых и садовых культур и значительно уменьшить потери урожая. В связи с этим химические средства защиты растений стали не менее важным фактором в повышении урожайности, чем химические удобрения [3].
Различают несколько групп пестицидов, оказывающих специфическое действие на различные живые организмы.
Фунгициды и бактерициды активны в отношении самых низших организмов — соответственно грибков и бактерий. В сельском хозяйстве их применяют для борьбы с различными болезнями культурных растений. Бактерициды, не токсичные для человека, используют в консервной промышленности, а другие (например, пентахлорфенол) — для консервации древесины, в медицине и других областях.
Инсектициды — одни из важнейших пестицидов; их используют для уничтожения вредных насекомых и их личинок. В отличие от инсектицидов, репелленты только отпугивают насекомых, например комаров, гнус.
Важную группу пестицидов составляют гербициды и дефолианты, действующие на растения. Гербициды используют для борьбы с сорняками, а дефолианты — для уничтожения лиственного покрова полезных растений в целях облегчения механизированной уборки урожая.
Зооциды — препараты для борьбы с теплокровными вредителями— грызунами (мышами, крысами, сусликами).
Очень важное требование к большинству пестицидов — строгая избирательность их действия. Так, гербициды, уничтожая
 сорняки, не должны влиять на полезные растения. Все химические средства защиты растений, как правило, должны быть мало токсичными в отношении человека, животных и птиц. Ценным их свойством является способность к постепенному разложению в природных условиях с образованием нетоксичных соединений.
сорняки, не должны влиять на полезные растения. Все химические средства защиты растений, как правило, должны быть мало токсичными в отношении человека, животных и птиц. Ценным их свойством является способность к постепенному разложению в природных условиях с образованием нетоксичных соединений.
Среди пестицидов имеются органические вещества многих классов: хлорпроизводные, азот- и серосодержащие соединения, производные кислот фосфора и др. Ассортимент и масштабы производства пестицидов непрерывно увеличиваются. Это объясняется открытием новых, более эффективных и избирательных или менее токсичных препаратов, а также необходимостью постоянно применять новые вещества, так как к длительно применяемым средствам постепенно вырабатывается иммунитет. Однако к выбору и использованию пестицидов следует относиться очень осторожно, поскольку возможны побочные эффекты и нарушения соответствия между различными организмами, существующего в природе.
Таким образом, основной органический и нефтехимический синтез, получая сырье от коксохимической и нефтеперерабатывающей промышленности, обеспечивает синтетическими продуктами все остальные отрасли органической технологии и, кроме того, поставляет народному хозяйству ряд продуктов целевого назначения. Основные сырьевые источники и продукты основного органического и нефтехимического синтеза и направления их использования в народном хозяйстве иллюстрирует рис. 1.
Ионные жидкости. Несмотря на существование широкого набора известных катализаторов, химическая технология и органический синтез постоянно нуждаются в новых, более эффективных и экологически приемлемых катализаторах, реакционных средах и растворителях. Достижения последних лет в химии расплавов солей, как правило, образованных органическими катионами, которые принято называть «ионными жидкостями» или «низкотемпературными расплавами солей», могут частично решить упомянутые выше проблемы. В состав ИЖ входит объемистый органический катион: 1,3-диалкилимидазолий (а), алкилам-моний (б), алкилфосфоний (в), N-алкилпиридиний (г) и др. и неорганический или органический анион [4].
Катионы:
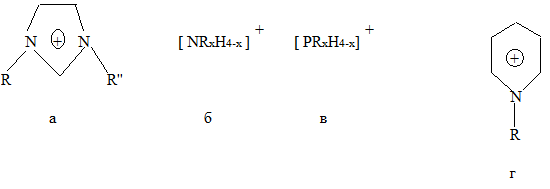
Анионы:
неорганические NO3ˉ , NO2ˉ , BF4ˉ , PF6ˉ , Cl ˉ , Brˉ , Iˉ , ClO4ˉ , SbF6ˉ;
органические CF3COOˉ, CF3SOˉ3, C3F7COOˉ, CH3COOˉ.
В начале 1980-х гг. ионными жидкостями назвали новый класс жидких при комнатной температуре веществ на основе расплавов солей. Вообще говоря, выбор комнатной температуры достаточно условен и к ионным жидкостям причисляют соли, которые плавятся и при более высокой температуре — до -100 °С, хотя известны ионные жидкости, остающиеся в жидком состоянии и при —80 °С. В отличие от молекулярных систем эти системы состоят, в основном, из ионов. Свойства и поведение таких жидкостей при использовании их в качестве растворителей или катализаторов (каталитических сред) сильно отличаются от свойств молекулярных жидкостей. Требования к свойствам растворителей обычно включают растворяющую или экстрагирующую способность, полярность, лиофильность, летучесть, вязкость.
В последние годы растет количество обзоров, публикаций и патентов, посвященных различным аспектам приготовления, исследования свойств и использования ионных жидкостей, в том числе и в катализ. Первая ионная жидкость [EtNH3]+[N03]- с температурой плавления 12 °С была получена российским ученым Паулем Вальденом в 1914 г. (в то время никто не называл ее ионной жидкостью). В период с 1940 по 1980 гг. были синтезированы ионные жидкости различных классов, а хлоралюминатные ионные жидкости достаточно подробно исследовались с точки зрения их использования для нанесения алюминиевых покрытий электрохимическим методом. Однако до 90-х годов систематические исследования ионных жидкостей практически не проводились. Также не исследовалась возможность их использования в качестве катализаторов или сред для каталитических процессов. С 1990 года интерес к ионным жидкостям стал расти ускоряющимися темпами [5].
Первые работы, посвященные низкотемпературным ионным жидкостям, были выполнены Остеръян-гом, Вилксом и Седдоном. Исторический экскурс в химию ионных жидкостей и первые их исследования, проводившиеся в Академии военно-воздушных сил США дан в работе Вилкса. Публикации, в которых ионные жидкости впервые использовались как реакционные среды или в качестве катализаторов для органического синтеза, появились в конце 80-х годов. Вначале кислые ионные жидкости рассматривали как эффективные катализаторы Фриде-ля—Крафтса, в то время как расплавы фосфониевых галогенидов успешно использовали для реакций нуклео-фильного замещения в ароматическом кольце.
Ионные жидкости являются уникальными объектами для химических исследований, использования их в катализе, органическом синтезе и других областях, включая биохимические процессы. Количество ионных жидкостей, описанных в литературе в настоящее время очень велико (около 300). Это и уже хорошо известные до 90-х годов ионные жидкости, в частности: пиридиниевые, имидазолиевые, полиалки-ламмониевые, и синтезированные относительно недавно: гуанидиниевые, пиперидиниевые, пирролие-вые, пирролидиниевые, морфолиниевые, холиниевые, пиперазиниевые, тиазолиевые и др. производные гетероциклических соединений; полициклические, ионные жидкости с мостиковыми структурами, биядерные или полиядерные, цвиттер-ионные, гидрофобные (фторированные), хиральные.
Хорошо известны следующие важные преимущества ионных жидкостей перед обычными органическими растворителями.
Широкий диапазон температур жидкого агрегатного состояния — около 300—400 градусов, от —80 °С до 350 °С. Для сравнения вода и органические растворители находятся в жидком состоянии в значительно более узком диапазоне — около 100 °С, а аммиак, в котором также проводят некоторые реакции, — лишь 44 °С. Это преимущество ионных жидкостей чрезвычайно важно для химической технологии.
Ионные жидкости являются хорошими растворителями для широкого круга неорганических, органических и полимерных материалов, высокополярными, но слабокоординирующими. Они негорючи, малотоксичны и удобны в использовании.
Для некоторых ионных жидкостей характерна кислотность по Бренстеду или Льюису, а также суперкислотные свойства, которые контролируются и варьируются в широких интервалах.
Ионные жидкости имеют очень низкое давление насыщенных паров и характеризуются высокой термической устойчивостью (многие устойчивы до 200 °С, а некоторые — и при более высоких температурах, до 450 °С).
В настоящее время существует достаточно большое количество публикаций, посвященных синтезу различных по составу и структуре ионных жидкостей, в том числе комбинаторному синтезу и скринингу ионных жидкостей в каталитических реакциях. Особо следует отметить патент фирмы Symyx, в котором описано большое число ионных жидкостей и обсуждается целый ряд каталитических реакций, в которых они могут быть использованы. Потенциально количество ионных жидкостей практически безгранично и лимитируется лишь доступностью подходящих органических молекул (катионные частицы) и неорганических, органических и металлокомплексных анионов. По различным оценкам количество возможных комбинаций катионов и анионов в таких ионных жидкостях может достигать 1018.
Другим практически важным направлением синтеза ионных жидкостей является их приготовление « in situ » непосредственно в реакторе. В этом случае соответствующий N-алкил галогенид и галогенид металла смешиваются в реакторе, и ионная жидкость образуется непосредственно перед запуском химического процесса или каталитической реакции.
В заключение следует констатировать, что ИЖ благодаря многообразию и особенностям своих свойств весьма привлекательны для катализа и органических синтезов.
Дата: 2019-02-02, просмотров: 989.