1. Окисление альдегидов:
Например, реакция «Серебряного зеркала» или окисление гидроксидом меди (II) – качественные реакции альдегидов
R-COH + [O] → R-COOH
2. Окисление спиртов:
R-CH2-OH + 2[O] t,kat → R-COOH + H2O
3. Гидролиз галогензамещённых углеводородов, содержащих три атома галогена у одного атома углерода.
R-CCl3 + 3NaOH → [R-C(OH)3] → R-COOH + 3NaCl + H2O
4. Из цианидов (нитрилов) – способ позволяет наращивать углеродную цепь:
СH3-Br + Na-C≡N → CH3-CN + NaBr
метилцианид ( нитрил уксусной кислоты )
СH3-CN + 2H2O t → CH3COONH4
ацетат аммония
CH3COONH4 + HCl → CH3COOH + NH4Cl
5. Использование реактива Гриньяра
R-MgBr + CO2 → R-COO-MgBr H2O → R-COOH + Mg(OH)Br
ПРИМЕНЕНИЕ КАРБОНОВЫХ КИСЛОТ
Муравьиная кислота – в медицине - муравьиный спирт (1,25% спиртовой раствор муравьиной кислоты), в пчеловодстве, в органическом синтезе, при получении растворителей и консервантов; в качестве сильного восстановителя. Применяется в текстильной промышленности в качестве протравы при крашении тканей, для дубления кож, а также для различных синтезов.
Уксусная кислота – в пищевой и химической промышленности. В домашнем хозяйстве как вкусовое и консервирующее вещество. Натуральный уксус содержит около 5% уксусной кислоты. Из него приготовляют уксусную эссенцию, используемую в пищевой промышленности для консервирования овощей, грибов, рыбы. Уксусная кислота широко используется в химической промышленности для различных синтезов (производство ацетилцеллюлозы, из которой получают ацетатное волокно, органическое стекло, киноплёнку; для синтеза красителей, медикаментов и сложных эфиров). .
Масляная кислота – для получения ароматизирующих добавок, пластификаторов и флотореагентов.
Щавелевая кислота – в металлургической промышленности (удаление окалины).
Стеариновая C17H35COOH и пальмитиновая кислота C15H31COOH – в качестве поверхностно-активных веществ, смазочных материалов в металлообработке.
Олеиновая кислота C17H33COOH – флотореагент и собиратель при обогащении руд цветных металлов.
Задания для СРС по теме « Альдегиды. Карбоновые кислоты».
1. Вычислите массу уксусного альдегида, который образовался из ацетилена, полученного из кальций карбида массой 711г, который содержит 10% примесей.
2. При сжигании 7,5г органического вещества образуется 4,5г водяных паров и 11г оксида углерода (IV). Найдите молекулярную формулу вещества и назовите его, если известно, что плотность его паров по водороду равна 15.
3. Окислили 2 моль метанола, а образовавшийся метаналь растворили в 200г воды. Вычислите содержание метаналя в растворе в процентах.
4. Составьте уравнения по приведенной схеме:
этилен → хлорэтан → етилен → ацетилен → этаналь.
5. Составьте уравнения реакций по данной схеме:
СН3Сl → С2Н6 → С2Н4 → С2Н5ОН → СН3СНО.
6. Составьте уравнения реакций по данной схеме:
этанол → этаналь → этан → этилен → полиэтилен.
7. Составьте уравнения реакций по данной схеме:
этан → этилен → этанол → уксусный альдегид → уксусная кислота.
8. Укажите вещество, которое образуется при взаимодействии альдегида с водородом
А) спирт; Б) кетон;
В) карбоновая кислота; Г) углерод (IV) оксид.
9. Обозначьте вещество, молекула которой содержит гидроксильную группу:
А) этаналь; Б) этанол; В) этан; Г) этен.
10. Установите соответствие веществ буквам в схеме превращений:
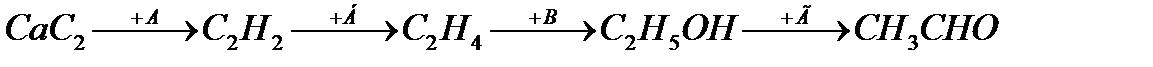
1) H2O; 2) СuО; 3) 2H2O; 4) H2; 5) КОН(спирт.).
11. Установите соответствие веществ буквам в схеме превращений:

1) СuО; 2) НВr; 3) КОН; 4) Аg2О; 5) Вr2.
12. Установите соответствие веществ буквам в схеме превращений:
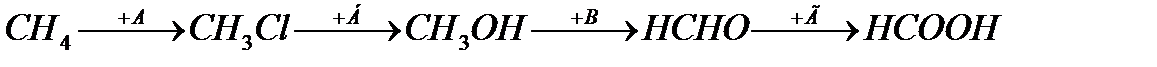
1) КОН; 2) Аg2О; 3)Сl2; 4) СuО; 5) НСl.
13. Установите соответствие веществ буквам в схеме превращений:

1) НСl; 2) Аg2О; 3) КОН; 4) Вr2; 5) СuО
Темы докладов и рефератов
| 1. Формальдегид, его применение в медицине 2. Ацетальдегид, свойства, применение. 3. Цитраль: применение в медицине. 4. Ацетон: строение, свойства, применение | 1. Ацетилсалициловая кислота: получение, применение. 2. Пировиноградная кислота. 3. Молочная кислота. 4. Лимонная кислота и ее соли. 5. Винная кислота. 6. Яблочная кислота. |
Литература:
1. Еремин, Кузьменко Химия-11. проф. уровень; М.: «Дрофа», 2009
2. Габриелян Химия 10 класс, проф. уровень; М: «Дрофа», 2012
Дополнительная информация
Ненасыщенные непредельные кислоты с одной двойной связью в молекуле имеют общую формулу CnH2n-1COOH.
Высокомолекулярные непредельные кислоты часто упоминаются диетологами (они называют их ненасыщенными). Самая распространенная из них –
олеиновая СН3–(СН2)7–СН=СН–(СН2)7–СООН или C17H33COOH. Она представляет собой бесцветную жидкость, затвердевающую на холоде. Особенно важны полиненасыщенные кислоты с несколькими двойными связями:
линолевая СН3–(СН2)4–(СН=СН–СН2)2–(СН2)6–СООН или C17H31COOH с двумя двойными связями,
линоленовая СН3–СН2–(СН=СН–СН2)3–(СН2)6–СООН или C17H29COOH с тремя двойными связями и
арахидоновая СН3–(СН2)4–(СН=СН–СН2)4–(СН2)2–СООН с четырьмя двойными связями; их часто называют незаменимыми жирными кислотами. Именно эти кислоты обладают наибольшей биологической активностью: они участвуют в переносе и обмене холестерина, синтезе простагландинов и других жизненно важных веществ, поддерживают структуру клеточных мембран, необходимы для работы зрительного аппарата и нервной системы, влияют на иммунитет. Отсутствие в пище этих кислот тормозит рост животных, угнетает их репродуктивную функцию, вызывает различные заболевания. Линолевую и линоленовую кислоты организм человека сам синтезировать не может и должен получать их готовыми с пищей (как витамины). Для синтеза же арахидоновой кислоты в организме необходима линолевая кислота. Полиненасыщенные жирные кислоты с 18 атомами углерода в виде эфиров глицерина находятся в так называемых высыхающих маслах – льняном, конопляном, маковом и др. Линолевая кислота C17H31COOH и линоленовая кислота C17H29COOH входят в состав растительных масел. Например, льняное масло содержит около 25% линолевой кислоты и до 58% линоленовой.
Сорбиновая (2,4-гексадиеновая) кислота СН3–СН=СН–СН=СНСООН была получена из ягод рябины (на латыни – sorbus). Эта кислота – прекрасный консервант, поэтому ягоды рябины не плесневеют.
Простейшая непредельная кислота, акриловая СН2=СНСООН, имеет острый запах (на латыни acris – острый, едкий). Акрилаты (эфиры акриловой кислоты) используются для получения органического стекла, а ее нитрил (акрилонитрил) – для изготовления синтетических волокон.
Называя вновь выделенные кислоты, химики, нередко, дают волю фантазии. Так, название ближайшего гомолога акриловой кислоты, кротоновой СН3–СН=СН–СООН, происходит вовсе не от крота, а от растения Croton tiglium, из масла которого она была выделена. Очень важен синтетический изомер кротоновой кислоты – метакриловая кислота СН2=С(СН3)–СООН, из эфира которой (метилметакрилата), как и из метилакрилата, делают прозрачную пластмассу – оргстекло.
Бензойная кислота известна человечеству очень давно. Первые упоминания об этом веществе относятся к шестнадцатому веку. Именно тогда ученым впервые удалось выделить бензойную кислоту из одноименной смолы методом сублимации. А в девятнадцатом веке немецкие химики исследовали это соединение более детально и сравнили свойства бензойной кислоты со свойствами гиппуровой кислоты. Противомикробное и противогрибковое действие бензойной кислоты послужило причиной того, что в двадцатом веке ее начали использовать в качестве пищевого консерванта при производстве продуктов питания. Физические и химические свойства бензойной кислоты Своим внешним видом бензойная кислота напоминает тонкие продолговатые листочки или иголочки белого цвета с характерным блеском. Она очень хорошо растворяется практически в любой среде: в жирах, спиртах и в обычной воде. Кроме того, при температуре свыше 122 градусов по Цельсию бензойная кислота расплавляется и переходит в газообразное состояние. Любой химик скажет вам, что это соединение относится карбоновым одноосновным кислотам ароматического ряда. Но нам больше интересно, каковы свойства бензойной кислоты, и не наносит ли она вреда человеческому здоровью. На этикетках продуктов питания она обозначается кодом Е210. В промышленных масштабах бензойную кислоту производят из толуола, методом окисления последнего. Раньше ее получали из фталевой кислоты или бензотрихлорида, но сейчас этот способ не актуален в силу дороговизны и сложности технологического процесса.
Что касается безопасности и натуральности, то бензойную кислоту можно назвать природным соединением, поскольку она присутствует в составе некоторых ягод (черники, брусники, клюквы), а также образуется в кисломолочных продуктах, таких, как йогурты или простокваша. Это не значит, что ее там так же много, как в некоторых консервированных продуктах заводского производства. Но, с другой стороны, это свидетельствует о том, что бензойная кислота не токсична и не опасна для человека, если употреблять ее в разумных количествах.
Применение бензойной кислоты Консервант Е210 активно используется пивоваренной, кондитерской и хлебопекарной промышленностью. Вот неполный список продуктов, выпускаемых с применением бензойной кислоты: Фруктовые соки и пюре; Варенья, джемы и повидла; Молочные продукты; Овощные консервы; Мороженое; Ликеры, пиво, вина; Конфеты и сахарозаменители; Соленая и маринованная рыба; Маргарин и масло; Жевательная резинка. Без применения бензойной кислоты не обходится и производство некоторых косметических средств.
Кроме того, ее добавляют в лекарственные препараты, например, в антисептические мази против чесотки. Фармацевтика интересуется бензойной кислотой не из-за консервирующих свойств. Это вещество прекрасно справляется с микробами, грибками и простейшими паразитами. Добавляют ее и в сиропы от кашля, поскольку она оказывает выраженное отхаркивающее действие, разжижает мокроту и помогает вывести ее из бронхов. Очень эффективны медицинские растворы для ножных ванночек с добавлением бензойной кислоты. С их помощью можно избавиться от потливости ног и грибковых поражений кожи.
Химическая промышленность тоже использует бензойную кислоту – в качестве основного реагента при производстве некоторых органических соединений.
Влияние бензойной кислоты на здоровье Когда бензойная кислота попадает в наш организм, она вступает в реакцию с белковыми молекулами и трансформируется в гиппуровую кислоту, а уже потом выводится наружу вместе с мочой. Разумеется, этот процесс представляет собой лишнюю нагрузку на выделительную систему, поэтому российским законодательством установлена предельно допустимая норма использования бензойной кислоты при производстве продуктов питания. Ее не должно быть больше, чем 5 миллиграммов на 1 килограмм готового продукта. Но о вреде бензойной кислоты обычно рассуждают не в контексте нагрузки на почки. Дело в том, что при определенных условиях из этого химического соединения может образовываться чистый бензол – опасное вещество, относящееся к канцерогенам, то есть провоцирующее развитие онкологических заболеваний. Но чтобы произошла такая реакция, необходима очень высокая температура. В организме человека выделение бензола из бензойной кислоты невозможно. Однако греть консервированные продукты, не предназначенные для этого, и употреблять их в таком виде не рекомендуется. Некоторые современные специалисты в области пищевой химии полагают, что при взаимодействии бензойной кислоты Е210 и аскорбиновой кислоты Е300 возможно возникновение нежелательных химических реакций с выделением бензола. Но для этого процесса также требуется особая среда с повышенной температурой. В любом случае, вы можете узнать из этикетки, есть ли такое сочетание веществ в конкретном продукте, и принять решение, покупать его или нет. Любителям кошек следует помнить, что для ваших питомцев бензойная кислота и ее соли крайне опасны сами по себе, даже в мизерных количествах. Поэтому прежде чем предлагать своей кошке какой-либо продукт со своего стола, убедитесь, что в его составе нет такого консерванта. Вообще это одна из многих причин, почему не стоит кормить домашних любимцев «человеческими» продуктами. Лучше покупать специальное питание или готовить для них пищу самим.
Дата: 2019-02-02, просмотров: 721.