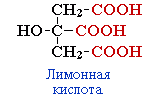Лекция №28 . Карбоновые кислоты: строение, свойства,получение, применение.
1. Карбоновые кислоты – это кислородсодержащие органически вещества, молекулы которых содержат одну или несколько карбоксильных групп (-СOOH), соединённых с углеродным радикалом или водородным атомом.
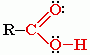
Карбоксильная группа содержит две функциональные группы – карбонил >С=О и гидроксил -OH, непосредственно связанные друг с другом:
 2. Классификация
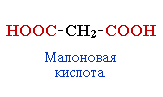
А) По числу карбоксильных групп в молекуле
2. Классификация
А) По числу карбоксильных групп в молекуле
Б) По природе углеводородного радикала
|
Изомерия
I . Структурная
А) Изомерия углеродного скелета (начиная с C4)
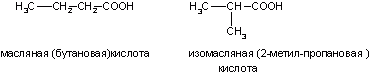
Б) Межклассовая со сложными эфирами R- CO – O- R1 (начиная с C2)
Например: для С3Н6О2
CH3-CH2-COOH пропионовая кислота
СH3-CO-OCH3 метиловый эфир уксусной кислоты
II . Пространственная
А) Оптическая
Например:
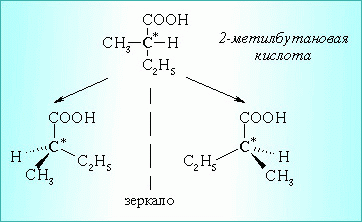
Б) Цис- транс – изомерия для непредельных кислот
Пример:
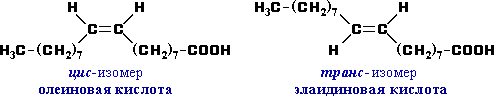
ПРЕДЕЛЬНЫЕ ОДНООСНОВНЫЕ КАРБОНОВЫЕ КИСЛОТЫ
CnH 2 n +1 - COOH или CnH 2 n O 2
Гомологический ряд
| Название | Формула кислоты | tпл. | tкип. | ρ | |
| кислоты | |||||
| муравьиная | метановая | HCOOH | 8,3 | 100,5 | 1,22 |
| уксусная | этановая | CH3COOH | 16,8 | 118 | 1,05 |
| пропионовая | пропановая | CH3CH2COOH | -21 | 141 | 0,99 |
| масляная | бутановая | CH3(CH2)2COOH | -6 | 164 | 0,96 |
Строение карбоксильной группы
Карбоксильная группа сочетает в себе две функциональные группы – карбонил >C=O и гидроксил -OH, взаимно влияющие друг на друга:
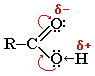
Кислотные свойства карбоновых кислот обусловлены смещением электронной плотности к карбонильному кислороду и вызванной этим дополнительной (по сравнению со спиртами) поляризации связи О–Н.
В водном растворе карбоновые кислоты диссоциируют на ионы:
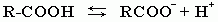
Растворимость в воде и высокие температуры кипения кислот обусловлены образованием межмолекулярных водородных связей.
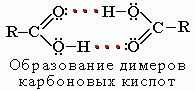
С увеличением молекулярной массы растворимость кислот в воде уменьшается.
II . Специфические свойства
1. Образование функциональных производных R-CO-X
(свойства гидроксильной группы)
Получение хлорангидридов:
R-COOH + PCl5 → R-CO-Cl + POCl3 + HCl
2. Образование амидов
CH3COOH + NH3→CH3COONH4 t˚C→ CH3CONH2 + H2O
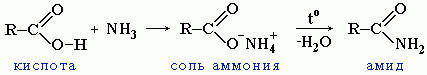
Вместо карбоновых кислот чаще используют их галогенангидриды:
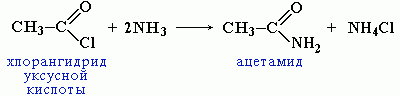
Амиды образуются также при взаимодействии карбоновых кислот (их галогенангидридов или ангидридов) с органическими производными аммиака (аминами):
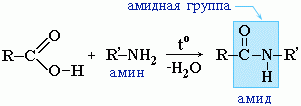
Амиды играют важную роль в природе. Молекулы природных пептидов и белков построены из a-аминокислот с участием амидных групп - пептидных связей
3. Реакции замещения с галогенами
(свойства углеводородного радикала, образуется а-хлорпроизводное карбоновой кислоты ):

|
5. Реакции декарбоксилирования солей карбоновых кислот (получение алканов):
R-COONa + NaOH t → Na2CO3 + R-H (алкан)
6. Окисление в атмосфере кислорода:
R-COOH + O2 → CO2 + H2O
Особенности муравьиной кислоты H - COOH :
Даёт реакцию «Серебряного зеркала»:
H-COOH + 2[Ag(NH3)2]OH → 2Ag↓ + (NH4)2CO3 + 2NH3 + H2O
Окисление хлором:
H-COOH + Cl2 → CO2 + 2HCl
Вступает в реакцию с гидроксидом меди(II):
H-COOH + 2Cu(OH)2 t → Cu2O↓ + CO2↑ + 3H2
Разлагается при нагревании:
HCOOH t,H2SO4→ CO↑ + H2O
Непредельные карбоновые кислоты способны к реакциям присоединения:
СН2=СН-СООН + Н2 → СН3-СН2-СООН
СН2=СН-СООН + Сl2 → СН2Сl-СНСl-СООН
СН2=СН-СООН + HCl → СН2Сl-СН2-СООН
СН2=СН-СООН + Н2O → НО-СН2-СН2-СООН
Две последние реакции протекают против правила Марковникова.
Непредельные карбоновые кислоты и их производные способны к реакциям полимеризации.
Получение карбоновых кислот
I. В промышленности
1. Выделяют из природных продуктов (жиров, восков, эфирных и растительных масел)
2. Окисление алканов:
2CH4 + 3O2 t,kat → 2HCOOH + 2H2O
метан муравьиная кислота
2CH3-CH2-CH2-CH3 + 5O2 t,kat,p → 4CH3COOH + 2H2O
н-бутан уксусная кислота
3. Окисление алкенов :
CH2=CH2 + O2 t,kat → CH3COOH
этилен
СH3-CH=CH2 + 4[O] t,kat → CH3COOH + HCOOH
пропен уксусная кислота муравьиная кислота
4. Окисление гомологов бензола (получение бензойной кислоты):
C6H5-CnH2n+1 + 3n[O] KMnO4,H+→ C6H5-COOH + (n-1)CO2 + nH2O
5C6H5-CH3 + 6KMnO4 + 9H2SO4 → 5C6H5-COOH + 3K2SO4 + 6MnSO4 + 14H2O
толуол бензойная кислота
5. Получение муравьиной кислоты:
1 стадия : CO + NaOH t,p → HCOONa
формиат натрия – соль
2 стадия : HCOONa + H2SO4 → HCOOH + NaHSO4
6. Получение уксусной кислоты:
CH3OH + CO t,p → CH3COOH
Метанол
II. В лаборатории
1. Гидролиз сложных эфиров:
OH-
R-COOR1 + H2O ↔ RCOOH + R1-OH
H+
2. Из солей карбоновых кислот:
R-COONa + HCl → R-COOH + NaCl
3. Растворением ангидридов карбоновых кислот в воде:
(R-CO)2O + H2O → 2 R-COOH
4. Щелочной гидролиз галоген производных карбоновых кислот:
R- C = O + NaOH → R-COOH + NaCl
│
Cl
Задания для СРС по теме « Альдегиды. Карбоновые кислоты».
1. Вычислите массу уксусного альдегида, который образовался из ацетилена, полученного из кальций карбида массой 711г, который содержит 10% примесей.
2. При сжигании 7,5г органического вещества образуется 4,5г водяных паров и 11г оксида углерода (IV). Найдите молекулярную формулу вещества и назовите его, если известно, что плотность его паров по водороду равна 15.
3. Окислили 2 моль метанола, а образовавшийся метаналь растворили в 200г воды. Вычислите содержание метаналя в растворе в процентах.
4. Составьте уравнения по приведенной схеме:
этилен → хлорэтан → етилен → ацетилен → этаналь.
5. Составьте уравнения реакций по данной схеме:
СН3Сl → С2Н6 → С2Н4 → С2Н5ОН → СН3СНО.
6. Составьте уравнения реакций по данной схеме:
этанол → этаналь → этан → этилен → полиэтилен.
7. Составьте уравнения реакций по данной схеме:
этан → этилен → этанол → уксусный альдегид → уксусная кислота.
8. Укажите вещество, которое образуется при взаимодействии альдегида с водородом
А) спирт; Б) кетон;
В) карбоновая кислота; Г) углерод (IV) оксид.
9. Обозначьте вещество, молекула которой содержит гидроксильную группу:
А) этаналь; Б) этанол; В) этан; Г) этен.
10. Установите соответствие веществ буквам в схеме превращений:
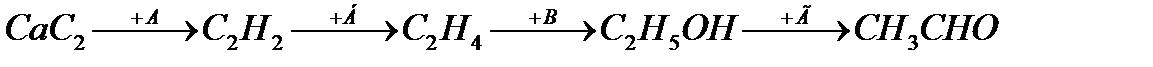
1) H2O; 2) СuО; 3) 2H2O; 4) H2; 5) КОН(спирт.).
11. Установите соответствие веществ буквам в схеме превращений:

1) СuО; 2) НВr; 3) КОН; 4) Аg2О; 5) Вr2.
12. Установите соответствие веществ буквам в схеме превращений:
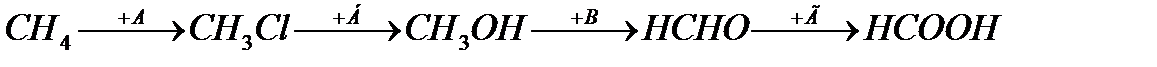
1) КОН; 2) Аg2О; 3)Сl2; 4) СuО; 5) НСl.
13. Установите соответствие веществ буквам в схеме превращений:

1) НСl; 2) Аg2О; 3) КОН; 4) Вr2; 5) СuО
Темы докладов и рефератов
| 1. Формальдегид, его применение в медицине 2. Ацетальдегид, свойства, применение. 3. Цитраль: применение в медицине. 4. Ацетон: строение, свойства, применение | 1. Ацетилсалициловая кислота: получение, применение. 2. Пировиноградная кислота. 3. Молочная кислота. 4. Лимонная кислота и ее соли. 5. Винная кислота. 6. Яблочная кислота. |
Литература:
1. Еремин, Кузьменко Химия-11. проф. уровень; М.: «Дрофа», 2009
2. Габриелян Химия 10 класс, проф. уровень; М: «Дрофа», 2012
Дополнительная информация
Ненасыщенные непредельные кислоты с одной двойной связью в молекуле имеют общую формулу CnH2n-1COOH.
Высокомолекулярные непредельные кислоты часто упоминаются диетологами (они называют их ненасыщенными). Самая распространенная из них –
олеиновая СН3–(СН2)7–СН=СН–(СН2)7–СООН или C17H33COOH. Она представляет собой бесцветную жидкость, затвердевающую на холоде. Особенно важны полиненасыщенные кислоты с несколькими двойными связями:
линолевая СН3–(СН2)4–(СН=СН–СН2)2–(СН2)6–СООН или C17H31COOH с двумя двойными связями,
линоленовая СН3–СН2–(СН=СН–СН2)3–(СН2)6–СООН или C17H29COOH с тремя двойными связями и
арахидоновая СН3–(СН2)4–(СН=СН–СН2)4–(СН2)2–СООН с четырьмя двойными связями; их часто называют незаменимыми жирными кислотами. Именно эти кислоты обладают наибольшей биологической активностью: они участвуют в переносе и обмене холестерина, синтезе простагландинов и других жизненно важных веществ, поддерживают структуру клеточных мембран, необходимы для работы зрительного аппарата и нервной системы, влияют на иммунитет. Отсутствие в пище этих кислот тормозит рост животных, угнетает их репродуктивную функцию, вызывает различные заболевания. Линолевую и линоленовую кислоты организм человека сам синтезировать не может и должен получать их готовыми с пищей (как витамины). Для синтеза же арахидоновой кислоты в организме необходима линолевая кислота. Полиненасыщенные жирные кислоты с 18 атомами углерода в виде эфиров глицерина находятся в так называемых высыхающих маслах – льняном, конопляном, маковом и др. Линолевая кислота C17H31COOH и линоленовая кислота C17H29COOH входят в состав растительных масел. Например, льняное масло содержит около 25% линолевой кислоты и до 58% линоленовой.
Сорбиновая (2,4-гексадиеновая) кислота СН3–СН=СН–СН=СНСООН была получена из ягод рябины (на латыни – sorbus). Эта кислота – прекрасный консервант, поэтому ягоды рябины не плесневеют.
Простейшая непредельная кислота, акриловая СН2=СНСООН, имеет острый запах (на латыни acris – острый, едкий). Акрилаты (эфиры акриловой кислоты) используются для получения органического стекла, а ее нитрил (акрилонитрил) – для изготовления синтетических волокон.
Называя вновь выделенные кислоты, химики, нередко, дают волю фантазии. Так, название ближайшего гомолога акриловой кислоты, кротоновой СН3–СН=СН–СООН, происходит вовсе не от крота, а от растения Croton tiglium, из масла которого она была выделена. Очень важен синтетический изомер кротоновой кислоты – метакриловая кислота СН2=С(СН3)–СООН, из эфира которой (метилметакрилата), как и из метилакрилата, делают прозрачную пластмассу – оргстекло.
Бензойная кислота известна человечеству очень давно. Первые упоминания об этом веществе относятся к шестнадцатому веку. Именно тогда ученым впервые удалось выделить бензойную кислоту из одноименной смолы методом сублимации. А в девятнадцатом веке немецкие химики исследовали это соединение более детально и сравнили свойства бензойной кислоты со свойствами гиппуровой кислоты. Противомикробное и противогрибковое действие бензойной кислоты послужило причиной того, что в двадцатом веке ее начали использовать в качестве пищевого консерванта при производстве продуктов питания. Физические и химические свойства бензойной кислоты Своим внешним видом бензойная кислота напоминает тонкие продолговатые листочки или иголочки белого цвета с характерным блеском. Она очень хорошо растворяется практически в любой среде: в жирах, спиртах и в обычной воде. Кроме того, при температуре свыше 122 градусов по Цельсию бензойная кислота расплавляется и переходит в газообразное состояние. Любой химик скажет вам, что это соединение относится карбоновым одноосновным кислотам ароматического ряда. Но нам больше интересно, каковы свойства бензойной кислоты, и не наносит ли она вреда человеческому здоровью. На этикетках продуктов питания она обозначается кодом Е210. В промышленных масштабах бензойную кислоту производят из толуола, методом окисления последнего. Раньше ее получали из фталевой кислоты или бензотрихлорида, но сейчас этот способ не актуален в силу дороговизны и сложности технологического процесса.
Что касается безопасности и натуральности, то бензойную кислоту можно назвать природным соединением, поскольку она присутствует в составе некоторых ягод (черники, брусники, клюквы), а также образуется в кисломолочных продуктах, таких, как йогурты или простокваша. Это не значит, что ее там так же много, как в некоторых консервированных продуктах заводского производства. Но, с другой стороны, это свидетельствует о том, что бензойная кислота не токсична и не опасна для человека, если употреблять ее в разумных количествах.
Применение бензойной кислоты Консервант Е210 активно используется пивоваренной, кондитерской и хлебопекарной промышленностью. Вот неполный список продуктов, выпускаемых с применением бензойной кислоты: Фруктовые соки и пюре; Варенья, джемы и повидла; Молочные продукты; Овощные консервы; Мороженое; Ликеры, пиво, вина; Конфеты и сахарозаменители; Соленая и маринованная рыба; Маргарин и масло; Жевательная резинка. Без применения бензойной кислоты не обходится и производство некоторых косметических средств.
Кроме того, ее добавляют в лекарственные препараты, например, в антисептические мази против чесотки. Фармацевтика интересуется бензойной кислотой не из-за консервирующих свойств. Это вещество прекрасно справляется с микробами, грибками и простейшими паразитами. Добавляют ее и в сиропы от кашля, поскольку она оказывает выраженное отхаркивающее действие, разжижает мокроту и помогает вывести ее из бронхов. Очень эффективны медицинские растворы для ножных ванночек с добавлением бензойной кислоты. С их помощью можно избавиться от потливости ног и грибковых поражений кожи.
Химическая промышленность тоже использует бензойную кислоту – в качестве основного реагента при производстве некоторых органических соединений.
Влияние бензойной кислоты на здоровье Когда бензойная кислота попадает в наш организм, она вступает в реакцию с белковыми молекулами и трансформируется в гиппуровую кислоту, а уже потом выводится наружу вместе с мочой. Разумеется, этот процесс представляет собой лишнюю нагрузку на выделительную систему, поэтому российским законодательством установлена предельно допустимая норма использования бензойной кислоты при производстве продуктов питания. Ее не должно быть больше, чем 5 миллиграммов на 1 килограмм готового продукта. Но о вреде бензойной кислоты обычно рассуждают не в контексте нагрузки на почки. Дело в том, что при определенных условиях из этого химического соединения может образовываться чистый бензол – опасное вещество, относящееся к канцерогенам, то есть провоцирующее развитие онкологических заболеваний. Но чтобы произошла такая реакция, необходима очень высокая температура. В организме человека выделение бензола из бензойной кислоты невозможно. Однако греть консервированные продукты, не предназначенные для этого, и употреблять их в таком виде не рекомендуется. Некоторые современные специалисты в области пищевой химии полагают, что при взаимодействии бензойной кислоты Е210 и аскорбиновой кислоты Е300 возможно возникновение нежелательных химических реакций с выделением бензола. Но для этого процесса также требуется особая среда с повышенной температурой. В любом случае, вы можете узнать из этикетки, есть ли такое сочетание веществ в конкретном продукте, и принять решение, покупать его или нет. Любителям кошек следует помнить, что для ваших питомцев бензойная кислота и ее соли крайне опасны сами по себе, даже в мизерных количествах. Поэтому прежде чем предлагать своей кошке какой-либо продукт со своего стола, убедитесь, что в его составе нет такого консерванта. Вообще это одна из многих причин, почему не стоит кормить домашних любимцев «человеческими» продуктами. Лучше покупать специальное питание или готовить для них пищу самим.
Лекция №28 . Карбоновые кислоты: строение, свойства,получение, применение.
1. Карбоновые кислоты – это кислородсодержащие органически вещества, молекулы которых содержат одну или несколько карбоксильных групп (-СOOH), соединённых с углеродным радикалом или водородным атомом.
Карбоксильная группа содержит две функциональные группы – карбонил >С=О и гидроксил -OH, непосредственно связанные друг с другом:
 2. Классификация
А) По числу карбоксильных групп в молекуле
2. Классификация
А) По числу карбоксильных групп в молекуле
Б) По природе углеводородного радикала
|
Изомерия
I . Структурная
А) Изомерия углеродного скелета (начиная с C4)
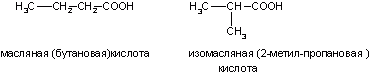
Б) Межклассовая со сложными эфирами R- CO – O- R1 (начиная с C2)
Например: для С3Н6О2
CH3-CH2-COOH пропионовая кислота
СH3-CO-OCH3 метиловый эфир уксусной кислоты
II . Пространственная
А) Оптическая
Например:

Б) Цис- транс – изомерия для непредельных кислот
Пример:
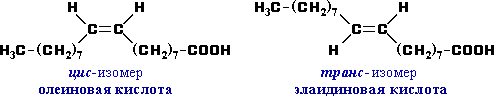
Дата: 2019-02-02, просмотров: 845.
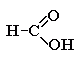 Метановая, муравьиная кислота
Метановая, муравьиная кислота
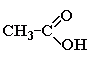 Этановая, уксусная кислота
Этановая, уксусная кислота