Минерализация воды характеризует содержание в ней растворённых солей в кг/м3, г/м3, г/л, мг/л. В пластовых водах всегда растворено некоторое количество (Q) солей. По степени минерализации пластовые воды делятся на четыре группы:
· рассолы (Q > 50 г/л);
· солёные (10 < Q < 50 г/л);
· солоноватые (1< Q < 10 г/л);
· пресные (Q £ 1 г/л).
Минерализация пластовой воды растёт с глубиной залегания пластов. Минерализация вод нефтяных месторождений колеблется от нескольких сотен г/м3 в пресной воде до 300 кг/м3 в концентрированных рассолах.
В пластовой воде содержатся ионы растворённых солей:
· анионы: OH–; Cl–; SO42–; CO32–; HCO3–;
· катионы: H+; K+; Na+; NH4+; Mg2+; Ca2+; Fe3+;
· ионы микроэлементов: I–; Br–;
· коллоидные частицы SiO2; Fe2O3; Al2O3;
· нафтеновые кислоты и их соли.
Больше всего в воде содержится хлористых солей, до 80–90 % от общего содержания солей.
В количественном отношении катионы солей пластовых вод располагаются в следующий ряд: Na+; Ca2+; Mg2+; K+; Fe3+.
Большое значение на растворимость солей и увеличение их концентрации в пластовых водах оказывают температура и парциальное давление СО2.
Максимальная растворимость СаСО3 в воде наблюдается при 0 оС, с возрастанием температуры она падает. Максимальная растворимость гипса (СаSО4·2Н2О) в воде наблюдается при 40 оС. С дальнейшим возрастанием температуры она уменьшается.
С увеличением парциального давления СО2 растворимость СаСО3 возрастает. Уменьшение пластового давления усиливает процесс выпадения солей СаСО3 и других. Изменение термобарической обстановки в пласте даже при небольшой минерализации пластовых вод влияет на растворимость солей и на процесс их выпадения.
Тип пластовой воды
По типу растворённых в воде солей различают хлоркальциевые (хлоркальциево-магниевые) и гидрокарбонатные (гидрокарбонатно-натриевые, щелочные) пластовые воды. Тип пластовой воды определяется анионом.
Гидрокарбонатный тип воды определяется солями угольной кислоты, обусловленный наличием карбонат-анионов ( 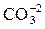 ), или бикарбонат-анионов (
), или бикарбонат-анионов ( 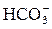 ). Соли всех остальных кислот относятся к хлоркальциевому типу. В основном это соли соляной или серной кислот и тип воды, обусловленный их наличием, характеризуется присутствием хлор-анионов (Cl–) и сульфат-анионов (
). Соли всех остальных кислот относятся к хлоркальциевому типу. В основном это соли соляной или серной кислот и тип воды, обусловленный их наличием, характеризуется присутствием хлор-анионов (Cl–) и сульфат-анионов ( 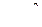 ).
).
Жёсткость пластовых вод
Соли пластовых вод влияют и определяют её жёсткость. Жёсткостью называется суммарное содержание растворённых солей двухвалентных катионов: кальция, магния и железа.
Жёсткость различают временную (карбонатную) и постоянную (некарбонатную). Временная жёсткость или карбонатная (Жк) обусловлена содержанием в воде карбонатов или гидрокарбонатов двухвалентных металлов: кальция, магния, железа.
Постоянная жёсткость или некарбонатная (Жнк) обусловлена наличием в воде сульфатов или хлоридов (или соли других кислот) двухвалентных металлов: кальция, магния, железа.
Общая жёсткость воды определяется как сумма карбонатной и некарбонатной:
Жо = Жк + Жнк . (5.1)
Жёсткость воды оценивается содержанием в ней солей в миллиграмм эквивалентах на литр 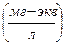 .
.
Жк, Жнк оценивают как сумму жесткостей всех i-ых ионов (∑gi):
Жо = Sgi. (5.2)
Жесткость иона оценивается отношением массы иона к его эквиваленту:
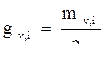 , (5.3)
, (5.3)
где mvi – концентрация i-го иона в воде (мг/л);
эi – эквивалент i-го иона.
Эквивалент иона оценивается отношением молекулярной массы иона (МI) к его валентности (n):
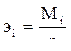 , (5.4)
, (5.4)
где Мi – молекулярная масса иона;
n – валентность иона.
Рассмотрим пример. В одном литре воды содержатся ионы в количестве: Mg+2 =21мг и Ca+2 = 56 мг.
Найти общую жесткость.
Решение. Определим жесткость воды, обусловленную наличием в воде ионов магния и кальция. Воспользуемся формулами (5.1–5.4):
Ж = G (мг-экв/л), g = m/э, э = M/n,
где M – масса иона;
n – валентность иона.
ММg = 24,3; эMg = 24,3/2 = 12,5 мг-экв;
МCa = 40,08; эCa = 40,08/2 = 20 мг-экв;
gMg = 21/12,15 = 1,72 мг-экв/л;
gCa = m/э = 56/20,04 = 2,79 мг-экв/л;
Жобщ = gMg + gCa = 2,79 + 1,728 = 4,5181 (мг-экв/л).
Природные воды в зависимости от содержания в них двухвалентных катионов кальция, магния, железа подразделяются на следующие группы:
· очень мягкая вода – до 1,5 мг-экв/л;
· мягкая вода – 1,5–3,0 м-экв/л;
· умеренно жёсткая вода – 3,0–6,0 мг-экв/л;
· жёсткая вода – более 6 мг-экв/л.
Жесткость пластовой воды и группа пластовой воды по жесткости определяются экспериментально-расчётным путём.
Временную (карбонатную) жёсткость можно устранить термическим методом, длительным кипячением или химическим методом – добавлением гидроксида кальция Са(ОН)2. В обоих случаях выпадает в осадок карбонат кальция СаСО3.
Постоянную жёсткость устраняют химическим способом с помощью добавления соды или щёлочи.
Дата: 2018-12-28, просмотров: 426.