Углеводородных газов
Как отмечалось выше, в нефтяной газ при нормальных и стандартных условиях входят углеводороды от С1 до С4: метан, этан, пропан, изобутан и н-бутан.
С точки зрения строения все они линейно построены, а потому это, так называемые, неполярные углеводороды.
С точки зрения химии, если в системе силами взаимодействия между молекулами можно пренебречь, то такую систему можно рассматривать как идеальную.
К газообразным углеводородам с точки зрения физики можно применять законы для идеальных систем.
С точки зрения термодинамики идеальным называется газ, внутренняя энергия которого зависит только от температуры и для которого справедливы равенства:
(∂Е/∂V)T = 0, z = Р·V/Q·R·T = 1, (2.4)
где Е – внутренняя энергия парообразования, Дж/моль;
z – коэффициент, характеризующий степень отклонения реального газа от закона идеального газа.
С точки зрения математики к расчёту физико-химических свойств газа, как многокомпонентной смеси можно применять принцип аддитивности.
Аддитивный подход к расчёту физико-химических и технологических параметров означает, что каждый компонент газа в смеси ведёт себя так, как если бы он в данной смеси был один.
Следовательно, для оценки макроскопических свойств нефтяного газа (при н.у. и с.у.) применимы аддитивные методы расчётов физико-химических и технологических параметров (Псмеси):
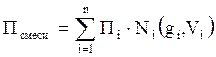 , (2.5)
, (2.5)
где Ni – мольная доля;
gi – весовая доля;
Vi – объёмная доля;
Пi – физико-химическое свойство i-го компонента.
Для идеальных газов общее давление в системе (смеси газов) равно сумме парциальных давлений компонентов (закон Дальтона):
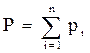 , (2.6)
, (2.6)
где Р – общее давление смеси газов;
рi – парциальное давление i-го компонента в смеси.
Откуда
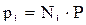 , (2.7)
, (2.7)
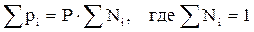 . (2.8)
. (2.8)
То есть, парциальное давление компонента в газовой смеси равно произведению его молярной доли на общее давление смеси газов.
Аддитивность парциальных объёмов (Vi) компонентов газовой смеси выражается законом Амага:
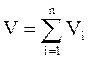 , (2.9)
, (2.9)
где V – общий объём смеси газов;
Vi – мольный объём i-го компонента газа в смеси.
По аналогии с уравнениями (2.7–2.8) мольный объём компонента в газе можно оценить:
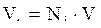 . (2.10)
. (2.10)
Как аддитивные величины рассчитывают все физико-химические свойства газа, например, плотность смеси газов:
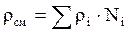 , (2.11)
, (2.11)
где ρi – плотность i–го компонента;
Ni – мольная доля i–го компонента.
Молекулярная масса смеси газовых компонентов рассчитывается по принципу аддитивности по выражению (2.12, левое выражение) для смесей, состав которых выражен в мольных или объёмных долях. Для смесей, состав которых выражен в массовых процентах по (2.12, правое выражение):
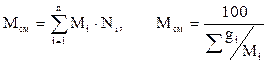 [u8] . (2.12)
[u8] . (2.12)
Рассмотрим пример. При приготовлении рекомбинированной пробы смешивают следующие объёмы (V) газов: 100 м3 пропана (C3H8), 75 м3 изобутана (i-С4Н10) и 75 м3 нормального бутана (n-С4Н10).
Дано: V i , м3 M i , г/моль
C3H8 100 44
i-C4H10 75 58
n-C4H10 75 58
Найти: чему равна молекулярная масса смеси газов (Мсм)?
Решение. Находим общий объём газовой смеси 100 + 75 + 75 = 250 (м3), и рассчитываем её объёмный состав в процентах:
250 м3 – 100 %,
100 м3 – Х %;
Х = 100·100/250 = 40 (%) или VC3H8 = 0,4 (в долях);
Аналогично, для → i-C4H10 – X % Þ
X = 75·100/250 = Vi-C4H10 = 30 % = 0,3 (в долях);
для → n-C4H10 – 30 % Þ Vn-C4H10 = 30 % = 0,3 (в долях).
Зная молекулярные массы газовых компонентов смеси (C3H8 → 44; C4H10 → 56) и, что Vi = Ni, рассчитываем величину молекулярной массы смеси газа (Mсм):
Mсм = SMi·Ni = 44·0,4 + 58·0,3 + 58·0,3 = 17,6 + 17,4·2 = 52,4 (г/моль).
Способы выражения состава
Нефтяной газ представлен в виде смеси углеводородов и неуглеводородных компонентов, поэтому для оценки его физико-химических свойств необходимо знать способы выражения состава смеси.
Массовая доля, весовой состав (gi) i-го компонента – величина, нормированная на 1 в долях или на 100 %. Она характеризует отношение массы i-го компонента (mi) в системе к общей массе системы:
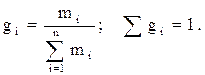 (2.13)
(2.13)
Молярная доля, мольный состав (Ni) i-го компонента – величина, нормированная на 1 в долях или на 100 %, характеризует отношение числа молей i-го компонента (ni) к общему числу молей компонентов в системе:
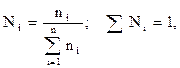
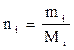 , (2.14)
, (2.14)
где mi – масса i-го компонента;
Мi – молекулярный вес i-го компонента.
Из соотношений (2.13–2.14) легко вывести выражения для пересчётов массового и мольного составов:
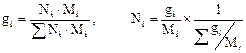 [u9] . (2.15)
[u9] . (2.15)
Объёмная доля i-го компонента – величина, нормированная на 1 или на 100 %, характеризует долю (Vi), которую занимает компонент в объёме системы. С учётом выражений (2.13–2.15) можно показать взаимосвязь объёмной доли с массовой и мольной долями:
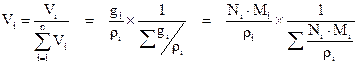 . (2.16)
. (2.16)
Для идеального газа соблюдается соотношение – объёмная доля компонента (Vi) равна мольной доли компонента (Ni) → Vi = Ni. Этот постулат есть следствие закона Авогадро.
Нефтяной газ рассматривается как идеальная система и его состав можно рассчитать на основе любых данных: масс компонентов, объёмов, плотностей, парциальных давлений и других величин.
Рассмотрим пример.
Дан объёмный состав нефтяного газа (Vi, %): CH4 – 61,3 %;
C2H6 – 15,4 %; C3H8 – 12,1 %; ∑C4H10 – 6,8 %; ∑C5H12 – 4,4 %.
Найти: какой будет массовый состав (gi, в долях) газа?
Решение. Для идеального газа величины объёмных (Vi) и мольных (Ni) долей равны. Для расчета состава газа в массовых долях воспользуемся выражением (2.6).
Учитывая молекулярные массы (г/моль) компонентов нефтяного газа: CH4 – 16; C2H6 – 30; C3H8 – 44; C4H10 – 58; C5H12 – 72, находим: gCH4 = 61,3·16/(61,3·16 + 15,4·30 + 12,1·44 + 6,8·58 + 4,4·72) =
980,8/2686,4 = 0,365;
gC2H6 = 15,4·30/2686,4 = 0,172;
gC3H8 = 12,1·44/2686,4 = 0,198;
gC4H10 = 6,8·58/2686,4 = 0,147;
gC5H12 = 4,4·72/2686,4 = 0,118.
Сумма всех долей массового состава равна 1.
Уравнение состояния
Для определения многих физических свойств природных газов используется уравнение состояния.
Уравнением состояния называется аналитическая зависимость между параметрами, описывающими изменение состояние вещества. В качестве таких параметров используются давление, температура, объём. Состояние газа при нормальных и стандартных условиях описывается уравнением Менделеева–Клапейрона:
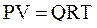 , (2.17)
, (2.17)
где Р – абсолютное давление, Па;
V – объём, м3;
Q – количество вещества, моль;
Т – абсолютная температура, К;
R – универсальная газовая постоянная, Па×м3/(моль×град).
На основе уравнения состояния газа можно рассчитывать многие параметры нефтяного газа: плотность, мольный объём, количество молекул, число молекул, парциальные давления и другие, если рассматривать количество вещества в уравнении состояния газа (2.17), равное 1 молю (Q = 1 моль).
С учётом этого, уравнение состояния газа можно преобразовать следующим образом:
Р·V = ∑N·R·T. (2.18)
Если сумма молей равна единице (∑N = 1 моль), следует, что уравнение приобретает вид Þ Р·V = R·T.
Зная, что масса (m) одного моля идеального газа равна его молекулярной массе (М), умножив левую и правую части на молекулярную массу и массу газа, соответственно, получим:
Р·V·M = m·R·T. (2.19)
Поделив обе части на V·R·T и преобразовав (2.19), получим выражение для расчёта плотности:
Р·M/R·T = m/V, m/V = M·Р/R·T, r = M·Р/R·T. (2.20)
Рассмотрим пример.
Дан один моль метана CH4.
Найти: какова будет плотность метана при н.у. и с.у.?
Решение. Зная, что молекулярная масса метана равна 16,04 г/моль и один моль метана занимает объём при н.у. 22,414 л, а при с.у. 24,055 л, находим:
rCH4 (н.у.) = 16,04/22,414 = 0,716 (г/л);
rCH4 (с.у.) = 16,04/24,055 = 0,665 (г/л).
Из выражения (2.20) и расчётов следует, что плотность газа с возрастанием давления будет расти, а с возрастанием температуры уменьшаться.
Плотность смеси газовых компонентов рассчитывают с учётом средней молекулярной массы смеси газа (Mсм) как отношение молекулярной массы смеси газа к его мольному объёму (Vм).
Например, для нормальных условий плотность газа будет рассчитываться по выражению:
rсм = Mсм /22,414. (2.21)
Если плотность газа (ρо) задана при атмосферном давлении, равном 0,1013 МПа, то пересчёт её величины с учётом другого давления (Р) при той же температуре для идеального газа выполняется по формуле:
r = rо∙Р/Ратм. (2.22)
Рассмотрим другой пример.
Плотность метана при н.у. равна 0,716 кг/м3. Определить плотность метана (СН4) при избыточном давлении, например при давлении 500 кПа и температуре 0 °С.
Решение. В этом случае общее давление (1 атм = 101,325 кПа) в системе будет равно Р = (500 + 101,325) = 601,325 кПа.
Зная, что молекулярная масса метана = 16,04 г/моль (кг/кмоль), универсальная газовая постоянная (R) = 8,314 Дж/(К·моль), температура (T) = 273,15 К, находим плотность метана по (2.20 и 2.22):
rCH4 = Р·М/R·T = 601,325·16,04/8,314·273,15 = 4,25 (кг/м3),
rCH4 = rо·Р/Рат = 0,716·601,325/101,325 = 4,25 (кг/м3).
Относительная плотность газов величина, рассчитанная по отношению к плотности воздуха, определенного при тех же условиях:
rосм = rсм /rвозд. (2.23)
Плотность воздуха (ρвозд) при н.у. равна » 1,293 кг/м3, а при с.у. » 1,189 кг/м3.
Рассмотрим пример.
Для условий задачи, рассмотренной выше (пример раздела 2.2), рассчитать абсолютные (r) и относительные (ρосм) плотности смеси газов, используя правое выражение (2.12) для расчета молекулярной массы (г/моль):
Мсм = 100/(36,5/16 +17,2/30 +19,8/44 +14,7/58 +11,8/72) = 26,874;
rсм = 26,874/22,414 = 1,119 (кг/м3);
ρосм (н.у.) = 1,119/1,293 = 0,927.
Аналогично из (2.20) находится и выражение для мольного объёма:
V = R·T/Р. (2.24)
Мольный объём при давлениях, равных или близких атмосферному и, для физических процессов, когда не происходит изменения числа молей в системе, оценивается соотношением:
V = R·T, (2.25)
где R – универсальна газовая постоянная;
Т – температура, К.
Рассмотрим пример.
Найти вид зависимости изменения мольного объёма газа от температуры → V = f(T).
Решение. Воспользуемся выражением (2.25) и получим объём, занимаемый одним молем идеального газа для условий задачи:
Vн.у. = 0,08206·273,15 = 22,414 (м3,);
Vс.у. = 0,08206·293,15 = 24,055 (м3).
Любой газ при н.у. (Т = 0 оС и Р = 100 кПа, 760 мм рт. ст.) занимает объём, равный 22,414 м3, а при с.у. (Т = 20 оС и Р = 100 кПа) занимает объём равен 24,055 м3.
С увеличением температуры мольный объём газа увеличивается. Мольный объём газов с возрастанием температуры будет расти, а с возрастанием давления уменьшаться (2.24).
У этого уравнения есть свои граничные условия. Оно справедливо для описания поведения газов при давлениях, близких к атмосферному (от 0,1 до 1,0–1,2 МПа), и при температурах ≈ 0–20 оС. При повышенном давлении газ сжимается и его состояние отличается от поведения идеальных газов.
Состояние реальных газов
При повышенных давлениях поведение нефтяного газа отклоняется от законов идеальных систем. Поведение реальных газов характеризуется межмолекулярным взаимодействием, молекулы газов начинают притягиваться друг к другу за счёт физического взаимодействия.
Для учёта этого взаимодействия уравнение (2.17) на протяжении многих лет модифицировалось голландским физиком Ван-дер-Ваальсом и другими.
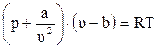 , (2.26)
, (2.26)
где a, b – коэффициенты;
u – молекулярный объём.
Коэффициенты a, b учитывают силы взаимодействия молекул и объём, занимаемый молекулами.
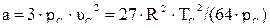 ;
; 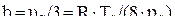 . (2.27)
. (2.27)
На основе уравнения (2.26) были качественно предсказаны многие закономерности термодинамического поведения реального газа – фазовые переходы, критические явления, эффект Джоуля–Томсона и другие. В количественном отношении уравнение Ван-дер-Ваальса обладало существенными недостатками. Широкое применение в последнее время нашли его модификации и, в частности для углеводородных систем уравнение Пенга–Робинсона (1975 г.)
Однако в инженерной практике для реальных газов используется уравнение Менделеева–Клапейрона, содержащее коэффициент сверхсжимаемости z, предложенный Д. Брауном и Д. Катцом и, учитывающий отклонения поведения реального газа от идеального состояния:
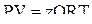 , (2.28)
, (2.28)
где Q – количество вещества, моль;
z – коэффициент сверхсжимаемости газа.
Физический смысл коэффициента сверхсжимаемости заключается в расширении граничных условий для высоких давлений уравнения Менделеева–Клапейрона.
Коэффициент z зависит от давления и температуры, приведенных критических давлений и температур, природы газа:
z = f (Тприв, Рприв), (2.29)
где Тприв – приведенная температура;
Рприв – приведенное давление.
Приведёнными параметрами индивидуальных компонентов называются безразмерные величины, показывающие, во сколько раз действительные параметры состояния газа: температура, давление, объём, плотность и другие больше или меньше критических.
Тприв = Тпл/Тср. кр; Рприв = Рпл/Рср. кр; Vприв = Vпл/Vср. кр. (2.30)
А для смесей газов они характеризуют отношения действующих (реальных) параметров (температура, давление и др.) к среднекритическим параметрам смеси:
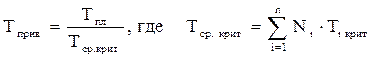 , (2.31)
, (2.31)
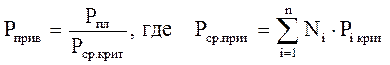 (2.32)
(2.32)
Критическая температура (Ткр) – максимальная температура, при которой газ и жидкость могут ещё сосуществовать в равновесии (табл. 2.4).
Критическое давление – давление паров вещества при критической температуре (табл. 2.4), а объём вещества, отнесённый к 1 молю или к единице массы вещества, называется критическим удельным объёмом.
Таблица 2.4
Дата: 2018-12-28, просмотров: 588.