Закона Бугера - Ламберта – Бера
1. Закон Бера справедлив для разбавленных растворов. При высоких концентрациях (> 0,01 М) среднее расстояние между частицами поглощающего вещества уменьшается до такой степени, что каждая частица влияет на распределение заряда соседних частиц, что, в свою очередь, может изменить способность частиц поглощать излучение данной длины волны.
2. Коэффициент e в уравнении (12) зависит от показателя преломления среды. Увеличение концентрации раствора приводит к значительному изменению показателя преломления n и отклонению от закона Бера (показатели преломления разбавленных растворов и растворителя отличаются несущественно).
3. Закон справедлив для монохроматического излучения. Строго говоря, уравнение (12) следует записывать в виде:
Аl = el · l · С (13)
Индекс l указывает, что величины А и e относятся к монохроматическому свету с длиной волны l. Немонохроматичность светового потока связана с несовершенством оптических приборов. Отклонение от закона Бера менее заметно, если длина волны не приходится на часть спектра с резким изменением оптической плотности. На практике измерение А стремятся проводить в максимуме светопоглощения.
4. Температура при измерениях должна оставаться постоянной хотя бы в пределах нескольких градусов.
5. Пучок света должен быть параллельным.
6. Уравнение (13) соблюдается для систем, в которых светопоглощающими центрами являются частицы одного сорта, т.е. отсутствует химическое взаимодействие.
Если при изменении концентрации будет меняться природа этих частиц, вследствие, например, кислотно - основного взаимодействия, полимеризации, диссоциации и т. д., то зависимость А = f ( C ) не будет линейной, т. к. молярный коэффициент поглощения вновь образующихся и исходных частиц не будет одинаковым.
Ограничения 1 и 2 являются истинными, остальные называют кажущимися; ограничения (3 - 5) зависят от условий проведения эксперимента, их связывают с инструментальными причинами. Последнее из ограничений вызвано химическими причинами.
При выполнении закона Бера график зависимости оптической плотности от концентрации представляет собой прямую, проходящую через начало координат (рис. 4.3),
Рис. 3. Зависимость оптической плотности вещества от концентрации при соблюдении основного закона светопоглощения. 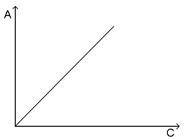
а функция Аl = f(l) имеет один и тот же вид независимо от толщины слоя и концентрации раствора, и положение максимума поглощения сохраняется (рис. 4).
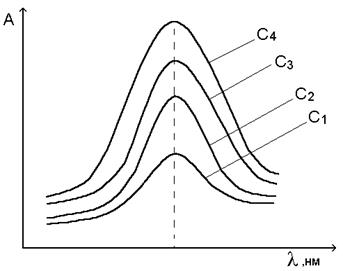
Зависимость оптической плотности от длины волны
Рис. 4. Кривая светопоглощения одного и того же вещества при соблюдении закона Бугера -Ламберта - Бера. С1 < С2 < С3 < С4.
Спектры поглощения
Графическое изображение распределения поглощаемой энергии по длинам волн называется спектром поглощения. Способы представления спектра различны в зависимости от величин, откладываемых по осям координат (рис.5).
Количество поглощенной световой энергии выражают величинами Т (коэф. пропускания), А (оптич. плотность), e. Выбор той или иной величины определяется областью спектра, величиной поглощения, задачами исследования и т.п.
В видимой и УФ - областях спектра обычно используют координаты A = f ( l ) или lg A = f ( l ), e = f ( l );
 в ИК - спектроскопии предпочитают представлять спектры в координатах Т = f (n).
в ИК - спектроскопии предпочитают представлять спектры в координатах Т = f (n).
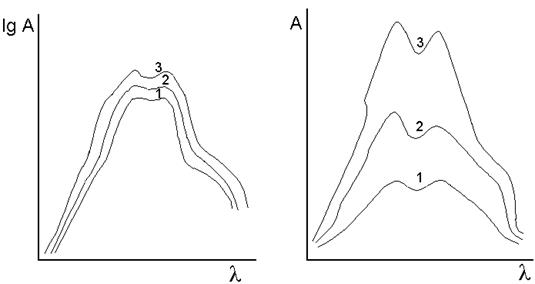
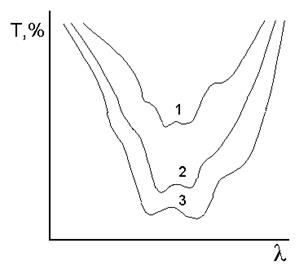
Рис. 5. Способы представления спектров поглощения одних и тех же растворов. (С1 : С2 : C3 = 1 : 2 : 3 ).
Основные характеристики спектра. Участок спектра, на котором наблюдается интенсивное поглощение излучения называют полосой поглощения. Наибольший интерес для анализа представляют следующие характеристики спектра: число максимумов (полос поглощения), их положение по шкале длин волн, высота максимума (значение молярного коэффициента e в максимуме поглощения), интенсивность полосы поглощения, ширина и форма полосы (рис.6.).
Ширину полосы поглощения принято характеризовать величиной 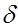 - полуширина полосы поглощения; ее измеряют при e = 1/2 emax.
- полуширина полосы поглощения; ее измеряют при e = 1/2 emax.
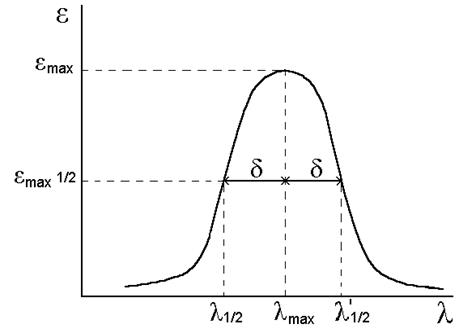
Рис.6. Полоса поглощения
Для аналитической практики имеет значение не столько интегральное поглощение, сколько поглощение при определенной длине волны, поэтому при характеристике полос используют значение молярного коэффициента в максимуме поглощения - emax.
Очевидно, чем выше e max и меньше ширина полосы, тем выше чувствительность определения данного вещества.
Слайд УФ спектр
Типы спектров поглощения
Молекулярная абсорбционная спектроскопия наблюдает изменения энергетического состояния молекул при поглощении излучения.
Из возможных видов движения молекулы - вращения частицы как целого, колебания ядер и возбуждения электронов - особенно большое аналитическое значение имеют два последних.
Колебательные спектры
 Спектры, соответствующие колебательным переходам, наблюдают в инфракрасной области (n ~ 102 ÷ 5·103 см -1), Волновое число, что соответствует энергии квантов от 3 до 60 кДж / моль. Количество возможных колебаний зависит от числа атомов в молекуле; число наблюдаемых колебаний обусловлено симметрией молекул.
Спектры, соответствующие колебательным переходам, наблюдают в инфракрасной области (n ~ 102 ÷ 5·103 см -1), Волновое число, что соответствует энергии квантов от 3 до 60 кДж / моль. Количество возможных колебаний зависит от числа атомов в молекуле; число наблюдаемых колебаний обусловлено симметрией молекул.
Многоатомные молекулы
Нормальные колебания молекул. Колебания в двухатомной молекуле происходят только вдоль линии, соединяющей ядра. Молекула, состоящая из N атомов, обладает 3N степенями свободы движения. Из них 3 степени свободы приходятся на поступательное движение, остальные (3N - 3) - на вращение и колебание молекулы. Число вращательных и колебательных степеней свободы определяется геометрией молекулы. Линейная молекула имеет 3N - 5 колебательных степеней свободы, нелинейная - (3N - 6).
Число колебательных степеней свободы равно числу нормальных колебаний молекулы. Частоты нормальных колебаний характеризуются положением полос в ИК - спектрах, а амплитуда колебаний определяет интенсивность полос.
Колебания могут происходить или вдоль валентных связей атомов с изменением расстояния между ядрами, или с изменением валентного угла между связями при постоянном межъядерном расстоянии, соответственно, валентные n и деформационные d колебания. Для изменения межъядерного расстояния нужна большая энергия, чем для изменения валентного угла, поэтому деформационным колебаниям всегда соответствует более длинноволновая часть спектра, чем валентным колебаниям. Отдельные виды колебаний можно наблюдать только в небольших и простых молекулах. В сложных молекулах валентным колебаниям всегда сопутствуют деформационные, и наоборот.
Типы возможных нормальных колебаний молекулы воды приведены на рис. 8.
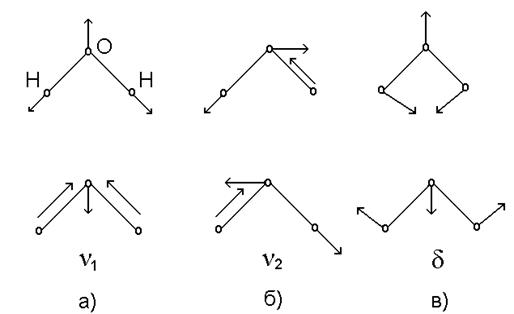
Рис. 8. Формы нормальных колебаний молекулы Н2О:
а) симметричные валентные колебания; б) антисимметричные валентные колебания; в) деформационные колебания.
Смещения атомов при колебаниях трехатомных молекул для разных типов колебаний
 |
Характеристические частоты. Экспериментально показано, что многочисленные структурные группы, такие, как СН3, С = С, С = О, Р = О и др., поглощают почти при постоянных длинах волн независимо от молекулы, в которой они содержатся. Соответствующие этому поглощению частоты называют характеристическими или групповыми. Они служат для определения в молекуле определенных функциональных групп.
Таблица 7. Типичные области частот колебаний функциональных групп
| Функциональная группа | ν, см-1 | Интенсивность |
| О-Н | 3200-3650 | Переменная |
| N-Н | 3300-3500 | средняя |
| С-О | 1050-1300 | сильная |
| С=О | 1690-1760 | сильная |
| NО2 | 1300-1370 | сильная |
Строго локализованные групповые частоты представляют предельный идеальный случай. На практике приходится учитывать влияние радикалов - ближнее взаимодействие или влияние окружающей среды (например, агрегатного состояния, растворителя, условий регистрации) - дальнее взаимодействие.
Характеристические частоты сведены в так называемые корреляционные таблицы, которые широко используются в прикладной спектроскопии для определения строения молекул и проведения качественного анализа по ИК - спектрам.
Дата: 2018-12-21, просмотров: 806.