Тема 8
Характеристики электромагнитного излучения
Электромагнитное излучение имеет двойственную природу. В одних проявлениях ведет себя как физическое поле с непрерывными свойствами (преломление, интерференция, дифракция, отражение, рассеяние), которые описываются на основе волновой природы излучения. В других случаях электромагнитное излучение проявляет себя как поток дискретных частиц (квантов), и такие явления, как испускание и поглощение атомами и молекулами, описываются на основе корпускулярной природы излучения.
Для описания волновых свойств электромагнитное излучение удобно представить в виде электрического силового поля, колеблющегося перпендикулярно направлению распространения волны (рис. 1).
К волновым характеристикам излучения относятся частота колебаний, длина волны и волновое число, к квантовым - энергия квантов.
Частота n показывает число колебаний электрического поля в 1с, измеряется в герцах (1 Гц = 1с -1). Частота определяется источником излучения.
Длина волны l показывает наименьшее расстояние между точками, колеблющимися в одинаковых фазах. Это линейная единица, в системе СИ измеряется в метрах (м) и его долях.
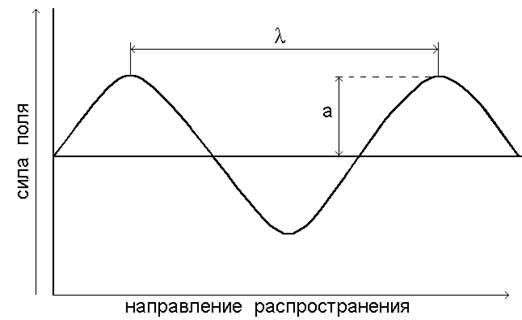
Рис. 1.Электромагнитная волна: l - длина волны, а - амплитуда.
Произведение частоты и длины волны представляет собой скорость излучения (см / с):
C = l ·n (1)
При переходе из вакуума в другую среду скорость распространения уменьшается. То же происходит с длиной волны, поскольку частота излучения неизменна.
 Волновое число n показывает число волн, приходящихся на 1 см. Если длина волны выражена в см, то
Волновое число n показывает число волн, приходящихся на 1 см. Если длина волны выражена в см, то
n  = 1/ l (см -1) (2)
= 1/ l (см -1) (2)
Энергия электромагнитного излучения Е зависит от частоты излучения и определяется соотношением:
E = h n (3)
где h - постоянная Планка, равная 6,62 · 10 -34 Дж·с.
Электромагнитный спектр
Совокупность всех частот (длин волн) электромагнитного излучения называют электромагнитным спектром. В зависимости от длины волны в электромагнитном спектре выделяют следующие участки (рис.2):
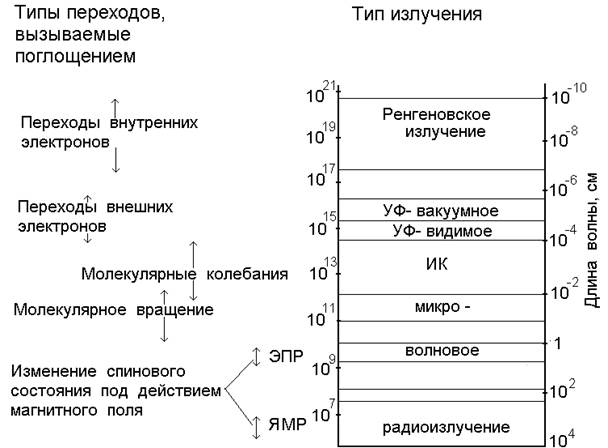
Рис.2. Области электромагнитного спектра
Протяженность отдельных областей спектра ограничивается либо способом получения излучения, либо возможностями его регистрации. Особо четкие границы можно установить для видимого света. Протяженность ультрафиолетовой (УФ) области в сторону более коротких волн резко ограничена: l = 200 нм. Ниже этого значения начинается поглощение УФ - излучения воздухом, поэтому исследования в области l < 200 нм возможны только в вакууме (так называемый вакуумный ультрафиолет). Границы между другими областями спектра менее четкие, и сами эти области частично перекрываются.
В отдельных областях спектра используют различные единицы измерения длин волн и частоты. В области радио - и микроволн для измерения частот используют герцы, килогерцы, мегагерцы. Однако, при частотах выше 10 - 12 Гц (инфракрасная область - ИК) точность измерения частот по сравнению с точностью измерения длин волн становится неудовлетворительной. Кроме того, пропорциональность между энергией и величиной, обратной длине волны, позволяет быстро оценить энергетические характеристики, поэтому вместо частоты или длины волны удобнее использовать волновое число.
Поток фотонов с одинаковой частотой называют монохроматическим, с разными частотами - полихроматическим. Обычный наблюдаемый поток излучения от раскаленных тел, в частности, солнечный свет, является полихроматическим.
Происхождение молекулярных спектров
При прохождении излучения через прозрачный слой твердого тела, жидкости или газа происходит селективное поглощение излучения с определенными частотами. Электромагнитная энергия в этом случае передается атомам или молекулам вещества и переводит поглощающие частицы из нормального состояния, или основного, в возбужденное.
Энергетическое строение молекулы сложнее, чем у атома. Наряду с движением электронов происходит колебательное движение ядер атомов и вращение молекулы как целого. Поэтому в любом стационарном состоянии энергия молекулы складывается из электронной, колебательной и вращательной энергий:
Е = Евр + Екол + Еэл (4 )
Наибольший вклад в полную энергию вносит энергия электронных переходов, наименьший - энергия вращения молекул:
Евр << Екол << Еэл = 1 : 102 : 103 (5)
Так же, как и атом, молекула может существовать только в определенных энергетических состояниях, называемых энергетическими уровнями (орбиталями). Каждому электронному состоянию соответствуют колебательные уровни, а каждому колебательному уровню - вращательные. Любой уровень, помимо главного, побочного, магнитного и спинового, характеризуется колебательным и вращательным квантовыми числами.
При получении энергии извне молекула переходит с одного энергетического уровня на другой. У молекул, так же как и у атомов, наиболее возбудимыми являются внешние (оптические) электроны.
В спектроскопии, как отмечалось выше, чаще используют возбуждение молекулы под действием электромагнитного поля. При этом молекула поглощает фотоны с энергией, равной разности энергий ее орбиталей. Совокупность всех поглощенных частот составляет спектр поглощения молекулы (молекулярный абсорбционный спектр). Поглощение электромагнитного излучения веществом М можно представить как двухступенчатый процесс, первая ступень которого выражается следующим образом:
М + h n ® M* (6)
где М*- атом или молекула в возбужденном состоянии. Время пребывания в возбужденном состоянии невелико (10 -9 - 10 -8с); частицы возвращаются в исходное состояние в результате какого - либо релаксационного процесса. Наиболее известным видом релаксации является превращение энергии возбуждения в тепло:
М* ® М + тепло (7)
Релаксация может произойти в результате разрушения М* с образованием новых веществ - фотохимическая реакция, а также при переходе в невозбужденное состояние с выделением фотона - флуоресценция и фосфоресценция. Эти процессы объединяют под общим названием люминесценция:
М* ® М + h n (8)
Важно иметь в виду, что время жизни частиц М* обычно столь мало, что концентрация их в любой момент времени при нормальных условиях ничтожна. Более того, количество выделяющегося тепла неощутимо. Вследствие этого облучение системы при ее изучении сопровождается минимальным разрушением, что является преимуществом абсорбционных методов.
Возбуждение молекул другими видами энергии, например, в плазме, не применяют, так как большинство веществ в этих условиях разлагается.
Цель анализа
Качественный анализ. Для целей функционального и структурного анализа в основном используется ИК - спектроскопия.
Количественный анализ. Для определения количественного состава анализируемого объекта чаще используют спектроскопию УФ - и видимой областей спектра.
Спектры поглощения
Графическое изображение распределения поглощаемой энергии по длинам волн называется спектром поглощения. Способы представления спектра различны в зависимости от величин, откладываемых по осям координат (рис.5).
Количество поглощенной световой энергии выражают величинами Т (коэф. пропускания), А (оптич. плотность), e. Выбор той или иной величины определяется областью спектра, величиной поглощения, задачами исследования и т.п.
В видимой и УФ - областях спектра обычно используют координаты A = f ( l ) или lg A = f ( l ), e = f ( l );
 в ИК - спектроскопии предпочитают представлять спектры в координатах Т = f (n).
в ИК - спектроскопии предпочитают представлять спектры в координатах Т = f (n).
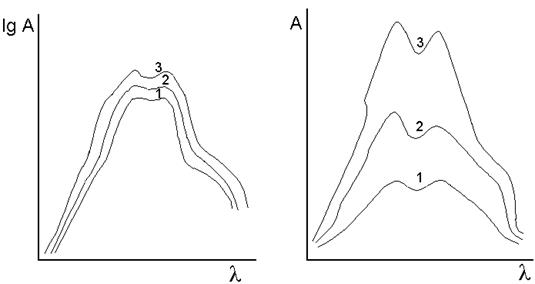
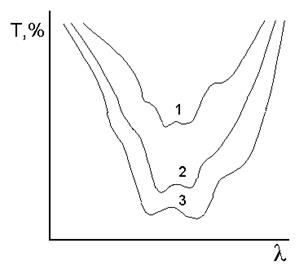
Рис. 5. Способы представления спектров поглощения одних и тех же растворов. (С1 : С2 : C3 = 1 : 2 : 3 ).
Основные характеристики спектра. Участок спектра, на котором наблюдается интенсивное поглощение излучения называют полосой поглощения. Наибольший интерес для анализа представляют следующие характеристики спектра: число максимумов (полос поглощения), их положение по шкале длин волн, высота максимума (значение молярного коэффициента e в максимуме поглощения), интенсивность полосы поглощения, ширина и форма полосы (рис.6.).
Ширину полосы поглощения принято характеризовать величиной 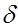 - полуширина полосы поглощения; ее измеряют при e = 1/2 emax.
- полуширина полосы поглощения; ее измеряют при e = 1/2 emax.
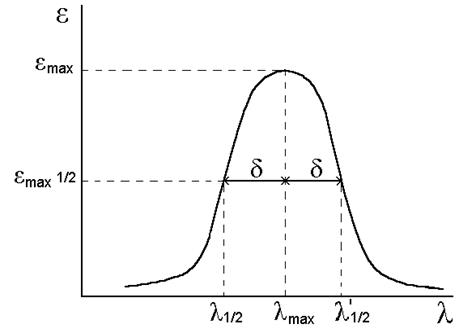
Рис.6. Полоса поглощения
Для аналитической практики имеет значение не столько интегральное поглощение, сколько поглощение при определенной длине волны, поэтому при характеристике полос используют значение молярного коэффициента в максимуме поглощения - emax.
Очевидно, чем выше e max и меньше ширина полосы, тем выше чувствительность определения данного вещества.
Слайд УФ спектр
Типы спектров поглощения
Молекулярная абсорбционная спектроскопия наблюдает изменения энергетического состояния молекул при поглощении излучения.
Из возможных видов движения молекулы - вращения частицы как целого, колебания ядер и возбуждения электронов - особенно большое аналитическое значение имеют два последних.
Колебательные спектры
 Спектры, соответствующие колебательным переходам, наблюдают в инфракрасной области (n ~ 102 ÷ 5·103 см -1), Волновое число, что соответствует энергии квантов от 3 до 60 кДж / моль. Количество возможных колебаний зависит от числа атомов в молекуле; число наблюдаемых колебаний обусловлено симметрией молекул.
Спектры, соответствующие колебательным переходам, наблюдают в инфракрасной области (n ~ 102 ÷ 5·103 см -1), Волновое число, что соответствует энергии квантов от 3 до 60 кДж / моль. Количество возможных колебаний зависит от числа атомов в молекуле; число наблюдаемых колебаний обусловлено симметрией молекул.
Многоатомные молекулы
Нормальные колебания молекул. Колебания в двухатомной молекуле происходят только вдоль линии, соединяющей ядра. Молекула, состоящая из N атомов, обладает 3N степенями свободы движения. Из них 3 степени свободы приходятся на поступательное движение, остальные (3N - 3) - на вращение и колебание молекулы. Число вращательных и колебательных степеней свободы определяется геометрией молекулы. Линейная молекула имеет 3N - 5 колебательных степеней свободы, нелинейная - (3N - 6).
Число колебательных степеней свободы равно числу нормальных колебаний молекулы. Частоты нормальных колебаний характеризуются положением полос в ИК - спектрах, а амплитуда колебаний определяет интенсивность полос.
Колебания могут происходить или вдоль валентных связей атомов с изменением расстояния между ядрами, или с изменением валентного угла между связями при постоянном межъядерном расстоянии, соответственно, валентные n и деформационные d колебания. Для изменения межъядерного расстояния нужна большая энергия, чем для изменения валентного угла, поэтому деформационным колебаниям всегда соответствует более длинноволновая часть спектра, чем валентным колебаниям. Отдельные виды колебаний можно наблюдать только в небольших и простых молекулах. В сложных молекулах валентным колебаниям всегда сопутствуют деформационные, и наоборот.
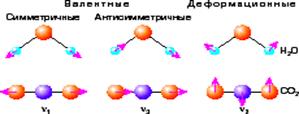
Типы возможных нормальных колебаний молекулы воды приведены на рис. 8.
Рис. 8. Формы нормальных колебаний молекулы Н2О:
а) симметричные валентные колебания; б) антисимметричные валентные колебания; в) деформационные колебания.
Смещения атомов при колебаниях трехатомных молекул для разных типов колебаний
 |
Характеристические частоты. Экспериментально показано, что многочисленные структурные группы, такие, как СН3, С = С, С = О, Р = О и др., поглощают почти при постоянных длинах волн независимо от молекулы, в которой они содержатся. Соответствующие этому поглощению частоты называют характеристическими или групповыми. Они служат для определения в молекуле определенных функциональных групп.
Таблица 7. Типичные области частот колебаний функциональных групп
| Функциональная группа | ν, см-1 | Интенсивность |
| О-Н | 3200-3650 | Переменная |
| N-Н | 3300-3500 | средняя |
| С-О | 1050-1300 | сильная |
| С=О | 1690-1760 | сильная |
| NО2 | 1300-1370 | сильная |
Строго локализованные групповые частоты представляют предельный идеальный случай. На практике приходится учитывать влияние радикалов - ближнее взаимодействие или влияние окружающей среды (например, агрегатного состояния, растворителя, условий регистрации) - дальнее взаимодействие.
Характеристические частоты сведены в так называемые корреляционные таблицы, которые широко используются в прикладной спектроскопии для определения строения молекул и проведения качественного анализа по ИК - спектрам.
В качественном анализе
Рассмотрим в упрощенном виде, что происходит при прохождении излучения с энергией в десятые эВ и соответственно с диапазоном частот от 500 до 5000 см-1 через пары формальдегида.
Если волновое число проходящего через вещество излучения медленно изменяется от 500 до 5000 см-1, то энергия такого излучения медленно возрастает, так как уменьшается длина волны. Поток падающего излучения будет беспрепятственно проходить через вещество, пока энергия его не будет точно соответствовать по величине энергии, способной вызвать изменение валентных углов между атомами водорода в молекуле. Такого типа колебания атомов носят название деформационных колебаний (δ) и бывают симметричными (δs) и антисимметричными (δas). Это происходит в области энергий, соответствующих волновому числу 1500 см-1. В этот момент энергия проходящего излучения расходуется на возбуждение колебаний и интенсивность прошедшего потока энергии резко падает (происходит поглощение).
При дальнейшем возрастании энергии излучения наступает момент, когда она точно соответствует энергии, вызывающей изменение длины двойной связи С=O (1745 см-1). Такого типа колебания называются валентными.
И наконец, при достаточном возрастании энергии в области около 2800 см-1 начинает изменяться длина С—Н-связей — валентные симметричные и валентные антисимметричные колебания С—Н:
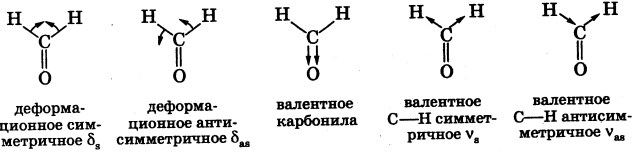
Измеряя изменение интенсивности проходящего через вещество потока излучения, мы получаем ИК-спектр.
Чрезвычайно важно, что поглощение для каждой функциональной группы лежит в сравнительно узкой области и что оно в пределах этой узкой области зависит только от ближайшего окружения данной функциональной группы.
На рисунке приведен ИК-спектр метилэтилкетона. Важнейшие пики отнесены к колебаниям имеющихся в молекулах функциональных групп.
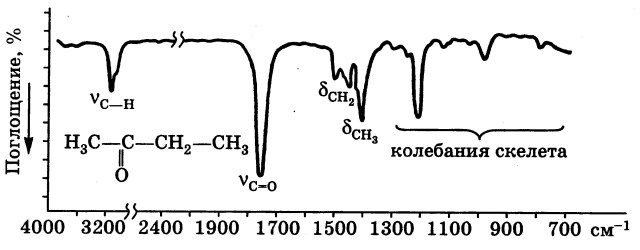
Абсорбционная спектроскопия может служить одним из методов качественного анализа. Для проведения структурного анализа нужно иметь индивидуальное соединение, т. к. в большинстве случаев спектроскопическими методами нельзя отличить смесь веществ от чистого соединения. Индивидуальность исследуемого образца гарантируется подходящими методами разделения, особенно газовой хроматографией. Наиболее сильные полосы поглощения в регистрируемом спектре должны быть выписаны полностью. Расшифровка спектров осуществляется тем легче и однозначнее, чем больше имеется информации об анализируемом образце уже из постановки задачи (молекулярная масса, данные элементного анализа, растворимость, схема синтеза и др.).
В инфракрасной области спектра наблюдают сигналы, соответствующие отдельным функциональным группам. Обнаружение отдельных функциональных групп производят по их характеристическим частотам (см. выше). Пики, используемые для идентификации определенных функциональных групп, расположены в ближней ИК - области (ниже примерно 7,5 мкм или 1300 см -1); положение максимумов в этой области практически не зависит от углеродного скелета, с которым связана группа.
Ориентировочно выделяют четыре области спектра:
1) 2,7 - 4,0 мкм - валентные колебания с участием атомов водорода (О - Н, С - Н, N - H, S - H);
2) 4,0 - 5,0 мкм - тройные валентные связи (С ≡ С, С ≡ N) и С = С = С;
3) 5,0 - 6,4 мкм - двойные валентные связи (С = С, С = О, С =N)
и группы - С = О , - С = О , - С = О;

 OH OR NH2
OH OR NH2
4) 6,0 - 15 мкм - одинарные валентные связи (С - Н, N - H), группы -СН3, -СН2 -, -NH2, группы с тяжелыми атомами и РО43-, SO42-, CO32-, NO3-.
Для более надежной интерпретации спектра требуются тренировка и опыт. При расшифровке спектров необходимо учитывать следующие моменты:
а) отсутствие характеристической полосы поглощения является более надежным доказательством отсутствия структурной группы, чем доказательство ее наличия на основании появления полосы поглощения;
б) не все полосы в спектре можно интерпретировать;
в) выводы, получаемые из спектров, часто остаются более или менее обоснованными предположениями.
Для структурного анализа часто рекомендуют следующую схему:
1) определение класса соединения (для алифатических соединений частота валентных колебаний группы ºСН< 3000 см -1, для ненасыщенных и ароматических соединений частота валентных колебаний группы ñСН > 3000 см -1);
2) обнаружение функциональных групп ( - ОН, -NH2, ñNH, -CN, ñC = O) целесообразно начинать с области высоких частот;
3) установление типа заместителей в ароматических соединениях, положения и характера двойных связей, влияния стерических факторов.
Полученная таким образом информация в большинстве случаев достаточна для выбора некоторых возможных вариантов. Если идентификация функциональных групп в молекуле не позволяет идентифицировать само соединение, тогда сравнивают полные спектры определяемого и стандартного соединений. Для этой цели существуют атласы спектров.
Тема 8
Спектроскопические методы анализа
Спектроскопические методы анализа основаны на взаимодействии электромагнитного излучения с веществом. Это взаимодействие сопровождается явлениями, из которых наиболее важны испускание, поглощение и рассеяние излучения. Возникающие при этом сигналы несут качественную и количественную информацию о веществе.
Частота сигнала отражает специфические свойства вещества, его природу, а интенсивность сигнала связана с количеством анализируемого соединения. Для наблюдения и исследования таких сигналов используются различные физические закономерности. Благодаря этому методы спектроскопии позволяют получать детальную информацию о составе, строении и количественном содержании исследуемых веществ.
Методы оптической молекулярной спектроскопии позволяют наблюдать результаты взаимодействия электромагнитного излучения оптического диапазона (УФ-, видимая, ИК- и микроволновая области) с молекулами исследуемого вещества. Соответствующие аналитические сигналы содержат информацию о свойствах пробы, определяемых присутствием поглощающего вещества.
При облучении вещества электромагнитным излучением кроме процессов поглощения (абсорбции) света наблюдается и ряд других процессов – отражение, рассеяние, флуоресценция или фосфоресценция (поглощение с последующим излучением света), фотохимические реакции (распад связей в молекуле вещества).
Ослабление интенсивности излучения при прохождении его через пробу, связанное с рассеиванием какой-либо дисперсной системой, используется в таких аналитических методах, как турбодиметрия и нефелометрия.
Метод, в котором используется линейное измерение интенсивности электромагнитного излучения, называется турбодиметрией.
Измерение интенсивности потока, рассеянного дисперсной системой, можно проводить под углом 900, что и реализуется в методе нефелометрии.
В некоторых случаях молекулы при поглощении квантов энергии могут испускать излучение в видимой области спектра. Интенсивность этого излучения, естественно, также связана с концентрацией интересующего вещества в пробе. Использование такого рода электронных спектров испускания - фотолюминесценции для химико-аналитических целей составляет основу другого метода - флуориметрического.
Аналитические методы, основанные на использовании явления поглощения излучения УФ, видимой и ИК областей молекулами вещества, составляют базу абсорбционной молекулярной спектроскопии.
Частота поглощаемого излучения отражает природу вещества, его специфические свойства. Интенсивность сигнала – А (величина поглощения) зависит от концентрации поглощающего вещества и, таким образом, является мерой концентрации определяемого вещества в пробе.
В аналитической оптической молекулярной спектроскопии наблюдают и исследуют аналитические сигналы в области 100—800 нм, обусловленные электронными переходами внешних, валентных электронов. Поглощение излучения в ИК- и микроволновой области связанно с изменением вращения и колебания атомов в молекуле и вращением молекулы.
С помощью методов оптической молекулярной спектроскопии можно решать разнообразные задачи – от исследования химической структуры молекул до анализа сложных многокомпонентных смесей, таких, например, как пищевые продукты.
Используемый для химического анализа диапазон электромагнитного излучения охватывает интервал его энергий приблизительно от 100 до 0,01 эВ. Естественно, что процессы, происходящие при взаимодействии вещества с излучением этого оптического диапазона, неодинаковы. В соответствии с этим в аналитической химии практическое значение получили разделы оптической молекулярной спектроскопии, каждый из которых связан с определенным спектральным диапазоном.
Таблица 1 — Спектр электромагнитных волн
| λ,см | Область | Изменения в энергетическом состоянии | Энергия излучения, эВ |
| 103 | Радиоспектроскопия | Спинов ядер и электронов | 10-6 |
| 10-3 | ИК-спектроскопия | Атомов в кристаллической решетке | 10-3 |
| 10-5 | Спектроскопия в видимой области | Атомов в молекулах из-за колебаний | 10-1 |
| 10-6 | УФ-спектроскопия | Валентных электронов | 10 |
| 10-6 — 10-7 | Масс-спектрометрия | Образование ионов и разрывы связей | 10—102 |
| 10-9 | Рентгеноструктурный анализ | Электронов внутренних оболочек | 105 |
| 10-10 | Ядерные реакции под воздействием γ-излучения | Ядер | 107 |
Дата: 2018-12-21, просмотров: 795.