Если элементы, составляющие сплав, взаимодействуют друг с другом, то образуется химические соединения с кристаллической решеткой, резко отличающейся от кристаллических решеток исходных элементов. Свойства химических соединений отличаются от свойств образующих их элементов. Большое число химических соединений, образующихся в металлических сплавах, отличаются по некоторым особенностям от типичных химических соединений, так как не подчиняются законам валентности и не имеют постоянного состава (Fe3C, Fe6C).
Диаграммы состояния и принцип их построения.
Что представляют собой диаграммы состояния?
Диаграмма состояния представляет собой графическое изображение зависимости температур фазовых превращений в сплавах от их состава.
Опишите принцип построения диаграмм.
Диаграммы состояния обычно строят экспериментально. Для их построения используют термический метод, с помощью которого получают кривые охлаждения и затвердевания сплавов (для этого следует расплавить ряд сплавов и провести их медленное охлаждение, фиксируя зависимость температуры от времени охлаждения). По остановкам и перегибам на этих кривых, обусловленных тепловыми эффектами превращений, определяются температуры самих превращений. Точки перегиба или остановки на кривых охлаждения называются критическими точками. Они соответствуют температурам, при которых в сплавах начинают или заканчиваются протекать какие- либо превращения.
Диаграммы состояния двойных сплавов строятся в системе двух координат – температура и концентрация. В двойных сплавах по вертикали диаграммы состояния откладывается температура, а по горизонтали - концентрация компонентов. Каждая точка на оси абсцисс соответствует определенному содержанию одного и другого компонента с учетом того, что общее содержание компонентов в каждой точке этой оси соответствует 100 %. Поэтому по мере увеличения количества одного компонента сплава должно снижаться содержание в сплаве другого компонента.
5.2.2. Назовите основные типы диаграмм состояния.
Вид диаграммы состояния определяется характером взаимодействий, которые имеют место между компонентами сплавов в жидком и твердом состоянии. Предполагается, что между компонентами сплава в жидком состоянии существует неограниченная растворимость, т. е. они образуют однородный жидкий раствор (обозначается буквой Ж). В твердом состоянии компоненты могут образовывать:
1. механические смеси из чистых компонентов;
Неограниченные твердые растворы;
3. ограниченные твердые растворы;
Устойчивые химические соединения;
5. неустойчивые химические соединения, а также испытывать полиморфные превращения.
Поэтому принято рассматривать следующие базовые типы диаграмм состояния.
Основные типы диаграмм состояния
5.3.1. Охарактеризуйте диаграмму состояния сплавов, образующих механические смеси из чистых компонентов (диаграмма I рода).
Исходные данные: оба компонента неограниченно растворимы в жидком состоянии, а в твердом состоянии нерастворимы и не образуют химических соединений.
Компоненты: химические элементы А, В (К = 2).
Фазы: жидкость Ж, кристаллы А, В (Ф = 3).
Примером диаграмм этого типа является диаграмма состояния сплавов системы Pb - Sb. Диаграмма Pb-Sb строится на основе использования кривых охлаждения, полученных методом термического анализа (рис.1).
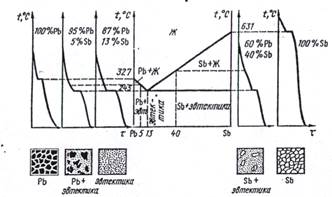
Рис. 1. Диаграмма состояния, кривые охлаждения и схемы структур сплав системы Pb - Sb при полном охлаждении до комнатной температуры.
Система сплавов Pb-Sb включает в себя составы со 100 % РЬ и 0 % Sb, т. е. чистый свинец, и со 100 % Sb и 0 % РЬ, т. е. чистую сурьму. Кривые охлаждения для этих чистых металлов имеют по одному горизонтальному участку, характеризующему температуру кристаллизации: соответственно для свинца 327 °С и для сурьмы 631 °С. На диаграмме состояния эти температуры находятся на осях ординат, где содержатся соответственно чистый свинец и чистая сурьма. Структура чистых металлов представляет собой однородные зерна.Сплав, содержащий 13 % Sb и 87 % РЬ, также имеет один горизонтальный участок, т. е. одну критическую точку (245 °С) температуру затвердевания этого сплава. Этот сплав характеризуется тем, что в нем происходит одновременная кристаллизация жидкой фазы кристаллов РЬ и Sb (в общем случае компонентов и В) с образованием механической смеси. Такая механическая смесь двух (или более) видов кристаллов, одновременно кристаллизующихся из жидкости, называется эвтектикой. Сам сплав 13 % Sb и 87 % РЬ является эвтектическим, а его микроструктуру представляет собой попеременно чередующиеся выделения сур мы в свинцовой основе (рис.1). Принято эвтектическую реакцию записывать так: Ж —> Pb + Sb, или в общем виде Ж —> А + В.
Кристаллизация любого сплава, имеющего 0 % < Sb < 13%, начинается с выделения кристаллов РЬ. Эти сплавы затвердевай в интервале температур, и на кривых охлаждения имеются критические точки, соответствующие началу и концу затвердевания (например, сплав с 5 % Sb, рис. 1). Все они называются доэвтектическими сплавами, претерпевают эвтектическое превращение при охлаждении ниже температуры 245 °С и имеют после окончательного охлаждения структуру РЬ + Э(РЬ + Sb), рис. 1. В этой структуре имеется две структурные составляющие: кристаллы РЬ и эвтектика Э(РЬ + Sb), которые получаются на ба; двух фаз: кристаллов РЬ и кристаллов Sb.
Кристаллизация любого сплава с концентрацией 100 % > Sb > 13 % начинается с выделения кристаллов Sb. Эти сплавы также затвердевают в интервале температур - начала и конца затвердевания (например, сплав с 40% Sb, рис.1). При охлаждении ниже температуры 245 °С в них протекает эвтектическое превращение. Эти сплавы называются заэвтектическими и имеют после охлаждения окончательную структуру Sb + Э(РЬ + Sb), рис. 1. Структура заэвтектических сплавов также является двухфазной (кристаллы Sb и РЬ) и состоит из двух структурных составляющих: кристаллов Sb и эвтектики Э (Pb + Sb).
На диаграмме можно выделить три характерные зоны: область, где существует только жидкая фаза, - выше системы линий, ограниченной точками: температура 327 °С - эвтектическая точка 245 °С - температура 631 °С; область, где существует только твердая фаза (кристаллы РЬ и Sb), - ниже эвтектической линии (вся горизонтальная линия на уровне температуры 245 °С с концами в месте ее пересечений с ординатами со 100 % РЬ и 100 % Sb); область, где одновременно сосуществует жидкая и твердая фаза (область с жидко-твердой фазой) - между линиями, ограничивающими соответственно жидкое и твердое состояние сплавов.
Линия, ограничивающая на диаграмме область жидкой фазы сплавов, называется линией ликвидус. Линия, ограничивающая область полностью затвердевшего сплава от остальной области на диаграмме состояний, называется линией солидус.
5.3.2. Охарактеризуйте диаграмму состояния сплавов с неограниченной растворимостью компонентов в твердом состоянии (диаграмма II рода)
Исходные данные: оба компонента неограниченно растворимы в твердом и жидком состоянии и не образуют химических соединений.
Компоненты: химические элементы А, В (К = 2).
Фазы: жидкость Ж, кристаллы α- твердого раствора (Ф = 2).
Примером сплавов с такими диаграммами состояния являются сплавы системы Cu - Ni .
Если два компонента (А и В) неограниченно растворяются в жидком и твердом состоянии, то они не могут при затвердевании образовывать собственных кристаллов во всех сплавах на базе этих компонентов. Соответственно при кристаллизации в этих сплавах будут выделяться кристаллы α-твердого раствора, а, следовательно, максимальное число фаз в этих сплавах равняется двум (жидкость и α-твердый раствор). В этом случае в соответствии с правилом фаз кристаллизация всех сплавов будет протекать только в интервале температур (кристаллизация при постоянной температуре у сплавов возможна только при наличии трех фаз) и, соответственно, на диаграмме состояния отсутствует горизонтальная линия, а присутствуют только наклонные кривые (рис..2)
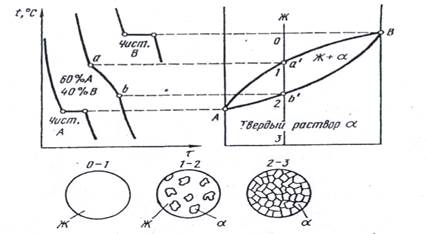
Рис. 2. Диаграмма состояния, кривые охлаждения и схемы типовых структур сплавов с неограниченной растворимостью в твердом состоянии.
На диаграмме (рис. 2) присутствуют три области: обл. выше линии Аа'В - жидкость; область между линиями Аа АЬ'В - жидкость и твердый раствор. Ниже линии АЬ'В - область твердого раствора. Линия Аа'В является линией ликвидус, а линия А ь 'В - линией солидус.
Кристаллизация любого сплава начинается выпадением жидкого расплава отдельных кристаллов твердого раствора,
например, в точке а', рис. 2) и заканчивается полным затвердением твердого раствора (например, в точке Ь', рис.2). Но так в интервале кристаллизации (например, между точками а' рис.2) сплавы находятся в двухфазном состоянии (Ж + а)
при понижении температуры должно изменяться соотношение количества жидкой и твердой фазы в двухфазной области - количество жидкости уменьшается, а количество α-твердого раствора растет. Кроме того, при понижении температуры будут меняться также составы жидкой и твердой фаз.
Дата: 2018-11-18, просмотров: 773.