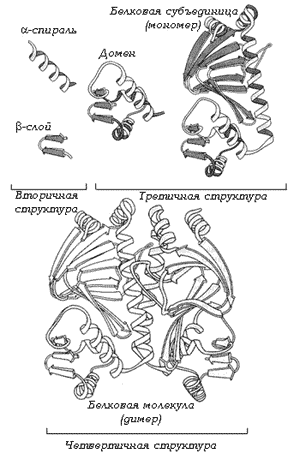
Рис. 11. Пространственная структура белка
Белки – это гетерополимеры, состоящие из 20 различных мономеров – природных альфа-аминокислот. Белки – это нерегулярные полимеры.
Общее строение аминокислоты может быть представлены следующим образом: R—(H)C(NH2)—СООН. Аминокислоты в белке связаны пептидной связью —N(H)—С(=О). Аминокислоты разделяют на заменимые (синтезируются в самом организме) и незаменимые, которые животный организм получает с пищей. Среди белков различают протеины, состоящие только из аминокислот, и протеиды, дополнительно содержащие небелковую часть (например, гемоглобин, который состоит из белка глобина и гема – порфирина).
В строении молекулы белка различают несколько уровней структурной организации (рис. 11). Первичная структура – это последовательность аминокислотных остатков, соединенных пептидными связями. Вторичная структура – как правило, это спиральная структура (альфа-спираль), которая удерживается множеством водородных связей, возникающих между находящимся близко друг от друга –С=О и –NH-группами. Другой тип вторичной структуры – это бета-слой, или складчатый слой; это две параллельные полипептидные цепи, связанные водородными связями, перпендикулярными цепям. Третичная структура белковой молекулы – это пространственная конфигурация, обычно напоминающая компактную глобулу; она поддерживается ионными, водородными и дисульфидными (S–S) связями, а также гидрофобными взаимодействиями. Четвертичная структура образуется при взаимодействии нескольких субъединиц – глобул (например, молекула гемоглобина состоит из четырех таких субъединиц). Утрата белковой молекулой своей структуры называется денатурацией; она может быть вызвана температурой, обезвоживанием, облучением и т.д. Если при денатурации первичная структура не нарушается, то при восстановлении нормальных условий полностью воссоздается структура белка.
Функции белков в клетке очень разнообразны. Они играют роль катализаторов, т.е. ускоряют химические реакции в организме (ферменты ускоряют реакции в десятки и сотни тысяч раз). Белки выполняют также строительную функцию (входят в состав мембран и органоидов клетки, а также в состав внеклеточных структур, например, коллаген в соединительной ткани). Движение организмов обеспечивается специальными белками (актином и миозином). Белки выполняют также транспортную функцию (например, гемоглобин транспортирует О2). Белки обеспечивают функции иммунной системы организма (антитела и антигены), свертывание крови (фибриноген плазмы крови), т.е. выполняют защитные функции. Они служат также одним из источников энергии (при распаде 1 г белка выделяется 17,6 кДж энергии). Известны также регуляторные функции белков, т.к. многие гормоны – это белки (например, гормоны гипофиза, поджелудочной железы и т.д.). Кроме того, в организме имеются еще и резервные белки, например, являющиеся источником питания для развития плода.
26. Охарактеризуйте строение и биологическое значение АТФ. Почему АТФ называют основным источником энергии в клетке?
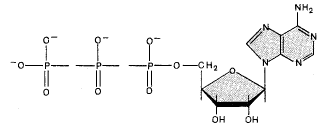
Рис. 12. Схема строения АТФ
АТФ – это аденозинтрифосфат, нуклеотид, относящийся к группе нуклеиновых кислот. Концентрация АТФ в клетке мала (0,04%; в скелетных мышцах 0,5%). Молекула АТФ состоит из аденина, рибозы и трех остатков фосфорной кислоты (рис. 12). При гидролизе остатка фосфорной кислоты выделяется энергия:
АТФ + H2O = АДФ + Н3РО4 + 40 кДж/моль.
Связь между остатками фосфорной кислоты является макроэргической, при ее расщеплении выделяется примерно в 4 раза больше энергии, чем при расщеплении других связей. Энергия гидролиза АТФ используется клеткой в процессах биосинтеза и деления клетки, при движении, при производстве тепла, при проведении нервных импульсов и т.д. После гидролиза образовавшийся АДФ обычно с помощью белков-цитохромов быстро вновь фосфорилируется с образованием АТФ. АТФ образуется в митохондриях при дыхании, в хлоропластах – при фотосинтезе, а также в некоторых других внутриклеточных процессах. АТФ называют универсальным источником энергии, потому что энергетика клетки основана главным образом на процессах, в которых АТФ либо синтезируется, либо расходуется.
Дата: 2019-12-22, просмотров: 665.