До 50 мл проби води додають 1 мл розчину соляної кислоти (1:1) і декілька кристаликів персульфату амонію та після перемішування протягом 3 хвилин – 1 мл 50 %-го розчину роданіду амонію. Через 3 хвилини визначають оптичну щільність цієї рідини на фотоколориметрі з синім фільтром
(λ = 490...508 нм), кювети повинні мати шар рідини 1–5 см). Від значення оптичної щільності проби води треба відняти значення оптичної щільності дистильованої води, яка визначається на тому ж фотоколориметрі при тих же умовах, що і для проби води. За калібрувальним графіком, який потрібно побудувати заздалегідь, знаходять концентрацію загального заліза в пробі води.
Побудувати калібрувальний графік слід таким чином: спочатку готують основний стандартний розчин, 1 мл якого містить 0,1 мг заліза (0,8634 г залізо (ІІІ)-амонійсульфату Fe(NH4)(SO4)2∙12H2O розчиняють у дистильованій воді, додають 10 мл концентрованої сірчаної кислоти і доводять об’єм розчину дистильованою водою до 1 л). З цього розчину потім готують робочий стандартний розчин заліза, 1 мл якого містить 0,005 мг заліза (50 мл основного розчину розбавити до 1 л дистильованою водою). Потім з робочого розчину готують серію розчинів з вмістом заліза 0–2,0 мг/л, визначають їх оптичну щільність і будують калібрувальний графік.
Візуальне колориметричне визначення загального заліза в пробі води ведуть у фарфорових чашках, титруючи стандартним розчином дистильовану воду з доданими до неї необхідними реагентами до однакової кольоровості з кольоровістю проби води.
Вміст заліза при візуальному визначенні в фарфорових чашках розраховують за формулою
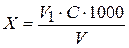 , (7.1)
, (7.1)
де Х – вміст заліза, мг/л; V1 – об’єм стандартного розчину, який витратили на титрування, мл; С – дорівнює 0,1 (1 мл стандартного розчину містить 0,1 мг заліза), або 0,01 (1 мл стандартного розчину містить 0,01 мг заліза) або іншому числу, яке відповідає концентрації заліза у тому розчині, яким проводилося титрування; V – об’єм проби води, яка аналізується, мл.
Експеримент 2. Визначення в природних водах концентрації
марганцю
До проби води об’ємом 70–80 мл додають 5 мл комбінованого реактиву (75 г сульфату ртуті розчиняють у 400 мл концентрованої азотної кислоти і 200 мл дистильованої води, додають 20 мл 85%-ої фосфорної кислоти та 0,035 г нітрату срібла; цей розчин охолоджують і потім додають дистильованої води до загального об’єму 1 л), 3,5 мл 30%-го розчину персульфату амонію, кип’ятять 1–2 хвилини, доки колір розчину не буде змінюватися. Після охолодження під струменем холодної води об’єм проби доводять дистильованою водою до 100 мл та визначають інтенсивність кольору розчину або візуально, або за оптичною щільністю розчину, яку вимірюють на фотоколориметрі. Зі значення оптичної щільності проби води слід відняти її значення в холостому експерименті (з дистильованою водою).
Для побудови калібрувального графіка в мірні колби об’ємом 100 мл наливають 70–80 мл дистильованої води, 5 мл комбінованого розчину і 3,5 мл розчину персульфату амонію. Послідовно в кожну з колб додають 0,1; 0,3; 0,5; 0,8; 1,0; 1,5 мл 0,01 н розчину перманганату калію, що відповідає (після доведення об’ємів до 100 мл) вмісту марганцю 0,11; 0,33; 0,55; 0,88; 1,1; 1,65 мг/л. Заміряють оптичну щільність цих розчинів на фотоколориметрі з зеленим світлофільтром (λ = 536...540 нм) і будують калібрувальний графік.
Ці ж самі розчини можна використовувати для візуального визначення концентрації марганцю в пробах природних вод (у циліндрах Генера).
Вміст марганцю у пробі води при візуальній оцінці розраховують за формулою
 , (7.2)
, (7.2)
де а – кількість розчину перманганату калію, витраченого на приготування розчину порівняння в циліндрі Генера № 2, мл; b – вміст марганцю в стандартних розчинах перманганату калію (наприклад, 0,011 мг в 1 мл 0,01 н розчину або 0,055 мг в 1 мл 0,05 н розчину); К – поправковий коефіцієнт для розчину перманганату калію; V – об’єм проби води для аналізу, мл; h1 та h2 – висота рідини в посудинах Генера № 1 та № 2 відповідно, мм.
Якщо при аналізі проби води застосовувався фотоколориметр, то вміст марганцю обчислюють за такими формулами
 ; (7.3)
; (7.3)
 , (7.4)
, (7.4)
де Х, Y – вміст марганцю у мг/л та мг-екв/л відповідно; С – концентрація марганцю за калібрувальним графіком, мг/л; V – об’єм проби води для аналізу, мл; 27,47 – еквівалент двозарядних іонів марганцю; 100 – об’єм, до якого розбавлена проба води.
Отримані в експерименті результати необхідно за чинним стандартом округлювати за табл. 7.1.
Таблиця 7.1 – Порядок округлення отриманих результатів
| Округлення результатів | Діапазон концентрацій, мг/л | |||
| 0,02–1 | 1–2 | 2–5 | 5–10 | |
| отриманих у мг/л | 0,02 | 0,05 | 0,1 | 0,2 |
| отриманих у мг-екв/л | 0,0002 | 0,001 | 0,002 | 0,05 |
ЗАПИТАННЯ ДЛЯ САМОКОНТРОЛЮ ТА ЗАХИСТУ
ЛАБОРАТОРНИХ РОБІТ
1. Опишіть будову води як хімічної сполуки.
2. Яка роль води в природокористуванні людини?
3. Наведіть хімічний склад домішок природних вод.
4. Наведіть класифікацію домішок природних вод за їх фазово-дисперсним станом.
5. Опишіть аномалії низки фізичних властивостей води та їх причини.
6. Що включає повний аналіз природної води?
7. Назвіть основні правила відбору проб природної води.
8. Розкрийте поняття консервації проб природної води.
9. Дайте визначення поняття „гідросфера Землі”.
10. Яка частка гідросфери представлена на Землі прісною водою?
11. Дайте оцінку водним ресурсам України.
12. Назвіть фізичні показники якості природних вод.
13. Наведіть характеристики бактеріологічних та біологічних показників якості природних вод.
14. Назвіть основні вимоги до якості вод для різних галузей народного господарства.
15. Як за стандартом визначається прозорість природних вод?
16. Як визначається кольоровість природної води?
17. Розкрийте поняття активної реакції природних вод та стандартні методи її оцінки.
18. Які ви знаєте методи визначення в природних водах вмісту вільної та агресивної вуглекислоти?
19. Охарактеризуйте поняття про вуглекислотну рівновагу в природних водах. На які якості води вона впливає?
20. Як визначається жорсткість природних вод?
21. У яких одиницях вимірюється жорсткість природних вод в Україні?
22. Які методи зниження жорсткості природних вод Ви знаєте?
23. Що для природних вод характеризує показник „здатність до окиснення”?
24. Які існують стандартні методи визначення в природних водах сульфатів та хлоридів?
25. Як за стандартом визначаються в природних водах концентрації марганцю та заліза?
СПИСОК РЕКОМЕНДОВАНОЇ ЛІТЕРАТУРИ
1. Кульский Л.А. и др. Справочник по свойствам, методам анализа и очистке воды: В 2-х ч. – К.: Наук. думка, 1980. – 1500 с.
2. Абрамов Н.Н. Водоснабжение. – М.: Стройиздат, 1982. – 280 с.
3. Кульский Л.А. Основы химии и технологии воды. – К.: Наук. думка, 1991. – 568 с.
ЗМІСТ
Вступ .....................................................................................................................
Лабораторна робота 1. Визначення основних фізичних показників якості природних вод ................................................................................................................................
Лабораторна робота 2. Визначення водневого показника проб природної
води .......................................................................................................................
Лабораторна робота 3. Визначення лужності, кислотності і вмісту вуглекислоти в пробах природних вод .....................................................................................................
Лабораторна робота 4. Визначення жорсткості води ........................................
Лабораторна робота 5. Визначення в пробах природних вод сухого залишку, втрат при прожарюванні залишку та здатності до окиснення ............................................
Лабораторна робота 6. Визначення сульфатів та хлоридів у природних водах
Лабораторна робота 7. Визначення концентрації загального заліза та марганцю
в пробах природних вод ......................................................................................
Запитання для самоконтролю та захисту лабораторних робіт .........................
Список рекомендованої літератури ....................................................................
Навчальне видання
МЕТОДИЧНІ ВКАЗІВКИ
до лабораторних робіт з дисципліни
«Хімія та технологія води»
для студентів спеціальності 6.091602
«Хімічна технологія неорганічних речовин»
усіх форм навчання
Укладачі: ЮРЧЕНКО Олександр Павлович
КОБЗЄВ Олександр Вікторович
АВІНА Світлана Іванівна
Відповідальний за випуск О. Я. Лобойко
Роботу до видання рекомендував Я. М. Пітак
Редактор Л.А. Копієвська
Комп’ютерна верстка О. В. Кобзєв
План 2008 р., поз. 49/_
Підп. до друку . . 08 р. Формат 60x84 1/16. Папір друк. №2.
Друк – ризографія. Гарнітура Times New Roman. Ум. друк. арк. 1,7.
Обл. - вид.арк. 1,9. Наклад 100 прим. Зам. № ______. Ціна договірна.
 |
Видавничий центр НТУ „ХПІ”.
Свідоцтво про державну реєстрацію ДК №116 від 10.07.2000 р.
61002, м. Харків, вул. Фрунзе, 21.
 |
Друкарня НТУ "ХПІ". 61002, Харків, вул. Фрунзе, 21
[1] При розрахунку здатності до окиснення в мг перманганату на 1 л води замість 0,08 слід брати 0,32 – еквівалент перманганату калію, який відповідає 1 мл 0,01 н його розчину.
Дата: 2016-10-02, просмотров: 299.