Кафедра ТОПП
Расчётно-графическая работа по неорганической химии
Тема: "Химия элементов"
МОЛИБДЕН
Вариант 3
Факультет: ЭМ
Группа: ЭМ-712 Преподаватель:
Студент: Бусыгина Н.С. Шевницина Л.В.
Новосибирск 2008
Содержание
1. История открытия
2. Молибден в природе
3. Физико-химические свойства молибдена
4. Переработка молибденового сырья
5. Важнейшие соединения молибдена
6. Применение молибдена и его соединений
7. Биологическая роль молибдена
8. Токсикология молибдена
9. Кластеры, содержащие атомы молибдена
Список литературы
История открытия
Молибденит (дисульфид молибдена, MoS2) был известен древним грекам и римлянам с незапамятных времен. Этот свинцово-серый с металлическим блеском минерал (другое название - молибденовый блеск) сходен с галенитом (свинцовым блеском, PbS) и графитом. Мягкость минерала позволяла использовать его (вместе с графитом) как грифель для карандашей, поэтому долгое время молибденит путали с галенитом и графитом, хотя, в отличие от последнего, он оставлял на бумаге зеленовато-серый цвет. Сходство древнегреческих названий свинца - mólubdV, и галенита - molubdaina было причиной того, что в средневековой Европе три минерала (PbS, MoS2 и графит) имели одно название - Molybdaena. История открытия элемента № 42 связана со Швецией. В 1758 шведский минералог и химик Аксель Фредерик Кронштедт (1722-1765) высказал предположение, что графит, галенит и молибденовый блеск три самостоятельных вещества. Двадцать лет спустя, в 1778, химическим составом молибденита заинтересовался шведский химик Карл Вильгельм Шееле. Прокипятив его с концентрированной азотной кислотой, он получил белый осадок "особой белой земли", которую назвал молибденовой кислотой. Хотя во времена Шееле и не знали, что "земли" представляют собой оксиды металлов, уникальная химическая интуиция подсказывала ему, что металл можно получить прокаливанием молибденовой кислоты с углем. Экспериментальные трудности (у него не было подходящей печи) не позволили Шееле самостоятельно решить эту задачу и лишь в 1782 шведскому химику Петеру Якобу Гьельму (Peter Jacob Hjelm), которому Шееле прислал образец молибденовой кислоты, удалось восстановить ее углем и получить королек металла (сильно загрязненного карбидами). После удачно проведенного опыта Шееле писал Гьельму: "Радуюсь, что мы теперь обладаем металлом - молибденом!"
Относительно чистый металл удалось получить много лет спустя Йенсу-Якобу Берцелиусу в 1817. Совершенно чистый молибден, способный к ковке, получили лишь в начале 20 в.
Долгое время с момента открытия молибдена К. Шееле этот металл оставался лабораторной редкостью до того, как в конце 19 в. был предложен промышленный способ извлечения молибденита. В 1891 французская фирма Schneider & Co впервые начала использовать молибден в качестве легирующей добавки, придающей стали одновременно высокую твердость и вязкость. Это редкое сочетание ценных свойств в одном металле было сразу оценено по достоинству, так как, обладая плотностью в два раза меньшей, чем плотность вольфрама, молибден являлся почти равноценной его заменой. Резкий скачок в объеме потребления молибдена произошел во время Первой мировой войны, так как темпы производства металлического вольфрама, использовавшегося в качестве легирующей добавки в производстве броневой стали, явно отставали от темпов его увеличивающегося потребления. К этому времени уже были известны замечательные свойства молибдена как легирующей добавки, но основные проблемы были связаны с нехваткой разведанных месторождений молибденита. Интенсивные поиски увенчались успехом лишь в 1918, когда в "долине облаков", в Колорадо было открыто крупнейшее в мире месторождение Клаймакс. Интересно, что 75-миллиметровая броня (сталь, легированная марганцем) появившихся на полях сражений в 1914-1918 танков англо-французских войск легко пробивалась 75-миллиметровыми снарядами немецкой артиллерии. Стоило только добавить молибден (в количестве всего 1,5-2%) к стали, как эти снаряды становились бессильны даже против 25-миллиметровых броневых листов.
Молибден в природе
Типы месторождений. Молибден относится к редким элементам, его кларк в земной коре равен 1,1·10-4% по массе. Кроме того, оценено общее содержание его во Вселенной (5·10-7% по массе или 10-8% от общего количества атомов), на Солнце (9·10-7% (масс) или 10-8% (ат)), углеродистых метеоритах (1,2·10-4 (масс) или 2,5·10-5% (ат)), морской воде (10-6% (масс) или 6,4·10-8% (ат)), речной воде (8·10-8% (масс) или 8·10-10% (ат)). В природе этот металл встречается только в виде соединений, известно около двух десятков его минералов, среди которых наиболее важны молибденит (MoS2), повелит (CaMoO4), молибдо-шеелит (Ca (Mo,W) O4), молибдит (xFe2O3·yMoO3·zH2O) и вульфенит (PbMoO4). Промышленное значение имеет только молибденит. Молибденовые руды принято делить по минеральному составу и форме рудных тел на жильные (кварцевые, кварц-серицитовые и кварц-молибденит-вольфрамитовые), прожилково-вкрапленные (кварц-молибденит-серицитовые, медно-молибденовые, медные порфировые с молибденом), скарновые (молибденовые, вольфрамо-молибденовые и медно-молибденовые). Серицит - природный алюмосиликат. Скарны - это породы, образовавшиеся на контакте известняков и кислых магматических пород типа гранитов, богатых кварцем. Медно-порфировые месторождения представлены породами, в которых кварцевые жилы с молибденитом образуют прожилки в измененной породе. Раньше наибольшее промышленное значение имели кварцевые жильные месторождения, сейчас жильные месторождения, в основном, выработаны и ценны прожилково-вкрапленные и скарновые месторождения. Более 60% запасов молибдена и около 70% его добычи приходится на медно-молибден-порфировые месторождения. Из них молибден добывается попутно с медью.
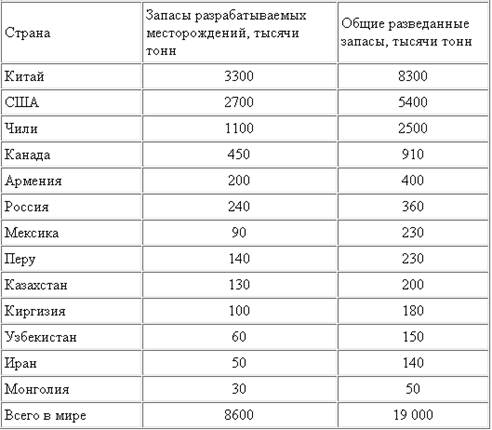
Cамое большое в мире месторождение молибдена - Клаймакс (англ. Сlimax - наивысшая точка, так как это самое высокое место в США) было открыто в 1924 в штате Колорадо и законсервировано с 1995 в связи с опасностью перепроизводства молибденовой продукции. Крупнейший рудник не будет разрабатываться до тех пор, пока запасы месторождения Empire в том же комплексе, в 100 км к востоку от Клаймакса, не будут истощены. Добыча молибденсодержащих руд в США ведется в Колорадо (рудник Henderson), Нью-Мексико (месторождение Questa), Айдахо (месторождение Thompson Creek). Попутное извлечение молибдена с медью идет в Аризоне (месторождения Bagdad и Sierrita) и Юте (Bingham Canyon). Точной информации о потенциальных ресурсах молибдена в Китае до сих пор нет, известно лишь, что основная добыча ведется в семи провинциях: Ляонин (горнорудный центр Хулудао), Шаньси (крупнейший молибден-порфировый рудник Циндуичэн), Хэбэй, Хэнань (месторождение Луанчуань), Цзянси (медно-порфировое месторождение Дэсин), Гирин, Шандун. Основная часть месторождений в Канаде расположена на территории Британской Колумбии (рудники Эндако и Китсолт). Ресурсы молибдена в Центральной и Южной Америке представлены, в основном, медно-молибден-порфировыми месторождениями, крупнейшими из которых (Chuquicamata, El Teniente, Los-Pelambres, Andina) владеет чилийская государственная корпорация Codelco (Corp. Nacional del Cobre de Chile). Кроме того, Мексика (месторождение La Caridad) и Перу (рудник Tokepala) располагают весомыми запасами молибдена. В России разведано десять месторождений молибдена, семь из которых промышленно осваиваются. Медно-молибден-порфировые месторождения есть в Сибири: крупнейшее в стране Сорское месторождение в Хакассии, уникальное по своим минералого-физическим и технологическим свойствам Жирекенское и Бугдаинское месторождения в Восточном Забайкалье, Орекитканское - в Бурятии. Разведаны также месторождения Агаскырское (Хакассия) и Лабаш в Беломорском районе Карелии. С 1940 разрабатывается скарновое Тырныаузское вольфрамо-молибденовое месторождение на Северном Кавказе, в Кабардино-Балкарии. В Читинской области есть и жильно-молибденовое месторождение - Шахтаминское, временно законсервированное вследствие истощения основных ресурсов. Руда с крупнейших Сорского и Жирекенского месторождений перерабатывается Сорским и Жирекенским горно-обогатительными комбинатами, оба они являются собственностью ОАО "Группа Сибирский алюминий".
Токсикология молибдена
Молибден, попадающий в организм с растительной пищей, более токсичен, чем его неорганические соединения, и вызывает у животных изменения аналогично селену. Молибденоз наблюдается у людей и животных в определённых географических районах при избытке Мо в почве. Доказана роль Мо как биоэлемента в тканевом дыхании, установлено его влияние на пуриновый обмен, синтез аскорбиновой кислоты, углеводный обмен, на функцию половых желёз и вегетоэндокринные реакции и другие процессы. Существует определённый антагонизм между Mo и Cu; Zn усиливает токсичность Мо; известно взаимосвязь Мо и других микроэлементов, а также Mo с P и S. MoO3 и молибдаты ядовиты, металлический Mo и MoS2 менее токсичны.
У человека молибденоз напоминает подагру; повышается образование мочевой кислоты, наблюдается артрозы, полиартральгии.
У рабочих медно-молибденового комбината в крови повышенное содержание мочевой кислоты, снижены активность каталазы и количество глобулинов, увеличено общее содержание глутатиона. У рабочих молибденового цеха гипотония, лабияльность кровяного дыхания, функциональное нарушение нервной системы, нарушение обменных процессов.
При изготовлении изделий из молибдена в воздушной среде обнаружена высокодисперсная, содержащая молибден, пыль в концентрации 9,6-72,3 мг/м3. При этом у рабочих жалобы на частый кашель, сухость в носу, першение в горле; выявлены атрофические риниты, фарингиты, гастриты, сердечно-сосудистая гистония. При увеличении содержания молибдена в крови человека, содержание витамина С уменьшается.
99Мо циркулирует в крови в виде компелекса с белками; в печени и почках он образует прочный белковый комплекс. При депонировании в костях 64% от локализованного количества молибдена слабо сорбировано минеральной частью поверхностных костных пластинок, остальная часть связанна с альбумоидами и мукоидами кости. Выделение происходит главным образом с мочой. Скорость выделения определяется прочностью фиксации Мо в тканях.
Допустимая концентрация Мо 2-4 мг/м3.
Список литературы
1. Ахметов Н.С. Общая и неорганическая химия. - 3-е издание, перераб. и доп. - М.: Высш. шк., 1998г.
2. Под ред. засл. деят. науки проф. Н.В. Лазарева и докт. биол. наук проф. И.Д. Гадаскиной. Вредные вещества в промышленности. - 7-е изд., перераб. и доп. в трёх томах. Том 3-й. неорганические и элементорганические соединения. - Л.: Хими, 1977г.
3. Зеликман А.Н. Молибден. Сборник, пер. с англ. - М., 1970г.
4. http://www.sbras.ru/HBC/article. phtml? nid=128&id=14
Кафедра ТОПП
Расчётно-графическая работа по неорганической химии
Тема: "Химия элементов"
МОЛИБДЕН
Вариант 3
Факультет: ЭМ
Группа: ЭМ-712 Преподаватель:
Студент: Бусыгина Н.С. Шевницина Л.В.
Новосибирск 2008
Содержание
1. История открытия
2. Молибден в природе
3. Физико-химические свойства молибдена
4. Переработка молибденового сырья
5. Важнейшие соединения молибдена
6. Применение молибдена и его соединений
7. Биологическая роль молибдена
8. Токсикология молибдена
9. Кластеры, содержащие атомы молибдена
Список литературы
История открытия
Молибденит (дисульфид молибдена, MoS2) был известен древним грекам и римлянам с незапамятных времен. Этот свинцово-серый с металлическим блеском минерал (другое название - молибденовый блеск) сходен с галенитом (свинцовым блеском, PbS) и графитом. Мягкость минерала позволяла использовать его (вместе с графитом) как грифель для карандашей, поэтому долгое время молибденит путали с галенитом и графитом, хотя, в отличие от последнего, он оставлял на бумаге зеленовато-серый цвет. Сходство древнегреческих названий свинца - mólubdV, и галенита - molubdaina было причиной того, что в средневековой Европе три минерала (PbS, MoS2 и графит) имели одно название - Molybdaena. История открытия элемента № 42 связана со Швецией. В 1758 шведский минералог и химик Аксель Фредерик Кронштедт (1722-1765) высказал предположение, что графит, галенит и молибденовый блеск три самостоятельных вещества. Двадцать лет спустя, в 1778, химическим составом молибденита заинтересовался шведский химик Карл Вильгельм Шееле. Прокипятив его с концентрированной азотной кислотой, он получил белый осадок "особой белой земли", которую назвал молибденовой кислотой. Хотя во времена Шееле и не знали, что "земли" представляют собой оксиды металлов, уникальная химическая интуиция подсказывала ему, что металл можно получить прокаливанием молибденовой кислоты с углем. Экспериментальные трудности (у него не было подходящей печи) не позволили Шееле самостоятельно решить эту задачу и лишь в 1782 шведскому химику Петеру Якобу Гьельму (Peter Jacob Hjelm), которому Шееле прислал образец молибденовой кислоты, удалось восстановить ее углем и получить королек металла (сильно загрязненного карбидами). После удачно проведенного опыта Шееле писал Гьельму: "Радуюсь, что мы теперь обладаем металлом - молибденом!"
Относительно чистый металл удалось получить много лет спустя Йенсу-Якобу Берцелиусу в 1817. Совершенно чистый молибден, способный к ковке, получили лишь в начале 20 в.
Долгое время с момента открытия молибдена К. Шееле этот металл оставался лабораторной редкостью до того, как в конце 19 в. был предложен промышленный способ извлечения молибденита. В 1891 французская фирма Schneider & Co впервые начала использовать молибден в качестве легирующей добавки, придающей стали одновременно высокую твердость и вязкость. Это редкое сочетание ценных свойств в одном металле было сразу оценено по достоинству, так как, обладая плотностью в два раза меньшей, чем плотность вольфрама, молибден являлся почти равноценной его заменой. Резкий скачок в объеме потребления молибдена произошел во время Первой мировой войны, так как темпы производства металлического вольфрама, использовавшегося в качестве легирующей добавки в производстве броневой стали, явно отставали от темпов его увеличивающегося потребления. К этому времени уже были известны замечательные свойства молибдена как легирующей добавки, но основные проблемы были связаны с нехваткой разведанных месторождений молибденита. Интенсивные поиски увенчались успехом лишь в 1918, когда в "долине облаков", в Колорадо было открыто крупнейшее в мире месторождение Клаймакс. Интересно, что 75-миллиметровая броня (сталь, легированная марганцем) появившихся на полях сражений в 1914-1918 танков англо-французских войск легко пробивалась 75-миллиметровыми снарядами немецкой артиллерии. Стоило только добавить молибден (в количестве всего 1,5-2%) к стали, как эти снаряды становились бессильны даже против 25-миллиметровых броневых листов.
Молибден в природе
Типы месторождений. Молибден относится к редким элементам, его кларк в земной коре равен 1,1·10-4% по массе. Кроме того, оценено общее содержание его во Вселенной (5·10-7% по массе или 10-8% от общего количества атомов), на Солнце (9·10-7% (масс) или 10-8% (ат)), углеродистых метеоритах (1,2·10-4 (масс) или 2,5·10-5% (ат)), морской воде (10-6% (масс) или 6,4·10-8% (ат)), речной воде (8·10-8% (масс) или 8·10-10% (ат)). В природе этот металл встречается только в виде соединений, известно около двух десятков его минералов, среди которых наиболее важны молибденит (MoS2), повелит (CaMoO4), молибдо-шеелит (Ca (Mo,W) O4), молибдит (xFe2O3·yMoO3·zH2O) и вульфенит (PbMoO4). Промышленное значение имеет только молибденит. Молибденовые руды принято делить по минеральному составу и форме рудных тел на жильные (кварцевые, кварц-серицитовые и кварц-молибденит-вольфрамитовые), прожилково-вкрапленные (кварц-молибденит-серицитовые, медно-молибденовые, медные порфировые с молибденом), скарновые (молибденовые, вольфрамо-молибденовые и медно-молибденовые). Серицит - природный алюмосиликат. Скарны - это породы, образовавшиеся на контакте известняков и кислых магматических пород типа гранитов, богатых кварцем. Медно-порфировые месторождения представлены породами, в которых кварцевые жилы с молибденитом образуют прожилки в измененной породе. Раньше наибольшее промышленное значение имели кварцевые жильные месторождения, сейчас жильные месторождения, в основном, выработаны и ценны прожилково-вкрапленные и скарновые месторождения. Более 60% запасов молибдена и около 70% его добычи приходится на медно-молибден-порфировые месторождения. Из них молибден добывается попутно с медью.

Cамое большое в мире месторождение молибдена - Клаймакс (англ. Сlimax - наивысшая точка, так как это самое высокое место в США) было открыто в 1924 в штате Колорадо и законсервировано с 1995 в связи с опасностью перепроизводства молибденовой продукции. Крупнейший рудник не будет разрабатываться до тех пор, пока запасы месторождения Empire в том же комплексе, в 100 км к востоку от Клаймакса, не будут истощены. Добыча молибденсодержащих руд в США ведется в Колорадо (рудник Henderson), Нью-Мексико (месторождение Questa), Айдахо (месторождение Thompson Creek). Попутное извлечение молибдена с медью идет в Аризоне (месторождения Bagdad и Sierrita) и Юте (Bingham Canyon). Точной информации о потенциальных ресурсах молибдена в Китае до сих пор нет, известно лишь, что основная добыча ведется в семи провинциях: Ляонин (горнорудный центр Хулудао), Шаньси (крупнейший молибден-порфировый рудник Циндуичэн), Хэбэй, Хэнань (месторождение Луанчуань), Цзянси (медно-порфировое месторождение Дэсин), Гирин, Шандун. Основная часть месторождений в Канаде расположена на территории Британской Колумбии (рудники Эндако и Китсолт). Ресурсы молибдена в Центральной и Южной Америке представлены, в основном, медно-молибден-порфировыми месторождениями, крупнейшими из которых (Chuquicamata, El Teniente, Los-Pelambres, Andina) владеет чилийская государственная корпорация Codelco (Corp. Nacional del Cobre de Chile). Кроме того, Мексика (месторождение La Caridad) и Перу (рудник Tokepala) располагают весомыми запасами молибдена. В России разведано десять месторождений молибдена, семь из которых промышленно осваиваются. Медно-молибден-порфировые месторождения есть в Сибири: крупнейшее в стране Сорское месторождение в Хакассии, уникальное по своим минералого-физическим и технологическим свойствам Жирекенское и Бугдаинское месторождения в Восточном Забайкалье, Орекитканское - в Бурятии. Разведаны также месторождения Агаскырское (Хакассия) и Лабаш в Беломорском районе Карелии. С 1940 разрабатывается скарновое Тырныаузское вольфрамо-молибденовое месторождение на Северном Кавказе, в Кабардино-Балкарии. В Читинской области есть и жильно-молибденовое месторождение - Шахтаминское, временно законсервированное вследствие истощения основных ресурсов. Руда с крупнейших Сорского и Жирекенского месторождений перерабатывается Сорским и Жирекенским горно-обогатительными комбинатами, оба они являются собственностью ОАО "Группа Сибирский алюминий".
Физико-химические свойства молибдена
МОЛИБДЕН - (Molybdenum), Mo - химический элемент 6 (VI Б) группы периодической системы, атомный номер 42, атомная масса 95,94. Известен 31 изотоп молибдена с 83Мо по 113Мо. Из них стабильные: 92Мо, 94Мо - 98Мо. Шесть этих изотопов и 100Мо (Т½ = 1,00·1019 лет) встречаются в природе: 92Мо (14,84%), 94Мо (9,25%), 95Мо (15,92%), 96Мо (16,68%), 97Мо (9,55%), 98Мо (24,13%), 100Мо (9,63%). Самые нестабильные изотопы элемента № 42 имеют периоды полураспада менее 150 нс. Наиболее устойчивая степень окисления +6.
Внешний вид металлического молибдена зависит от способа его получения. Компактный (в виде слитков, проволоки, листов, пластин) молибден - довольно светлый, но блеклый металл, а молибден, полученный в виде зеркала разложением, например, кабонила - блестящий, но серый.
Молибденовый порошок имеет темно-серый цвет. Плотность молибдена 10280 кг/м3. Температура плавления 2623° С, кипения 4639° С. Известна только одна (при обычном давлении) кристаллическая модификация металла с кубической объемноцентрированной решеткой.
В совершенно чистом состоянии компактный молибден пластичен, ковок, тягуч, довольно легко подвергается штамповке и прокатке. При высоких температурах (но не в окислительной атмосфере) прочность молибдена превосходит прочность большинства остальных металлов.
При загрязнении углеродом, азотом или серой молибден, подобно хрому, становится хрупким, твердым, ломким, что существенно затрудняет его обработку. Водород очень мало растворим в молибдене, поэтому не может заметно влиять на его свойства.
Молибден - хороший проводник электричества, он в этом отношении уступает серебру всего в 3 раза. Электропроводность молибдена больше, чем у платины, никеля, ртути, железа и многих других металлов. В обычных условиях молибден устойчив даже во влажном воздухе.
Его реакционная способность зависит от степени измельченности, и мелкий порошок все же медленно окисляется во влажном воздухе, давая так называемую молибденовую синь.
Энергичное взаимодействие молибдена с водяным паром начинается при 700° С, а с кислородом - при 500° С:
Mo + 2H2O = MoO2 + 2H2↑,
2Mo + 3O2 = 2MoO3.
Молибден сгорает в атмосфере фтора уже при 50-60° С, реакции с другими галогенами протекают при более высоких температурах:
Mo + 3F2 = MoF6
2Mo + 5Cl2 = 2MoCl5.
Разбавленные и концентрированные минеральные кислоты при нагревании растворяют молибден, но концентрированная HNO3 пассивирует его. При повышенных температурах с молибденом взаимодействуют сера, селен, мышьяк, азот, углерод и многие другие неметаллы. Основным промышленным способом получения металлического молибдена является реакция MoO3 с водородом:
MoO3 + 3H2 = Mo + 3H2O.
Процесс проходит в две или три стадии. Сначала молибденовый ангидрид восстанавливается до MoO2, а затем до свободного металла. Первая стадия восстановления проводится при 550° С. Если вторая стадия протекает ниже 900° С, то получающийся металл содержит значительное количество кислорода и поэтому необходима третья стадия восстановления, при 1000-1100° С и выше. Получающийся таким способом металл вполне пригоден для обработки методами порошковой металлургии. Долгое время не удавалось получить молибден в компактном состоянии, и только в 1907 была предложена методика получения молибденовой проволоки. Порошок металла смешивался с органическим клеящим веществом (сахарным сиропом) и продавливался через отверстия матрицы для получения сформованных нитей. Через эти нити в атмосфере водорода пропускался постоянный электрический ток с маленькой разностью потенциалов, при этом происходил сильный разогрев, органическое вещество выгорало, а частицы металла спекались - получалась проволока. Для получения компактного металла сейчас используются приемы порошковой металлургии, позволяющие получать слитки при температурах значительно более низких, чем температура плавления металла. Порошкообразный молибден прессуется на гидравлических прессах в стальных матрицах, нагревается в атмосфере водорода при 1100-1300° С и спекается при 2200° С в атмосфере водорода в толстостенных молибденовых лодочках. Кроме того распространен метод плавления молибдена в вакууме, в электрической дуге, возникающей между стержнем из спрессованного порошка молибдена и охлаждаемым медным электродом при силе тока 7000А и небольшой разности потенциалов. Иногда применяется плавление в сфокусированном пучке электронов или аргоновой плазме.
Дата: 2019-07-31, просмотров: 376.