Сорбентов
Казеин - белок молока, фосфопротеин. В чистом виде представляет собой белый аморфный гигроскопичный порошок без запаха и вкуса, нерастворимый в воде, спирте и эфире, но растворимый в некоторых органических солях.
Из материалов органической природы нами использовался неионогенный гидрофильный полисахарид - микрокристаллическая целлюлоза производства Lachema (Chemapol, Praha-Сechoslovakia), (C6H10O5) n, с молекулярным весом (162,14)n.
Выбор микрокристаллической целлюлозы (МКЦ) в качестве носителя обусловлен, прежде всего, ее доступностью и наличием реакционно-способных групп, легко вступающих в химические реакции. МКЦ - продукт модификации природной целлюлозы, получаемый путем гидролитической деструкции.
МКЦ нерастворима в воде, но растворима в аммиачных растворах солей меди, отличается высокой гидрофильностью и хорошими сорбционными свойствами. МКЦ - легкосыпучий порошок белого цвета, по своим свойствам близка к природной целлюлозе, абсолютно безвредна и нетоксична.
Получение казеина.
50 г сухого молока растирают в 450 мл воды, где уже растворено 3 г лимонной кислоты. Раствор взбивают, затем центрифугируют. Так повторяют несколько раз (отмывка). Полученный осадок высушивают в сушильном шкафу.
2.3. Метод определения удельной адсорбции энтеросорбента по иону кобальта ( II ).
Адсорбционную емкость энтеросорбентов относительно ионов Co2+ определяли по количеству сорбированных ионов металла из стандартных растворов хлорида кобальта [2].
Для количественного определения ионов кобальта в растворе строили градуировочный график. Для этого в пробирки объемом по 10 см3 вносили по 0,005 см3 стандартных водных растворов хлорида кобальта, содержащих 2, 4, 6, и 8 см3 в 1 мл раствора; 0,3 г сухого роданида аммония, 2 см3 воды и доводили объем смеси до 5 см3 пропиловым спиртом. После перемешивания измеряли оптическую плотность относительно контроля в качестве, которого выступал раствор, не содержащий ионов кобальта, на ФЭК-М при длине волны 590 нм.
Удельную адсорбцию Co2+ из раствора на поверхность энтеросорбента определяли следующим образом: в колбы на 100 см3 помещали по две части сухого энтеросорбента и добавляли десятикратный раствор хлорида кобальта известной концентрации (0,2 М; 0,4 М; 0,6 М). Количество несвязавшихся с энтеросорбентом ионов Co2+ определяли спектрофотометрическим методом, описанным выше.
Удельную адсорбцию энтеросорбентов рассчитывали по формуле: 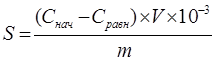 , где
, где
где Снач и Сравн – исходная и равновесная концентрации иона кобальта, моль/л ;
V- обьем раствора CoCl2, см3;
m- масса навески энтеросорбента, г.
2.4. Метод определения удельной адсорбции энтеросорбента по иону железа ( III ).
Адсорбционную емкость энтеросорбентов относительно ионов Fe определяли по количеству сорбированных ионов металла из стандартных растворов хлорида железа.
Для количественного определения ионов железа в растворе проводили титрование. Для этого отбирали пипеткой 5 мл раствора хлорида железа и переносили в колбу для титрования емкостью 100 мл. Осторожно нейтрализовали раствор, прибавляя по каплям при энергичном перемешивании 25%-ный раствор аммиака до появления слабой мути, которую растворяли в 1-2 каплях 6 М соляной кислоты. Затем прибавляли к раствору 2 мл 4 М раствора соляной кислоты , растворяли дистиллированной водой до объема 25 мл, нагревали, добавили 2 капли раствора сульфосалициловой кислоты и титровали раствором ЭДТА до перехода красно-фиолетовой окраски сульфосалицилата железа в светло-желтую ( или бесцветную) характерную для комплексоната железа.
Удельную адсорбцию рассчитывали по формуле:
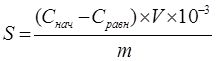 , где
, где
где Снач и Сравн- исходная и равновесные концетрации иона железа, моль/л;
V- обьем раствора хлорида железа, см3;
m- масса навески энтеросорбента, г.
2.5. Метод определения удельной адсорбции энтеросорбента по иону магния ( II ).
Адсорбционную емкость энтеросорбентов относительно ионов Mg определяли по количеству сорбированных ионов металла из стандартных растворов сульфата магния.
Для количественного определения ионов магния в растворе проводили титрование . Для этого отбирали пипеткой 5 мл раствора сульфата магния, переносили в колбу для титрования емкостью 100 мл, прибавляли 2 мл аммиачного буферного раствора и равное количество дистиллированной воды. Прибавляли на кончике шпателя 20-30 мг эриохромого черного Т, перемешивали до полного растворения индикатора. Титровали полученный раствор раствором ЭДТА до изменения окраски раствора из винно-красной в синюю.
Рассчитывали удельную адсорбцию по формуле:
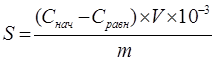 , где
, где
где Снач и Сравн- исходная и равновесная концентрации иона магния, моль/л;
V- объем раствора сульфата магния, см3;
m- масса навески энтеросорбента, г.
Экспериментальная часть
3.1. Синтез энтеросорбентов
На начальном этапе целью исследования явилось получение сорбционных материалов и использование их в качестве энтеросорбентов в медицинских целях.
Получение энтеросорбентов предполагает правильный выбор носителя для иммобилизации. При этом важно учитывать наличие таких положительных свойств твердых матриц как: развитая удельная поверхность, термостабильность, механическая устойчивость, малое изменение объема гранул при изменении рН или ионной силы, наличие функциональных групп, пригодных для селективной химической модификации и устойчивость к воздействию микроорганизмов.
В настоящее время предлагается огромный выбор биокатализаторов, которые могут быть использованы в биотехнологии и медицине в качестве энтеросорбентов, а также для селективного извлечения катионов и анионов из водных (или жидких) сред [13].
На данном этапе исследований перед нами стояла задача получения базового полифункционального сорбента, обладающего высокой сорбционной емкостью и специфичностью, который удовлетворял бы всем вышеперечисленным требованиям, предъявляемым к сорбционным материалам.
Поставленная задача решается способом, включающим гетерогенизацию поверхности микрокристаллической целлюлозы (МКЦ) природным высокомолекулярным соединением казеином.
Технология получения казеина представлена в виде схемы на рисунке 1.
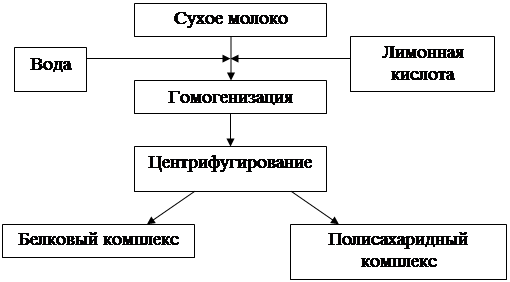 |
Рисунок 1 – Схема получения казеина из сухого молока
Выбор микрокристаллической целлюлозы (МКЦ) в качестве носителя обусловлен, прежде всего, ее доступностью и наличием реакционно-способных групп, легко вступающих в химические реакции, а также тем, что она естественным образом улучшает самоочищение кишечника. Обладая тонизирующим действием на ткани кишечника, усиливает перистальтику и помогает избавиться от контаменантов и слизи, тем самым, улучшая усвоение питательных веществ и воды.
Высокоразвитая поверхность МКЦ, активные концевые группы, образующиеся при гидролитическом расщеплении глюкозидных связей высокополимерной целлюлозы, наличие силанольных групп ≡Si-OH на поверхности аэросила, являются определяющим фактором в процессе модификации поверхности носителя белковыми лигандами.
Использование казеина для активации поверхности носителя обусловлено рядом положительных свойств белкового комплекса: присутствие фосфора в виде фосфосериновых групп, которые определяют анионный характер казеина в нейтральной среде, высокое содержание некоторых аминокислот (глутаминовая кислота, лейцин, пролин) и неполярных остатков отвечает за нерастворимость казеина в воде на уровне изоэлектрической точки (рН 4,6) [1]. Кроме того, первичная структура пептидной цепи отличается присутствием двух контрастных зон: концевая последовательность –NH2 имеет в целом основной и гидрофобный характер; концевая последовательность –СООН является кислой и гидрофильной; и обусловливает ряд важных физико-химических свойств казеинов [7], одно из которых состоит в высокой адсорбционной способности.
Согласно физико-химическим свойствам, казеин является кислотным белком, поэтому хорошо растворяется в растворах щелочей с образованием казеинатов. При концентрации гидроксида натрия ниже 5 % невозможно достичь полного растворения казеина, выше 15 % - может наступить необратимая денатурация белка.
Концентрация казеина для модификации поверхности аэросила выбирается с учетом стерического фактора. Менее 1 мас.% казеина использовать нецелесообразно, т.к. остаются не задействованы в процессе модификации все функциональные группы аэросила. Использование более 15 мас.% казеина недопустимо в связи с конкуренцией молекул казеина за право обладанием центрами связывания, находящихся на поверхности кремнезема.
 Проведен синтез энтеросорбентов на основе микрокристаллической целлюлозы и казеина.
Проведен синтез энтеросорбентов на основе микрокристаллической целлюлозы и казеина.
Технология получения энтеросорбента включает в себя 6 стадий и представлена на рисунке 2.
Жесткой матрицы для иммобилизации казеина служила МКЦ - неионогенный гидрофильный полисахарид. Модификацию поверхности МКЦ казеином проводили в соответствии с методикой изложенной в работе [14].
Стадия 1 характеризует процесс получения казеина из сухого молока.
Стадия 2 включает растворение навески казеина в растворителе. На этой стадии в раствор казеина вводится неорганический газообразователь гидрокарбонат аммония в количестве не более 1-3% по массе. Введение гидрокарбоната аммония позволит исключить загрязнение сорбента контаменантами.

Рисунок 2 - Схема получение сорбента на основе микрокристаллической целлюлозы
Стадия 3 включает суспензирование навески МКЦ и раствора казеина с неорганическим газообразователем.
Стадии 4,5 отражают сушку сорбента под вакуумом при t=500 С до испарения растворителя.
Стадия 6 включает стабилизацию сорбента подкисленным раствором ацетона.
Дата: 2019-07-31, просмотров: 300.