Введение
Печень вовлечена во многие патологические процессы, и ее повреждения вызывают серьезные нарушения метаболизма, иммунного ответа, детоксикации и антимикробной защиты. Печень относится к органам, способным к регенерации после повреждений, благодаря клеточной кооперации, наличию молекулярных механизмов реакции острой фазы и синтезу ряда веществ протекторной природы. Наиболее часто повреждения печени реализуются через химические и иммунологические механизмы.
Ни для кого не секрет, что подавляющая масса населения (по данным ВОЗ – 90%) употребляет алкоголь, причем 40–45% (преимущественно мужчины) алкоголь употребляют регулярно, что осложняется развитием целого ряда заболеваний, в том числе алкогольной болезни печени [1].
Алкогольные поражения печени, наряду с вирусными ее поражениями, в настоящее время занимают ведущее место в гепатологии. Они встречаются наиболее часто у молодого и работоспособного контингента больных. Алкоголизм во многих странах относится к широко распространенным заболеваниям. Так, в США осложнения алкогольной болезни печени служат причиной смерти 13 000 человек ежегодно. В России насчитывается более 10 млн. больных алкоголизмом [14].
Потребление этанола на душу населения в России уже достигло катастрофических цифр 14,6 л/год и занимает, к сожалению, одно из первых мест в мире [2]. Все возрастающий объем потребления алкоголя угрожает не только смертью многим миллионам человек, но и нации в целом. Эта проблема давно приобрела не только медицинское, но и социальное звучание. По данным ВОЗ, деградация нации начинается при употреблении 8 л алкоголя на душу населения.
Результаты довольно спорной антиалкогольной кампании 1985 г. показали, что несмотря на незначительное снижение потребления алкоголя (на 3,7 л) общая смертность упала на 12,3%, а в пересчете на трудоспособных мужчин – основных потребителей алкоголя – на 25,4%! Таким образом, был экспериментально доказан огромный вклад алкоголя в генез общей смертности населения [3]. От алкогольной болезни печени каждый год умирает только по официальным данным до 20 тысяч человек.
Связь употребления алкоголя с развитием цирроза печени впервые установлена M. Baillie в 1793 г. Несмотря на открытие в последние десятилетия многообразных этиологических факторов поражения печени, на сегодняшний день одним из ведущих среди них остается алкоголь. При этом следует учитывать, что не у всех лиц, злоупотребляющих спиртными напитками, развивается поражение печени: частота выявления у них цирроза на вскрытии не превышает 1015%, в то время как у 1/3 изменения печени вообще отсутствуют.
Большинство исследователей сходится во мнении, что риск поражения печени значительно увеличивается при употреблении более 80 г. чистого этанола в день на протяжении не менее 5 лет. Вместе с тем данная доза может рассматриваться, как критическая, вероятно, преимущественно по отношению к мужчинам. Для женщин, несмотря на очевидно большую чувствительность к алкоголю, подобный показатель обычно не указывается, хотя некоторые авторы называют безопасной дозу 20 г. этанола в день.
Развитие алкогольной болезни печени не зависит от типа спиртных напитков, следовательно, при расчете суточной дозы алкоголя у конкретного больного необходимо учитывать только общую концентрацию этанола. Постоянное употребление алкоголя более опасно, поэтому риск алкогольной болезни печени ниже у лиц, употребляющих спиртные напитки с перерывами не менее двух дней в неделю.
Какие дозы алкоголя на сегодня считаются относительно безопасными? Каковы особенности метаболизма этанола и механизмы поражения печени? Каким образом можно доказать алкогольный генез поражения печени при отрицании употребления алкоголя пациентом? И, главное, каким образом и на каком этапе можно приостановить развитие патологического процесса в печеночной паренхиме?
Метаболизм этанола
Алкоголь метаболизируется преимущественно в гепатоцитах. Печень является главным барьером на пути этанола, что и объясняет столь частое ее поражение при хронической алкогольной интоксикации. Лишь 2% этанола выводится легкими и почками.
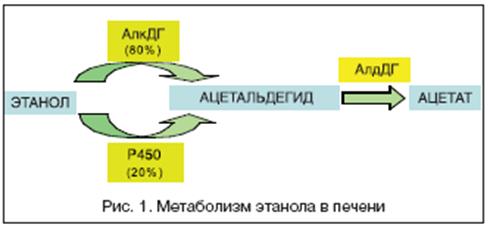
В метаболизме алкоголя участвует несколько ферментов. Около 80% этанола превращается в ацетальдегид под действием АДГ. Выделяют 2 фракции АДГ: желудочную и печеночную. Остальные 20% метаболизируются через систему цитохрома Р 450. В дальнейшем ацетальдегид под действием АлДГ окисляется до ацетата, который в свою очередь метаболизируется до углекислого газа и воды. В результате окисления 1 г этанола вырабатывается 7 ккал. Однако эти калории являются «пустыми», то есть не имеют питательной ценности. Алкоголики получают большое количество энергии (500 мл водки обеспечивает примерно 1400 ккал), но не получают пластических веществ, что приводит к разрушению собственных белков и усугубляет питательную недостаточность. Процессы метаболизма алкоголя приводят к вытеснению жирных кислот как источника «топлива», что объясняет развитие жировой дистрофии гепатоцитов.
Различия в скорости элиминации алкоголя в значительной мере обусловлены генетическим полиморфизмом ферментных систем. АДГ кодируется пятью различными локусами на хромосоме 4. Преобладание наиболее активного изофермента АДГ2, чаще встречающееся у представителей монголоидной расы, служит причиной повышенной чувствительности к спиртным напиткам, проявляющейся тахикардией, потливостью, гиперемией лица. В случае продолжения употребления алкоголя риск развития поражения печени у них выше вследствие усиленного образования ацетальдегида.
10 – 15% этанола метаболизируется в микросомах гладкого эндоплазматического ретикулума микросомальной этанолокислительной системой (МЭОС). Входящий в систему цитохром Р450 2Е1 участвует в метаболизме не только алкоголя, но и ряда лекарственных препаратов, в том числе парацетамола (ацетаминофена). При повышенной нагрузке на МЭОС она проявляет свойства самоиндукции, что в значительной степени обусловливает повышение толерантности к алкоголю на определенном этапе хронического злоупотребления спиртными напитками. Усиленная работа МЭОС ведет к повышенному образованию токсичных метаболитов лекарств, что может явиться причиной поражения печени при применении даже терапевтических доз медикаментов.
Медикаментозное лечение
1. Витаминотерапия. Назначается практически всем пациентам с АБП, особенно при развитии ЦП, так как у подавляющего большинства больных имеется дефицит витаминов. Целесообразно парентеральное введение витаминов В12, В1, B6, РР или комбинированных препаратов и внутрь – фолиевой кислоты. Назначение витамина В12 и фолиевой кислоты особенно показано больным алкоголизмом при наличии в крови макроцитоза эритроцитов.
2. Гепатопротекторы. Традиционно к гепатопротекторам относится довольно широкий спектр препаратов, различных по механизму действия, обладающих избирательным защитным действием на клетки печени.
По происхождению гепатопротекторы подразделяют на несколько групп [9]:
• растительные полифенолы;
• синтетические препараты;
• фосфолипидные препараты;
• органопрепараты.
3. Кортикостероиды используются только в случаях тяжелого алкогольного гепатита либо у пациентов с энцефалопатией для снижения летальности. В большинстве рандомизированных исследований получены данные о достоверном уменьшении летальности при применении 40 мг преднизолона в течение 4 нед. у больных с тяжелой формой острого алкогольного гепатита [12]. В наиболее тяжелых случаях показана пульс–терапия. Начальная доза при внутривенном введении 300 мг/сут. (в течение 2–3 дней), далее переходят на прием препарата внутрь.
4. При развитии цирроза основные усилия должны быть сосредоточены на профилактике и лечении его осложнений (кровотечения из варикозных вен пищевода, асцита, печеночной энцефалопатии).
5. Методом выбора при фульминантной форме ОАГ, а также у некоторых больных с алкогольным циррозом печени может быть трансплантация печени при условии минимум 6-месячной абстиненции [13].
Препараты разных групп
Механизм действия бемитила заключается в активации синтеза РНК, а затем белков в различных клетках. Под влиянием препарата усиливается синтез белков – ферментативных, структурных, белков, имеющих отношение к иммунной системе. Усиление образования митохондриальных ферментов и структурных белков митохондрий обеспечивает увеличение энергопродукции и поддержание высокой степени сопряженности окисления с фосфорилированием. Поддержание высокого уровня синтеза АТФ при дефиците кислорода способствует выраженной антигипоксической и противоишемической активности бемитила. Препарат усиливает синтез антиоксидантных ферментов и обладает достаточно выраженной антиоксидантной активностью. Дополнительный компонент в механизм гепатопротекторного действия препарата вносит его иммуномодулирующий эффект, заключающийся в нормализации гуморального и, преимущественно, клеточного звеньев иммунитета.
Применение бемитила в комплексной восстановительной терапии гепатитов и цирроза печени приводит к ускорению, как клинического выздоровления, так и восстановлению физической работоспособности реконвалесцентов. Отмечено также позитивное влияние препарата на показатели цитолитического и мезенхимально-воспалительного синдромов. Важной особенность препарата является его выраженное влияние на протеинсинтетическую и глюкостатическую функции печени.
S-аденозил-L-метионин (гептрал) играет центральную роль в биохимических реакциях трансметилирования (биосинтез фосфолипидов), транссульфатирования (синтез и оборот глутатиона и таурина, конъюгация желчных кислот с увеличением их гидрофильности, детоксикация желчных кислот и многих ксенобиотиков) и аминопропилирования (синтез таких полиаминов как путресцин, спермидин и спермин, играющие важную роль в формировании структуры рибосом и процессах регенерации), где служит либо донором групп, либо модулятором ряда ферментов. При применении адеметионина повышается элиминация свободных радикалов и других токсических метаболитов из гепатоцитов. В эксперименте показана антифибротическая активность адеметионина. Препарат обладает также антинейротоксическим и антидепрессивным действием. Адеметионин достаточно эффективен при патологии печени, сопровождающейся печеночной энцефалопатией. Следует, однако отметить, что максимальной выраженности гепатопротекторный эффект достигает лишь в том случае, если препарат вводится парентерально. Преимущественное влияние адеметионин оказывает на проявления токсемии и в гораздо меньшей степени влияет на показатели цитолиза и холестаза. Принимается препарат между приемами пищи. Применяют при острых и хронических гепатитах, циррозе печени.
L-орнитин-L-аспартат (гепа-мерц) – достаточно новый препарат для лечения болезней печени, регулирующий обмен веществ в печеночных клетках. В кишечнике препарат диссоциирует на составляющие его компоненты – аминокислоты орнитин и аспартат, которые участвуют в дальнейших биохимических процессах:
1. орнитин включается в цикл мочевины в качестве субстрата (на этапе синтеза цитруллина);
2. орнитин является стимулятором карбамоилфосфатсинтетазы I (первого фермента цикла мочевины);
3. аспартат также включается в цикл мочевины (на этапе синтеза аргининсукцината);
4. аспартат служит субстратом для синтеза глутамина, участвуя в связывании аммиака в перивенозных гепатоцитах, мозге и других тканях.
Таким образом, орнитина аспартат усиливает метаболизм аммиака, как в печени, так и в головном мозге. Выявлено положительное воздействие гепа-мерца на гипераммониемию и динамику энцефалопатии у больных циррозом печени. Способствует нормализации КОС организма, выработке инсулина и соматотропного гормона. Применяется при жировой дистрофии, гепатитах, циррозах, при поражениях печени в результате алкоголизма и наркомании, для лечения нарушений со стороны головного мозга, возникающих в результате нарушения деятельности печени. Продолжительность курса лечения определяется динамикой концентрации аммиака в крови и состоянием больного. Курс лечения можно повторять каждые 2–3 мес.
Урсодеоксихолевая кислота (УДХК) – гидрофильная, нетоксичная, третичная желчная кислота. Её содержание в естественном пуле желчных кислот человека лишь 4%. Прием УДХК приводит к уменьшению энтерогепатической циркуляции гидрофобных желчных кислот, обладающих гепатотоксическим действием, предупреждая тем самым их токсический эффект на мембраны гепатоцитов и на эпителий желчных протоков, подавляет выработку иммуноглобулинов, нормализует антигены HLA-DR на поверхности клеточных мембран, что снижает их аутоиммунность, снижает холестаз-опосредованную иммуносупрессию. Определенное влияние придается и положительному холеретическому влиянию УДХК, которое вследствие увеличения пассажа желчи, обусловливает и усиленное выведение токсических веществ из печени. УДХК обладает антиоксидантным действием, снижая оксидативную активацию Купферовских клеток гидрофобными желчными кислотами. В настоящее время назначение УДХК считается оправданным при заболеваниях печени, сопровождающихся или вызванных холестазом вне зависимости от этиологии. О дозировке УДХК существует единое мнение, которое состоит в том, что суточные дозы препарата, эффективные при холестазе, не отличаются от доз, применяемых для растворения желчных камней, и составляют 8–15 мг/кг массы тела больного. Применяют препарат при острых и хронических гепатитах (включая аутоиммунные), токсических (в том числе алкогольных) поражения печени, неалкогольном стеатогепатите, первичном билиарном циррозе (до формирования выраженной циррозной трансформации печени), гепатопатии беременных.
Кислота альфа-липоевая (липамид, тиоктацид) является коферментом, участвую-щим в окислительном декарбоксилировании пировиноградной кислоты и альфа-кетокислот, играет важную роль в биоэнергетике клеток печени, участвует в регулировании углеводного, белкового, липидного обменов, оказывает липотропный эффект. Она участвует как кофермент в мультиэнзимных комплексах митохондрий:
· в дегидрогеназе пировиноградной кислоты, обеспечивающей преобразование ПВК в ацетил-КоА (образование НАД) через цепь процесса дыхания-АТФ;
· в альфа-дегидрогеназе кетоглутарата, ферменте цитратного цикла, который катализирует преобразование альфа-кетоглутарата в сукцинил-КоА (образование НАД через цепь процесса дыхания-АТФ);
· в дегидрогеназе аминокислот, имеющих разветвленные цепи.
По экспериментальным данным, липоевая кислота обладает иммуномодулирующим действием, восстанавливая иммунный ответ у иммуносупрессированных мышей. Также у препарата выявлена антиоксидантная активность. Дополнительное введение альфа-липоевой кислоты оказывает хороший эффект при патологии, связанной с возникновением оксидативного стресса (реперфузионные повреждения органов, диабет, катаракта, радиационные повреждения). Применяют альфа-липоевую кислоту при вирусном гепатите А, жировом гепатозе, хронических гепатитах, алкогольных поражения и циррозе печени.
Нестероидные анаболики (метилурацил, пентоксил, калия оротат, натрия нуклеинат, рибоксин).
Значение этой группы препаратов в настоящее время незначительно вследствие их относительно невысокой эффективности, однако они иногда еще продолжают применяться при различной патологии печени благодаря низкой токсичности и малой стоимости.
Рибоксин – является пуриновым производным. Проникая через клеточную мембрану фосфорилируется, превращаясь в инозиновую кислоту, которая является общим предшественником адениловых и гуаниловых нуклеотидов. Благодаря этому рибоксин обеспечивает:
· создание основы для образования в ходе окислительного и субстратного фосфорилирования основных макроэргов (улучшается течение энергозависимых реакций и реакций синтеза, активируется тканевое дыхание, оптимизируется утилизация лактата и пирувата);
· формирование пула пуриновых нуклеозидов, который используется в синтезах РНК и ДНК (ускоряются процессы регенерации и адаптивного синтеза);
При лечении рибоксином заболеваний печени действие препарата проявляется в уменьшении нарушений метаболической и антитоксической функций, в ускорении регенерации ткани печени. Применяют препарат острых и хронических гепатитах, циррозе печени.
Калия оротат является единым биохимическим предшественником всех пиримидиновых оснований нуклеиновых кислот. В отличие от рибоксина не содержит остатка рибозы и требует привлечения пентозофосфатного цикла для образования оротидин-5-фосфата, который непосредственно идет на синтез пиримидиновых нуклеотидов. При этом, однако, расходуется значительное количество энергии АТФ (что можно компенсировать одновременным назначением рибоксина). Калия оротат облегчает создание фонда пиримидиновых нуклеотидов, необходимых для оперативных синтезов РНК (а, следовательно, и белка) и редупликации ДНК. При патологии печени препарат наибольшее действие оказывает на протеинсинтетическую функцию, способствует скорейшему восстановлению участия органа в пигментном обмене, сокращается длительность желтушного периода. Дезинтоксикационное действие препарата, однако, нередко оказывается недостаточным. Практически не влияет на процессы холестаза. Назначают, в основном, при острых вирусных гепатитах.
Метилурацил и пентоксил являются аналогами пиримидиновых нуклеотидов, но они практически не включаются в обмен в качестве предшественников в синтез нуклеотидов. Действие этих препаратов реализуется благодаря блокаде фермента уридинфосфатазы, в результате чего уменьшается разрушение д-тимидинмонофосфата, лимитирующего синтез ДНК. В результате происходит стимуляция митогенеза в чувствительных клетках. Активация синтеза РНК и белка носит вторичный характер и менее выражена, чем, например, при введении рибоксина и оротат калия. При патологии печени включение в терапию метилурацила и пентоксила ускоряет восстановление протеинсинтетической функции печени, уменьшает симптомы интоксикации и диспептические явления. Сокращается длительность желтушного периода и улучшается участие печени в пигментном обмене. Повышаются показатели неспецифической резистентности организма. По выраженности гепатопротекторного эффекта метилурацил превосходит пентоксил. Применяют препараты при острых вирусных гепатитах, до и после холецистэктомии (по 1,0ґ3 р/сут ґ10 дней до и после операции).
Натрия нуклеинат – натриевая соль нуклеиновых кислот, получаемых гидролизом дрожжей и дальнейшей очисткой. Содержит как пуриновым, так и пиримидиновых нуклеотиды, которые могут быть использованы в различных нуклеиновых синтезах в организме, активирует протеинсинтез. Подобно метилурацилу стимулирует гранулоцитопоэз и неспецифическую резистентность организма. Применяется в основном при острых гепатитах. Препарат малотоксичен и очень редко вызывает побочные эффекты (аллергического характера). Применяют при острых вирусных гепатитах.
Таким образом, применение гепатопротекторов при поражениях печени различной этиологии является обоснованным с точки зрения механизмов патогенеза данной патологии. Важным фактором является отсутствие выраженной токсичности у препаратов этой группы и небольшое число побочных эффектов даже при грубом поражении паренхимы печени.
Таблица совместимости некоторых гепатопротекторов при заболеваниях печени (Ю.Б. Белоусов и др., 2000)
| Препараты | Эссенциале | Легалон | Катерген | a-Липоевая кислота |
| Эссенциале | - | + | ± | + |
| Легалон | + | - | ± | ± |
| Катерген | ± | ± | - | ± |
| a-Липоевая кислота | ± | ± | ± | - |
– не сочетаются
± только по особым показаниям
+ сочетаются
Выводы
В заключении хочется отметить, что алкогольная интоксикация и алкогольная болезнь печени по сей день остается серьезной угрозой не только здоровью и жизни современного человека, но и угрозой всему обществу, приобретая все более печальные последствия не только в медицинской, но и социальной сфере. На поздних стадиях, к сожалению, алкогольная болезнь печени может прогрессировать даже при воздержании от приема алкоголя. Однако на ранних этапах развития алкогольная болезнь печени полностью обратима, это объясняет необходимость и важность раннего выявления и лечения алкогольного поражения печени, что сможет предотвратить огромное количество смертей, особенно среди молодых работоспособных мужчин.
В клинической практике прежних лет в качестве средств патогенетической терапии применялись самые разные препараты, многие из которых оказались малоэффективными и вышли из употребления. Вместе с тем, широко известные данные о способности ткани печени к регенерации позволяют достаточно высоко оценивать перспективы и потенциальные возможности патогенетической терапии гепатитов с использованием гепатопротекторов.
Лекарственная терапия больных патологией печени должна всегда быть максимально экономной. В каждом случае необходимо сопоставлять степень необходимости назначения препарата и потенциальную опасность его побочного действия. При лечении больных с заболеваниями печени полипрагмазия является крайне нежелательной, а назначаемые дозы, как правило, не должны превышать средних терапевтических и курсовых.
Список использованной литературы
1. Огурцов П.П., Покровский А.Б., Успенский А.Е. Материалы Всерос. форума «Алкоголь и здоровье населения России 1900–2000». М., 1998; 167–73.
2. Мухин Н.А., Лопаткина Т.Н., Танащук Е.Л. Материалы Всерос. форума «Алкоголь и здоровье населения России 1900–2000». М., 1998; 177–80.
3. Немцов А.В. Алкогольная смертность в России, 1980–90-е годы. М., 2001. – 60 с.
4. Хазанов А.И. К вопросу об алкогольных поражениях печени // Рос. мед. вести. – 1998. – №1. – С. 40–44.
5. Калинин А.В. Вопросы патогенеза, клиники и лечения алкогольной болезни печени. Клинические перспективы в гастроэнтерологии, гепатологии 2001, №4, с. 8–14.
6. Enomoto N, Takese S, Takada N et al. Alcoholic liver disease in heterozygotes of mutant and normal aldehyde dehydrogenase-2 genes. Hepatology 1991; 13:1071.
7. Огурцов П.П., Нужный В.П. Экспресс–диагностика (скрининг) хронической алкогольной интоксикации у больных соматического профиля // Клиническая фармакология и терапия. 2001. №1. С. 34–39.
8. Шапошникова Н.А., Дроздов В.Н., Петраков А.В., Ильченко Л.Ю. Дефицит цинка и печеночная энцефалопатия у больных циррозом печени // Гастроэнтерол. межведомств. сб. / под ред. Ю.О. Филиппова. Днепропетровск, 2007. Вып. 38. С. 191–196.
9. Rivera–Penera T, Gugig R, Davis J, et al. Outcome of acetaminophen overdose in pediatric patients and factors contributing to hepatotoxicity. J Pediatr 1997; 130:300–4.
10. Кунц Э., Гундерманн К.Й., Шнайдер Э. «Эссенциальные» фосфолипиды в гепатологии (экспериментальный и клинический опыт) // Терапевтический архив. – 1994. – №2. – С. 660–72.
11. Блюгер А.Ф., Майоре А.Я. Биомембраны гепатоцитов и патология заболеваний печени. – Рига, 1986. – №7. – С. 11–16.
12. Day C. Alcoholic liver diseases // Ceska a slovenska gastroenterol. a hepatol. 2006; 60 (1): 67–70.
13. Lucey M. Is liver transplantation an appropriate treatment for alcoholic hepatitis? // Hepatol. 2002; 36: 829–831.
14. Маевская М.В. Алкогольная болезнь печени //Consilium medicum 2001 т3, 6, стр. 256–260
15. Буеверов А.О. Место гепатопротекторов в лечении заболеваний печени. Бол. орг. пищевар. 2001; 3 (1): 1618.
16. 2. Достижения в лечении хронических заболеваний печени с применением эссенциальных фосфолипидов. Материалы симпозиума 12 апреля 1997 г. Под ред. В.Т. Ивашкина. 1997; 10 с.
17. Abittan C., Lieber C. Alcoholic liver disease. Clin. Perspect. in Gastroenterol. 1999; Sept. Oct.: 25763.
18. Achord J.L. Review and treatment of alcoholic hepatitis: a metaanalysis adjusting for confounding variables. Gut 1995; 37: 1138.
19. Bosron W.F., Ehrig T., Li T.K. Genetic factors in alcohol metabolism and alcoholism. Sem Liver Dis 1993; 13: 12638.
20. Chedid A., Mendenhall C.L., Moritz T.E. Cellmediated hepatic injury in alcoholic liver disease. Gastroenterology 1993; 105: 25460.
21. French S.W., Nash J., Shitabata P. et al. Pathology of alcoholic liver disease. Sem Liver Dis 1993; 13: 15464.
22. Lieber C.S. Alcohol and the liver: 1994 update. Gastroenterology 1994; 106: 108599.
23. Mioni D., Burra P., Pujatti A. et al. Carbohydrate deficient transferrin (CDT) levels in alcohol abusers with and without severe liver disease. Gut 1997; 43 (1): A181.
24. Orrego H., Blake J.E., Blendis L.M. et al. Longterm treatement of alcoholic liver disease with propylthiouracil. Part 2: Influence of dropout rates and of continued alcohol consumption in a clinical trial. J Hepatol 1994; 20: 3439.
25. Plevris J.N., Hayes P.C., Bouchier I.A.D. Ursodeoxycholic acid in the treatment of alcoholic liver disease. Eur J Gastroenterol Hepatol 1991; 3: 6536.
26. Sherlock S., Dooley J. Diseases of the liver and biliary system // 10 ed., Blackwell Science, 1997, P. 30915.
27. Бабак О.Я. Первый клинический опыт применения эссенциале Н на Украине. // Consilium medicum. Экстра выпуск 2001, стр. 11–14
28. Белокрылова Л.В. Вдияние эссенциальных фосфолипидов на структурно-функциональную организацию клеточных мембран тромбоцитов у больных ишемической болезнью сердца. Автореферат дисс. на соиск. уч. степени канд. мед. наук. Тюмень, 1998
29. Минушкин О.Н. Опыт терапии заболеваний печени эссенциальными фосфолипидами //Consilium medicum, Экстра выпуск 2001, стр. 9–11
30. Подымова С.Д. Патогенетическая роль эссенциальных фосфолипидов в терапии алкогольной болезни печени //Consilium medicum, Экстра выпуск 2001, стр. 3–5
31. Ягудина Р.И., Аринина Е.Е. Алкогольная болезнь печени и ее фармакотерапия // Российские аптеки, №23–24 (2009)
Введение
Печень вовлечена во многие патологические процессы, и ее повреждения вызывают серьезные нарушения метаболизма, иммунного ответа, детоксикации и антимикробной защиты. Печень относится к органам, способным к регенерации после повреждений, благодаря клеточной кооперации, наличию молекулярных механизмов реакции острой фазы и синтезу ряда веществ протекторной природы. Наиболее часто повреждения печени реализуются через химические и иммунологические механизмы.
Ни для кого не секрет, что подавляющая масса населения (по данным ВОЗ – 90%) употребляет алкоголь, причем 40–45% (преимущественно мужчины) алкоголь употребляют регулярно, что осложняется развитием целого ряда заболеваний, в том числе алкогольной болезни печени [1].
Алкогольные поражения печени, наряду с вирусными ее поражениями, в настоящее время занимают ведущее место в гепатологии. Они встречаются наиболее часто у молодого и работоспособного контингента больных. Алкоголизм во многих странах относится к широко распространенным заболеваниям. Так, в США осложнения алкогольной болезни печени служат причиной смерти 13 000 человек ежегодно. В России насчитывается более 10 млн. больных алкоголизмом [14].
Потребление этанола на душу населения в России уже достигло катастрофических цифр 14,6 л/год и занимает, к сожалению, одно из первых мест в мире [2]. Все возрастающий объем потребления алкоголя угрожает не только смертью многим миллионам человек, но и нации в целом. Эта проблема давно приобрела не только медицинское, но и социальное звучание. По данным ВОЗ, деградация нации начинается при употреблении 8 л алкоголя на душу населения.
Результаты довольно спорной антиалкогольной кампании 1985 г. показали, что несмотря на незначительное снижение потребления алкоголя (на 3,7 л) общая смертность упала на 12,3%, а в пересчете на трудоспособных мужчин – основных потребителей алкоголя – на 25,4%! Таким образом, был экспериментально доказан огромный вклад алкоголя в генез общей смертности населения [3]. От алкогольной болезни печени каждый год умирает только по официальным данным до 20 тысяч человек.
Связь употребления алкоголя с развитием цирроза печени впервые установлена M. Baillie в 1793 г. Несмотря на открытие в последние десятилетия многообразных этиологических факторов поражения печени, на сегодняшний день одним из ведущих среди них остается алкоголь. При этом следует учитывать, что не у всех лиц, злоупотребляющих спиртными напитками, развивается поражение печени: частота выявления у них цирроза на вскрытии не превышает 1015%, в то время как у 1/3 изменения печени вообще отсутствуют.
Большинство исследователей сходится во мнении, что риск поражения печени значительно увеличивается при употреблении более 80 г. чистого этанола в день на протяжении не менее 5 лет. Вместе с тем данная доза может рассматриваться, как критическая, вероятно, преимущественно по отношению к мужчинам. Для женщин, несмотря на очевидно большую чувствительность к алкоголю, подобный показатель обычно не указывается, хотя некоторые авторы называют безопасной дозу 20 г. этанола в день.
Развитие алкогольной болезни печени не зависит от типа спиртных напитков, следовательно, при расчете суточной дозы алкоголя у конкретного больного необходимо учитывать только общую концентрацию этанола. Постоянное употребление алкоголя более опасно, поэтому риск алкогольной болезни печени ниже у лиц, употребляющих спиртные напитки с перерывами не менее двух дней в неделю.
Какие дозы алкоголя на сегодня считаются относительно безопасными? Каковы особенности метаболизма этанола и механизмы поражения печени? Каким образом можно доказать алкогольный генез поражения печени при отрицании употребления алкоголя пациентом? И, главное, каким образом и на каком этапе можно приостановить развитие патологического процесса в печеночной паренхиме?
Метаболизм этанола
Алкоголь метаболизируется преимущественно в гепатоцитах. Печень является главным барьером на пути этанола, что и объясняет столь частое ее поражение при хронической алкогольной интоксикации. Лишь 2% этанола выводится легкими и почками.
В метаболизме алкоголя участвует несколько ферментов. Около 80% этанола превращается в ацетальдегид под действием АДГ. Выделяют 2 фракции АДГ: желудочную и печеночную. Остальные 20% метаболизируются через систему цитохрома Р 450. В дальнейшем ацетальдегид под действием АлДГ окисляется до ацетата, который в свою очередь метаболизируется до углекислого газа и воды. В результате окисления 1 г этанола вырабатывается 7 ккал. Однако эти калории являются «пустыми», то есть не имеют питательной ценности. Алкоголики получают большое количество энергии (500 мл водки обеспечивает примерно 1400 ккал), но не получают пластических веществ, что приводит к разрушению собственных белков и усугубляет питательную недостаточность. Процессы метаболизма алкоголя приводят к вытеснению жирных кислот как источника «топлива», что объясняет развитие жировой дистрофии гепатоцитов.

Различия в скорости элиминации алкоголя в значительной мере обусловлены генетическим полиморфизмом ферментных систем. АДГ кодируется пятью различными локусами на хромосоме 4. Преобладание наиболее активного изофермента АДГ2, чаще встречающееся у представителей монголоидной расы, служит причиной повышенной чувствительности к спиртным напиткам, проявляющейся тахикардией, потливостью, гиперемией лица. В случае продолжения употребления алкоголя риск развития поражения печени у них выше вследствие усиленного образования ацетальдегида.
10 – 15% этанола метаболизируется в микросомах гладкого эндоплазматического ретикулума микросомальной этанолокислительной системой (МЭОС). Входящий в систему цитохром Р450 2Е1 участвует в метаболизме не только алкоголя, но и ряда лекарственных препаратов, в том числе парацетамола (ацетаминофена). При повышенной нагрузке на МЭОС она проявляет свойства самоиндукции, что в значительной степени обусловливает повышение толерантности к алкоголю на определенном этапе хронического злоупотребления спиртными напитками. Усиленная работа МЭОС ведет к повышенному образованию токсичных метаболитов лекарств, что может явиться причиной поражения печени при применении даже терапевтических доз медикаментов.
Механизмы алкогольного повреждения печени
1. Токсическое действие ацетальдегида. Ацетальдегид, образующийся в печени под воздействием как АДГ, так и МЭОС, обусловливает значительную часть токсических эффектов этанола. Основные из этих эффектов приведены ниже:
· усиление перекисного окисления липидов;
· нарушение электроннотранспортной цепи в митохондриях;
· подавление репарации ДНК;
· нарушение функции микротрубочек;
· образование комплексов с белками;
· стимуляция продукции супероксида нейтрофилами
· активация комплемента;
· стимуляция синтеза коллагена.
Одним из важнейших гепатотоксических эффектов ацетальдегида, проявляющегося в результате усиления перекисного окисления липидов и формирования стойких комплексных соединений с белками, является нарушение функции важнейшего структурного компонента клеточных мебран фосфолипидов. Это ведет к повышениям проницаемости мембран, нарушению трансмембранного транспорта, функционирования клеточных рецепторов и мембраносвязанных ферментов.
Образование ацетальдегидбелковых комплексов нарушает полимеризацию тубулина микротрубочек, что проявляется в патоморфологическом феномене, носящим название алкогольного гиалина или телец Мэллори. Ввиду того, что микротрубочки участвуют во внутриклеточном транспорте и секреции белков, нарушение их функции ведет к задержке белков и воды с формированием баллонной дистрофии гепатоцитов.
На экспериментальных моделях показано, что подавление репарации ДНК при хроническом употреблении этанола ведет к усилению апоптоза программированной смерти клеток.
2. Нарушение липидного обмена. Окисление этанола обусловливает повышенный расход кофермента НАД и увеличение соотношения НАД•Н:НАД. Последнее приводит к сдвигу вправо реакции синтеза глицеро-3-фосфата:
Последствие повышенного синтеза глицеро-3-фосфата усиление эстерификации жирных кислот и синтеза триглицеридов, что служит начальным этапом развития гиперлипидемии и жировой дистрофии печени. Наряду с этим, нарастание концентрации НАД•Н сопровождается снижением скорости окисления жирных кислот, что также способствует их отложению в печени.
3. Нарушение функции митохондрий. Хроническое употребление алкоголя способствует снижению активности митохондриальных ферментов и разобщению окисления и фосфорилирования в электроннотранспортной цепи, что, в свою очередь, приводит к уменьшению синтеза АТФ. В роли непосредственных «виновников» указанных нарушений выступают ацетальдегид и жирные кислоты. Развитие микровезикулярного стеатоза печени, одного из наиболее тяжелых осложнений АБП, связывают с повреждением ДНК митохондрий продуктами перекисного окисления липидов.
4. Повышение клеточного редокспотенциала. Увеличение соотношения НАД•Н:НАД ведет к повышеному синтезу лактата из пирувата, обусловливающему развитие лактатацидоза, наиболее резко выраженного при тяжелых формах острого алкогольного гепатита.
5. Гипоксия и фиброз. Высокая потребность гепатоцитов в кислороде обусловливает прогрессирующее уменьшение концентрации последнего в печеночной дольке от зоны 1 (окружение портальной венулы и печеночной артериолы) к зоне 3 (окружение печеночной венулы). Следовательно, гепатоциты, локализованные в зоне 3, наиболее подвержены последствиям гипоксии фиброзу и некрозу. Более того, максимальное количество цитохрома Р450 2Е1, в составе МЭОС участвующего в метаболизме этанола, обнаруживается именно в зоне 3.
Механизмы этанолиндуцированного фиброгенеза до конца не расшифрованы, однако установлено, что при АБП формирование цирроза может происходить именно путем прогрессирования фиброза в отсутствие выраженного воспаления. Важное звено фиброгенеза активация цитокинов, среди которых особое внимание уделяется трансформирующему фактору роста (TGFb), под воздействием которого происходит трансформация жиронакапливающих клеток Ито в фибробласты, продуцирующие преимущественно коллаген 3 типа. Другим стимулятором коллагенообразования служат продукты перекисного окисления липидов.
6. Иммунные механизмы. Реакции клеточного и гуморального иммунного ответа не только играют существенную роль в повреждении печени при злоупотреблении алкоголем, но и в значительной степени могут объяснить случаи прогрессирования заболевания печени после прекращения употребления спиртных напитков. В то же время выраженные иммунологические сдвиги у больных АБП в большинстве случаев обусловлены иными причинами, нежели непосредственное действие этанола (в частности, инфекцией гепатотропными вирусами).
Участие гуморальных механизмов проявляется прежде всего в повышении уровня сывороточных иммуноглобулинов, преимущественно за счет IgA, и отложении IgA в стенке печеночных синусоидов. Кроме того, в невысоком титре выявляются сывороточные антитела к компонентам ядра и гладкой мускулатуре, а также антитела к неоантигенам (алкогольному гиалину и ацетальдегидбелковым комплексам).
Отражением клеточных механизмов служит циркуляция цитотоксических лимфоцитов у больных острым алкогольным гепатитом. CD4 и CD8 лимфоциты обнаруживаются также в воспалительных печеночных инфильтратах, наряду с повышенной мембранной экспрессией молекул HLA I и II классов. В роли антигеновмишеней в данном случае, повидимому, также выступают продукты взаимодействия метаболитов этанола и клеточных структур. Это подтверждается корреляцией количества ацетальдегидбелковых комплексов в биоптатах печени с параметрами активности заболевания.
У больных АБП выявляют повышенные концентрации сывороточных провоспалительных цитокинов: ИЛ1, ИЛ2, ИЛ6, ТNF, которые участвуют во взаимодействии иммунокомпетентных клеток. Кроме того, ТNFa и ИЛ8 (фактор хемотаксиса нейтрофилов) через стимуляцию продукции активных форм кислорода и оксида азота вызывают повреждение клетокмишеней, обусловливая картину полиорганной недостаточности при остром алкогольном гепатите. На стадии цирроза в качестве мощного стимулятора перечисленных цитокинов присоединяется бактериальный эндотоксин, в избыточных количествах проникающий в системную циркуляцию благодаря повышенной проницаемости кишечной стенки.
Дата: 2019-07-30, просмотров: 333.