ЗАДАНИЕ НА КУРСОВУЮ РАБОТУ
вариант 16
Студенту группы 64-7 Троцюк Анне Васильевне
Тема курсовой работы: Химия и технология производства 2 – нафтола щелочным плавлением.
Задание выдано
________________________________Руководитель Кочетков Б.Б.
Реферат
В данной курсовой работе была произведена оценка и выбрана наиболее выгодная схема получения β - нафтола, подобрано аппаратурное оформление и технологическая схема для его получения.
Курсовая работа содержит 37 страниц, 3 таблицы, 4 рисунка.
Содержание
Введение
1 Назначение и характеристика выпускаемой продукции
2 Технологическая часть
2.1 Кинетика и механизм реакции
2.2 Технология щелочного плавления
2.3 Получение β – нафтола
2.3.1 Щелочное плавление β – соли
2.3.2 Подкисление раствора нафтолята
2.3.3 Очистка 2 – нафтола
3 Контроль процесса щелочного плавления и методы определения гидроксисоединений
4 Аппаратура для обработки продуктов щелочного плавления
5 Безопасность и экологичность работы
Заключение
Список использованных источников
Приложение А
Приложение А.1
Приложение А.2
Приложение Б
Приложение В
Введение
Щелочное плавление - процесс взаимодействия металлических солей сульфокислот со щелочами, приводящих к замещению сульфогруппы гидроксильной группой. Данный метод является одним из основных для получения ароматических гидроксильных соединений, которые очень важны в производстве многих продуктов тонкого органического синтеза. Исходным органическим сырьем в процессах щелочного плавления являются металлические (главным образом натриевые) соли сульфокислот (бензолсульфонат натрия, нафталин сульфонат натрия, натриевые соли нафталинаминосульфокислот, антрахононсульфокислот и т.д.), применяемые в виде растворов, паст и сухих веществ. Неорганическим сырьем, участвующим в этих процессах, являются щелочи (едкий натр, едкое кали, окись кальция и др.), применяемые в виде растворов и расплавов.
Назначение и характеристика выпускаемой продукции
2-нафтолы (β-нафтолы)-бесцветные кристаллы со слабым фенольным запахом; хорошо растворимы в этаноле, диэтиловом эфире, хлороформе, бензоле, плохо - в воде.
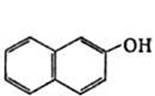
β – нафтол применяется при производстве органических красителей, в парфюмерной промышленности, в медицине.
β – нафтол полупродукт органического синтеза, имеет молекулярную массу М=144,17 г/моль;
плотность p=1,217;
температура кипения t кип=2860С;
температура плавления t пл=1220С;
Растворим в воде (0,074) и в органических растворителях: хлороформе, бензоле, этаноле.
Технологическая часть
Кинетика и механизм реакции
Замена сульфогруппы гидроксигруппой в ароматических соединениях методом щелочного плавления является одним из основных методов получения ароматических гидроксисоединений — важного класса органических соединений, используемых в производстве многих продуктов тонкого органического синтеза, в том числе в производстве органических красителей.
Впервые в 1864 г. Дюзаром и почти одновременно и независимо Вюрцем и Кекуле было осуществлено превращение бензолсульфокислоты в фенол. Эта реакция, в которой один заместитель в ароматическом ядре замещается другим, происходит с разрывом связи С—S и образованием новой связи С—О. Реакции замещения сульфогруппы гидроксигруппой протекают в жестких условиях, при высокой температуре (150—340 °С), часто при действии расплавленной щелочи(NaOH или КОН) с небольшим содержанием воды.
В качестве реагентов для превращения сульфогруппы в гидроксигруппу применяют гидроксид натрия NaOH, гидроксид калия КОН и гидроксид кальция Са(ОН)2 (в ряду антрахинона). Наиболее часто используют NaOH, который более дешев, хотя и менее реакционноспособен, чем КОН. В некоторых случаях используют смесь NaOH и КОН, имеющую более низкую температуру плавления, чем каждый реагент в отдельности (т. пл. NaOH 328 °С, т. пл. КОН 360 °С), что позволяет вести процесс при более низких температурах.
Замещение сульфогруппы в ароматических соединениях гидроксигруппой протекает при действии щелочей на соли сульфокислот (уравнение 1).
ArSO3Na + 2NaOH ® ArONa + Na2SO3 + H2O (1)
Однако в действительности реакция протекает более сложно, чем показано в уравнении (1). При изучении кинетики реакций щелочного плавления бензолсульфокислоты и некоторых нафталинсульфокислот с водными растворами NaOH было найдено, что для большинства сульфокислот реакции имеют второй порядок, а для бензолсульфокислоты, 6-гидрокси- и 7-гидроксинафталин-2-сульфокислот — порядок близок к трем, т. е. наблюда ется первый порядок по сульфокислоте и второй — по щелочи. Эти данные указывают, что реакция протекает в две стадии (схема 2). На первой стадии
-+он- +он-
ArSO3- ¾¾¾®[HOArSO3]2-¾¾® ArO- +SO32-+ Н2О (2)
происходит присоединение гидроксид-иона к аниону аренсульфокислоты с образованием дианиона, который далее (вторая стадия) реагирует со вторым гидроксид-ионом, образуя феноксид-ион, сульфит-ион и воду. Эта схема была предложена Н. Н. Ворожцовым ст. еще в 30-е годы XX века.
В соответствии с общими положениями ароматического нуклеофилыюго замещения и данными, полученными при изучении кинетики этой реакции, в настоящее время механизм щелочного плавления может быть представлен уравнением (3). Считают, что при действии второго гидроксид-иона происходит отрыв протона от гидроксильной группы s-комплекса. Электронодонорное влияние образующегося заместителя О- способствует последующему отщеплению иона SO32-
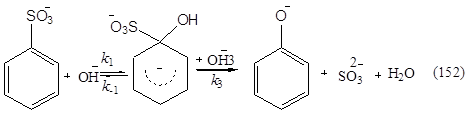 (3)
(3)
Применив, принцип стационарности и определив концентрацию продукта присоединения первого гидроксид-иона (s-комплекса) (уравнение 4) получим для скорости реакции щелочного плавления уравнение (5).
[HOArSO32-] = k1[ArSO3-][ОН-]/ k -1 + k2 [НО-] (4)
v = k1k2 [ArSO3-][НО-]2/k -1 + k2 [НО-] (5)
Если в соответствии с общей схемой щелочного плавления (смотри схему 3) первая стадия (присоединение гидроксид-иона к аниону сульфокислоты) будет медленной стадией, т.е. k1<k2, то скорость реакции щелочного плавления будет определяться уравнением (6), а порядок реакции будет равен 2.
v = k1 [ArSO3-] [НО-] (6)
Если действие второго гидроксид-иона и отрыв сульфит-аниона будут проходить медленно, т. е. k1>k2, и определять скорость всего процесса, то реакция будет описываться уравнением (7) и иметь порядок, равный 3.
v = Kk2 [ArSO3-] [НО-]2 (7)
где K = k1/k-1.
Понижение электронной плотности в реакционном центре, облегчающее нуклеофильную атаку гидроксид-ионом вызывается в основном только индуктивным эффектом ионизированной сульфогруппы. Поэтому реакция имеет высокую энергию активации (143—197 кДж/моль) и протекает в жестких условиях (300—340 °С). Протекание реакции при высокой температуре объясняется тем, что в ходе реакции происходит взаимодействие двух отрицательных ионов — ArSO3- и НО-. Структура промежуточно образующихся s-комплексов объясняет стабильность к щелочному плавлению, например, 4-гидроксибензол-1-сульфокислоты (п-фенолсульфокислоты) и невозможность получения из нее гидрохинона. В этом случае во взаимодействие с гидроксид-ионом должен был бы вступать дианион 4-гидроксибензол-1-сульфо-кислоты, в котором у атома углерода, связанного с сульфогруппой, дополнительно повышается электронная плотность из-за мезомерного влияния ионизированной группы ОН.
Таким образом, введение в молекулу ароматической сульфокислоты электронодонорного заместителя затрудняет реакцию щелочного плавления, и, наоборот, электроноакцепторные заместители облегчают реакцию.
Изучение щелочного плавления [14C] бензолсульфокислоты показало, что гидроксильная группа вступает в то же положение, где находилась сульфогруппа. При щелочном плавлении п-толуолсульфокислоты образуется только п-крезол. При действии на соль бензолсульфокислсмы гидроксидов натрия и калия, обогащенных 18О, было обнаружено, что атом кислорода гидроксида переходит в образующиеся феноксид и воду. Все это является подтверждением рассмотренного выше механизма щелочного плавления.
Согласно имеющимся данным, реакция замещения сульфогруппы гидроксигруппой протекает по механизму ароматического нуклеофильного замещения (присоединения — отщепления), а реакция, протекающая по «ариновому» механизму, практически отсутствует.
Получение b -нафтола
Синтез b-нафтола путем сульфирования нафталина и последующего щелочного плавления (схема 12) является единственным промышленным методом его получения.
H2SO4 Na2SO3 NaOH
C10Н8 ¾¾¾® C10Н7 SO3H¾¾¾® C10Н7 SO3Na¾¾¾®
-H2O -SO2, -H2O -Na2SO3 -H2O
SO2, H2O
C10Н7 ONa¾¾¾®C10Н7 OH (12)
-Na2SO3
Производство 2-нафтола включает стадии щелочного плавления β – соли (рис.2; Приложение А), подкисления раствора нафтолята натрия (рис.3; Приложение А.1) и очистки 2-нафтола (рис.4; Приложение А.2). β – соль для производства 2 – нафтола берут в готовом виде.
Очистка 2 – нафтола
После промывки проводят окончательную очистку 2-нафтола в две стадии - обезвоживанием и дистилляцией.
Сырой 2-нафтол из сборника 1 направляется в обезвоживатель 2, где 2-нафтал расплавляют, нагревая его до 125-130 °С и добавляя воду. Пары воды конденсируются в теплообменнике 5, и конденсат направляется на промывку 2-нафтола, присоединяясь ко второй промывной воде.
Обезвоженный продукт, содержащий не менее 87-90 % 2-нафтола и не более 1,5 % минеральных примесей, передается в перегонный куб 4. При 120-130 °С и вакууме из куба отгоняется остаток воды, поступающий в приемник 8. Увлекаемый парами воды 2-нафтол возвращают из приемника на обезвоживание. При 180-200 °С из куба начинает отгоняться 2-нафтол, первую порцию которого присоединяют к первому погону. Готовый продукт поступает в обогреваемый приемник 9, где поддерживается температура 140-160 °С. Прием чистого 2-нафтола продолжается до тех пор, пока в погоне не появляется желтый оттенок. Погоны желтого продукта направляют в приемник 8. Оставшуюся в кубе смолу передавливают паром в стальной гранулятор 5, залитый водой. Гранулы смолы отфильтровывают на фильтр б, выгружают и отвозят в отвал или на сжигание.
2-нафтол подают в напорный бак 13, а оттуда в барабанный кристаллизатор 14. На линии между приемниками 8,9 и вакуум-насосом установлены ловушки 2-нафтола 10,11,12. Во время перегонки различных фракций ловушки охлаждаются водой. По окончании операций, накопившийся в ловушках 2 - нафтол, расплавляют и направляют в аппарат для обезвоживания 2.(Приложение А.2).
Выход по всему производству 2-нафтола - 74 %.
3 Контроль процесса щелочного плавления и методы определения гидроксисоединений
В процессе щелочного плавления периодически отбирая пробы плава, определяют в них содержание щелочи. Если в двух последовательно взятых пробах содержание щелочи остается постоянным, то это указывает на окончание реакции. Аналогично конец реакции можно определить по количеству образовавшегося в плаве сульфита натрия. Так контролируют, например, процесс щелочного плавления в производствах И- и Гамма-кислот и др. При проведении плавки в автоклаве (например, в производстве Аш-кислоты, С-кислоты и др.) процесс ведут в течение определенного времени.
Образующиеся в результате реакции щелочного плавления гидроксисоединения в большинстве случаев способны при взаимодействии с солями диазония образовывать окрашенные азосоединения. Это свойство лежит в основе их качественного и количественного определения. Если в анализируемом соединении отсутствуют аминогруппы или замещенные аминогруппы, то качественной реакцией может служить появление интенсивной окраски (обычно от оранжевого до красного тонов) при сливании раствора испытуемого соединения и карбоната натрия с раствором диазосоединения. Часто эту пробу выполняют на фильтровальной бумаге, наблюдая окрашивание на границе нанесенных капель указанных растворов. В качестве диазосоединения часто используют хлорид п-нитробензолдиазония или бензолдиазония.
Для количественного определения гидроксисоединения титруют раствором п-нитробелзолдиазония. Предварительно из навески исследуемого вещества готовят примерно 0,05—0,1 н. водный раствор. От этого раствора берут аликвотную часть (20— 25 мл), добавляют карбонат натрия и титруют раствором диазосоединения. Для определения конца титрования на фильтровальную бумагу с помощью стеклянной палочки помещают каплю раствора с взмученным в нем красителем. В месте нанесения капли образуется бесцветный или слегка окрашенный вытек. Рядом с первой каплей наносят каплю диазосоединения. При наличии в пробе гидроксисоединения в месте соприкосновения вытеков появится окрашивание. В начале титрования в пробе содержится гидроксисоединение, количество которого будет уменьшаться по мере титрования. Отсутствие окрашивания означает конец титрования.
При анализе гидроксисоединения, имеющего в своем составе амино-, алкиламино- или ариламиногруппы, повышающие реакционную способность этого соединения по отношению к диазосоединению, результаты анализа по описанной методике могут быть недостаточно точными. При анализе аминогидроксинафталинмоно- или -дисульфокислот, например Аш-кислоты, наряду с сочетанием в орто-положение к гидроксигруппе (положение 6) возможно сочетание в орто-положение к аминогруппе (положение 3), а также сочетание в оба эти положения одновременно. Однако азосочетание с диазосоединением в щелочной среде, обусловленное влиянием гидроксигруппы, протекает со значительно большей скоростью, чем сочетание под влиянием аминогруппы, поэтому для определения аминогидроксинафталинсульфокислот титрование диазосоединениями проводят в щелочной среде (обычно в растворе карбоната натрия).
Для анализа фенола и b-нафтола используют метод йодометрического титрования. Фенол в водном растворе под действием раствора бромида и бромата калия количественно бромируется до трибромфеиола.
Для определения гидроксисоединений широко используют также различные методы хроматографии и спектроскопии.
Способы утилизации отходов
Твердые отходы производства вывозят в отвал или захоранивают. Кроме того, их можно уничтожить сжиганием на специальных условиях. Контроль за состоянием окружающей среды, вредными веществами заключается в установлении стандартов и нормативов на выбросы загрязнителей, соглашениями между местными органами власти и предприятиями, санкциями за нарушение нормативов, правил и законов ГОСТ 17.2.3.02-78.
Таблица 1- Характеристика вредных веществ по системе стандартов безопасности труда
| Наименование | Класс опасности | ПДК, мг/м3 | Воздействие на человека |
| β-нафтол | 4 | 0,1 | А |
| Гидроксид натрия | 3 | 0,5 | А |
| Оксид серы | 3 | 10 | А |
| β-нафтолин-сульфокислота | 4 | 0,5 | А |
А – вещества, способные вызвать аллергические заболевания в производственных условиях.
Заключение
В данной курсовой работе была разработана технологическая схема для получения β - нафтола и подобрано аппаратурное оформление.
Данная технологическая схема получения β – нафтола отражает не только основной прием проведения химического процесса, но и выделения и очистки конечного продукта. К технологической схеме дается пояснение как в виде основных химических процессов, так и виде описания приемов проведения основных и вспомогательных стадий.
Список использованной литературы
1. Технологические схемы производств органических веществ: Учеб. пособие/ Ю.Г. Воробьёв; Иван. гос. хим . - технол.университет; 2000 – 102 с.
2. Стандарт предприятия, ЕСКД. Требования к оформлению текстовых документов СПТ 3.4.204–01, Красноярск, 2001.-43с.
3. СТП 3.4.104-01. Стандарт предприятия. Курсовое проектирование. Требования к выполнению и представлению.- Взамен СТП 17-87. Введен 01.04.01. –Кр-ск: Изд-во СибГТУ, 2001, -12 с.
4. Предельно допустимые концентрации вредных веществ в воздухе и воде. Изд. 2-е, пер. и доп. Л.: «Химия», 1975.-456с.
5.Касаткин А.Г., Основные процессы и аппараты химической технологии. М.: Химия, 1973. – 482с.
6. Касаткин А.Г., Плановский А.Н. Процессы и аппараты промышленности органического синтеза. Часть 1. М.: Редакция химической литературы, 1939. - 492 с.
Приложение А
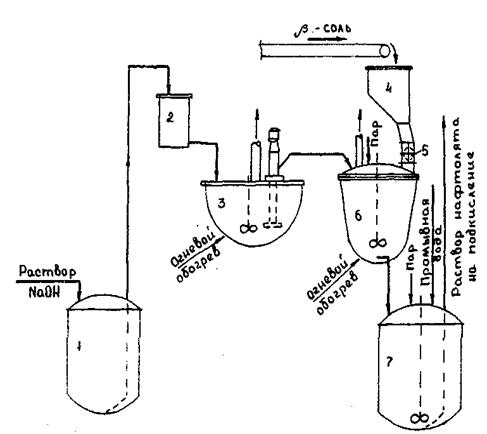
Рис 2 . Технологическая схема щелочного плавления β - соли
1 - сборник едкого натра; 2 - мерники; 3 - выпарной котел; 4 - приемный бункер; 5 - дозатор сульфосоли, поступающей на плавление; 6 - плавильный котел; 7- гаситель.
Приложение А.1
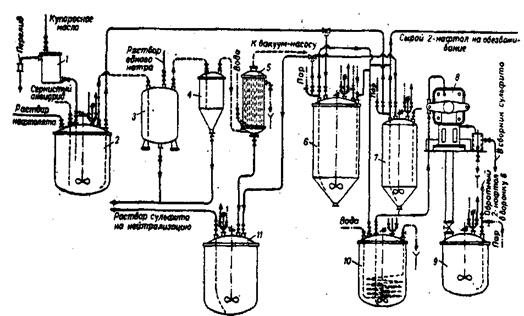
Рис. 3 Технологическая схема подкисления раствора нафтолята
1 - мерник; 2 - подкислитель; 3,4 – ловушви; 5 - конденсатор; 6,7 - промывные воронки; 8 - фильтр-пресс; 9- плавитель; 10- охладитель; 11 –сборник раствора сульфита.
Приложение А.2
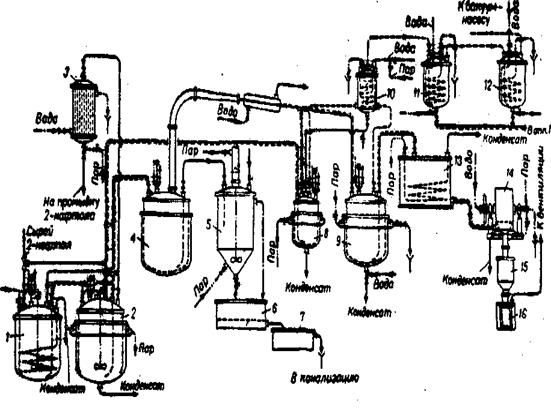
Рис.4 Технологическая схема очистки 2-нафтола:
1 - сборник сырого 2 - нафтола; 2 -обезвоживатель, 3 - конденсатор-теплообменник; 4 - перегонный куб; 5 - гранулятор смолы; 6 - фильтр; 7 - отстойник сточных вод; 8-прнемник; 9 - приемник 2-нафтола; 10,11,12 - ловушки; 13 - напорный бак; 14 - барабанный кристаллизатор; 15 - бункер; 16 - вентилируемый шкаф для разгрузки 2-нафтола.
Приложение Б
Таблица 2 - Физические константы целевых продуктов
| C10H7OH | |
| Молярная масса | 144,17 |
| Цвет, кристаллическая форма | |
| Показатель преломления | --- |
| Плотность | 1,217 |
| Т пл. | 122 |
| Т кип. | 286 |
| Растворимость в H2O при 25оС | 0,074 |
| Растворимость в других растворителях при 20оС | Р., сп., э., хл.,бз. |
Таблица 3 - Физические константы исходных продуктов
| NaOH | SO2 | H2O | |
| Молярная масса | 40,00 | 64,06 | 18,02 |
| Цвет, кристаллическая форма | бел., распл.,крист., ромб. | бц., г или ж. | бц., ж. |
| Показатель преломления | 1,458 | 1,410 | 1,333 |
| Плотность | 2,130 | 2,927 | 1,000 |
| Т пл. | 327,6 | -72,7 | 0,00 |
| Т кип. | 1378 | -10,1 | 100,00 |
| Растворимость в H2O при 20оС | 107 | 22,811,5 | --- |
| Растворимость в H2O при 100оС | 337 | 2,190 | --- |
| Растворимость в других растворителях при 20оС | Р.,сп. | Р.,сп. | ∞, сп. |
Таблица 4 - Физические константы побочных продуктов
| Na2SO3 | H2O | Na2SO4 | |
| Молярная масса | 126,04 | 18,02 | 142,04 |
| Цвет, кристаллическая форма | бц., гекс. | бц., ж. | бц., ромб. |
| Показатель преломления | 1,515 | 1,333 | 1,464 |
| Плотность | 2,633 | 1,000 | 2,698 |
| Т пл. | разл. | 0,00 | 890 |
| Т кип. | --- | 100,00 | --- |
| Растворимость в H2O при 20оС | 30,7 | --- | 52,9 |
| Растворимость в H2O при 100оС | 26,6 | --- | 42,5 |
| Растворимость в других растворителях при 20оС | сл., р.,сп. | ∞, сп. | Р.,глиц., мет., сп. |
Приложение В
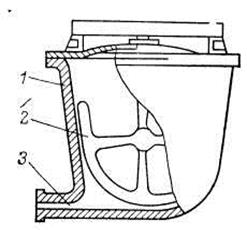
Рисунок 4. Котел для щелочного плавления:
1 — корпус; 2 — мешалка; 3 — нижний спуск для плава
ЗАДАНИЕ НА КУРСОВУЮ РАБОТУ
вариант 16
Студенту группы 64-7 Троцюк Анне Васильевне
Тема курсовой работы: Химия и технология производства 2 – нафтола щелочным плавлением.
Задание выдано
________________________________Руководитель Кочетков Б.Б.
Реферат
В данной курсовой работе была произведена оценка и выбрана наиболее выгодная схема получения β - нафтола, подобрано аппаратурное оформление и технологическая схема для его получения.
Курсовая работа содержит 37 страниц, 3 таблицы, 4 рисунка.
Содержание
Введение
1 Назначение и характеристика выпускаемой продукции
2 Технологическая часть
2.1 Кинетика и механизм реакции
2.2 Технология щелочного плавления
2.3 Получение β – нафтола
2.3.1 Щелочное плавление β – соли
2.3.2 Подкисление раствора нафтолята
2.3.3 Очистка 2 – нафтола
3 Контроль процесса щелочного плавления и методы определения гидроксисоединений
4 Аппаратура для обработки продуктов щелочного плавления
5 Безопасность и экологичность работы
Заключение
Список использованных источников
Приложение А
Приложение А.1
Приложение А.2
Приложение Б
Приложение В
Введение
Щелочное плавление - процесс взаимодействия металлических солей сульфокислот со щелочами, приводящих к замещению сульфогруппы гидроксильной группой. Данный метод является одним из основных для получения ароматических гидроксильных соединений, которые очень важны в производстве многих продуктов тонкого органического синтеза. Исходным органическим сырьем в процессах щелочного плавления являются металлические (главным образом натриевые) соли сульфокислот (бензолсульфонат натрия, нафталин сульфонат натрия, натриевые соли нафталинаминосульфокислот, антрахононсульфокислот и т.д.), применяемые в виде растворов, паст и сухих веществ. Неорганическим сырьем, участвующим в этих процессах, являются щелочи (едкий натр, едкое кали, окись кальция и др.), применяемые в виде растворов и расплавов.
Назначение и характеристика выпускаемой продукции
2-нафтолы (β-нафтолы)-бесцветные кристаллы со слабым фенольным запахом; хорошо растворимы в этаноле, диэтиловом эфире, хлороформе, бензоле, плохо - в воде.

β – нафтол применяется при производстве органических красителей, в парфюмерной промышленности, в медицине.
β – нафтол полупродукт органического синтеза, имеет молекулярную массу М=144,17 г/моль;
плотность p=1,217;
температура кипения t кип=2860С;
температура плавления t пл=1220С;
Растворим в воде (0,074) и в органических растворителях: хлороформе, бензоле, этаноле.
Технологическая часть
Кинетика и механизм реакции
Замена сульфогруппы гидроксигруппой в ароматических соединениях методом щелочного плавления является одним из основных методов получения ароматических гидроксисоединений — важного класса органических соединений, используемых в производстве многих продуктов тонкого органического синтеза, в том числе в производстве органических красителей.
Впервые в 1864 г. Дюзаром и почти одновременно и независимо Вюрцем и Кекуле было осуществлено превращение бензолсульфокислоты в фенол. Эта реакция, в которой один заместитель в ароматическом ядре замещается другим, происходит с разрывом связи С—S и образованием новой связи С—О. Реакции замещения сульфогруппы гидроксигруппой протекают в жестких условиях, при высокой температуре (150—340 °С), часто при действии расплавленной щелочи(NaOH или КОН) с небольшим содержанием воды.
В качестве реагентов для превращения сульфогруппы в гидроксигруппу применяют гидроксид натрия NaOH, гидроксид калия КОН и гидроксид кальция Са(ОН)2 (в ряду антрахинона). Наиболее часто используют NaOH, который более дешев, хотя и менее реакционноспособен, чем КОН. В некоторых случаях используют смесь NaOH и КОН, имеющую более низкую температуру плавления, чем каждый реагент в отдельности (т. пл. NaOH 328 °С, т. пл. КОН 360 °С), что позволяет вести процесс при более низких температурах.
Замещение сульфогруппы в ароматических соединениях гидроксигруппой протекает при действии щелочей на соли сульфокислот (уравнение 1).
ArSO3Na + 2NaOH ® ArONa + Na2SO3 + H2O (1)
Однако в действительности реакция протекает более сложно, чем показано в уравнении (1). При изучении кинетики реакций щелочного плавления бензолсульфокислоты и некоторых нафталинсульфокислот с водными растворами NaOH было найдено, что для большинства сульфокислот реакции имеют второй порядок, а для бензолсульфокислоты, 6-гидрокси- и 7-гидроксинафталин-2-сульфокислот — порядок близок к трем, т. е. наблюда ется первый порядок по сульфокислоте и второй — по щелочи. Эти данные указывают, что реакция протекает в две стадии (схема 2). На первой стадии
-+он- +он-
ArSO3- ¾¾¾®[HOArSO3]2-¾¾® ArO- +SO32-+ Н2О (2)
происходит присоединение гидроксид-иона к аниону аренсульфокислоты с образованием дианиона, который далее (вторая стадия) реагирует со вторым гидроксид-ионом, образуя феноксид-ион, сульфит-ион и воду. Эта схема была предложена Н. Н. Ворожцовым ст. еще в 30-е годы XX века.
В соответствии с общими положениями ароматического нуклеофилыюго замещения и данными, полученными при изучении кинетики этой реакции, в настоящее время механизм щелочного плавления может быть представлен уравнением (3). Считают, что при действии второго гидроксид-иона происходит отрыв протона от гидроксильной группы s-комплекса. Электронодонорное влияние образующегося заместителя О- способствует последующему отщеплению иона SO32-
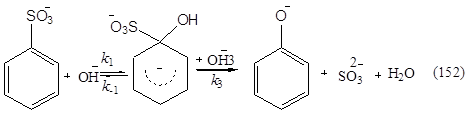 (3)
(3)
Применив, принцип стационарности и определив концентрацию продукта присоединения первого гидроксид-иона (s-комплекса) (уравнение 4) получим для скорости реакции щелочного плавления уравнение (5).
[HOArSO32-] = k1[ArSO3-][ОН-]/ k -1 + k2 [НО-] (4)
v = k1k2 [ArSO3-][НО-]2/k -1 + k2 [НО-] (5)
Если в соответствии с общей схемой щелочного плавления (смотри схему 3) первая стадия (присоединение гидроксид-иона к аниону сульфокислоты) будет медленной стадией, т.е. k1<k2, то скорость реакции щелочного плавления будет определяться уравнением (6), а порядок реакции будет равен 2.
v = k1 [ArSO3-] [НО-] (6)
Если действие второго гидроксид-иона и отрыв сульфит-аниона будут проходить медленно, т. е. k1>k2, и определять скорость всего процесса, то реакция будет описываться уравнением (7) и иметь порядок, равный 3.
v = Kk2 [ArSO3-] [НО-]2 (7)
где K = k1/k-1.
Понижение электронной плотности в реакционном центре, облегчающее нуклеофильную атаку гидроксид-ионом вызывается в основном только индуктивным эффектом ионизированной сульфогруппы. Поэтому реакция имеет высокую энергию активации (143—197 кДж/моль) и протекает в жестких условиях (300—340 °С). Протекание реакции при высокой температуре объясняется тем, что в ходе реакции происходит взаимодействие двух отрицательных ионов — ArSO3- и НО-. Структура промежуточно образующихся s-комплексов объясняет стабильность к щелочному плавлению, например, 4-гидроксибензол-1-сульфокислоты (п-фенолсульфокислоты) и невозможность получения из нее гидрохинона. В этом случае во взаимодействие с гидроксид-ионом должен был бы вступать дианион 4-гидроксибензол-1-сульфо-кислоты, в котором у атома углерода, связанного с сульфогруппой, дополнительно повышается электронная плотность из-за мезомерного влияния ионизированной группы ОН.
Таким образом, введение в молекулу ароматической сульфокислоты электронодонорного заместителя затрудняет реакцию щелочного плавления, и, наоборот, электроноакцепторные заместители облегчают реакцию.
Изучение щелочного плавления [14C] бензолсульфокислоты показало, что гидроксильная группа вступает в то же положение, где находилась сульфогруппа. При щелочном плавлении п-толуолсульфокислоты образуется только п-крезол. При действии на соль бензолсульфокислсмы гидроксидов натрия и калия, обогащенных 18О, было обнаружено, что атом кислорода гидроксида переходит в образующиеся феноксид и воду. Все это является подтверждением рассмотренного выше механизма щелочного плавления.
Согласно имеющимся данным, реакция замещения сульфогруппы гидроксигруппой протекает по механизму ароматического нуклеофильного замещения (присоединения — отщепления), а реакция, протекающая по «ариновому» механизму, практически отсутствует.
Дата: 2019-07-30, просмотров: 328.