Углерод (лат. Carboneum), С - химический элемент IV группы периодической системы Менделеева. Известны два стабильных изотопа 12С (98,892%) и 13С (1,108%).
Углерод известен с глубокой древности. Древесный уголь служил для восстановления металлов из руд, алмаз - как драгоценный камень. Значительно позднее стали применяться графит для изготовления тиглей и карандашей.
Углерод имеет четыре основных аллотропных модификации: алмаз, графит, карбин и фуллерен.
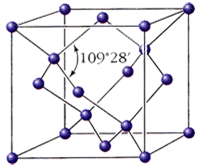
Алмаз - кристаллическое вещество, прозрачное, сильно преломляет лучи света, очень твёрдое, не проводит электрический ток, плохо проводит тепло, ρ = 3,5 г/см3; Т°пл. = 3730 °C; Т°кип = 4830 °C. В структуре алмаза каждый атом углерода находится в состоянии sp3-гибридизации и имеет четырех соседей, которые расположены в вершинах правильного тетраэдра, весь кристалл представляет собой трехмерный каркас, с этим связана высокая твердость алмаза, самая высокая среди природных веществ. Кристаллизуется в виде двух полиморфных модификаций - кубической и гексагональной.
| 
|
| Алмаз кубический | Алмаз гексагональный |
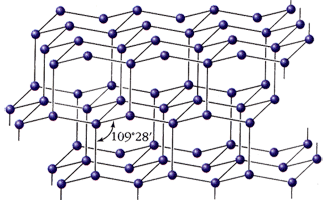
Графит - мягкое вещество серого цвета со слабым металлическим блеском, жирное на ощупь, проводит электрический ток; ρ = 2,5 г/см3. Атомы углерода находятся в состоянии sp2-гибридизации и связаны в плоские слои, состоящие из соединенных ребрами шестиугольников, наподобие пчелиных сот. Каждый атом в слое имеет трех соседей, для образования трех ковалентных связей атом предоставляет три электрона, а четвертый электрон образует p-связь и делокализован по всему кристаллу.
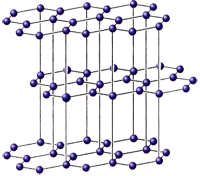
Этим объясняется способность графита расщепляться на тонкие чешуйки, которые очень прочны, его металлический блеск, тепло - и электропроводность. Графит - наиболее устойчивая при комнатной температуре аллотропная модификация углерода.
Углерод - важнейший биогенный элемент, составляющий основу жизни на Земле, структурная единица огромного числа органических соединений, участвующих в построении организмов и обеспечении их жизнедеятельности (биополимеры, а также многочисленные низкомолекулярные биологически активные вещества - витамины, гормоны, медиаторы и др.). Значительную часть необходимой организмам энергии образуется в клетках за счет окисления углерода. Возникновение жизни на Земле рассматривается в современной науке как сложный процесс эволюции углеродистых соединений.
Уникальная роль углерода в живой природе обусловлена его свойствами, которыми в совокупности не обладает ни один другой элемент периодической системы. Между атомами углерода, а также между углеродом и другими элементами образуются прочные химические связи, которые, однако, могут быть разорваны в сравнительно мягких физиологических условиях (эти связи могут быть одинарными, двойными и тройными). Способность углерода образовывать 4 равнозначные валентные связи с другими атомами. Углерод создает возможность для построения углеродных скелетов различных типов - линейных, разветвленных, циклических. Показательно, что всего три элемента - С, О, Н - составляют 98% общей массы живых организмов. Этим достигается определенная экономичность в живой природе: при практически безграничном структурном разнообразии углеродистых соединений небольшое число типов химических связей позволяет на много сократить количество ферментов, необходимых для расщепления и синтеза органических веществ. Особенности строения атома углерода лежит в основе различных видов изомерии органических соединений (способность к оптической изомерии оказалась решающей в биохимической эволюции аминокислот, углеводов и некоторых алкалоидов).
Согласно гипотезе А.И. Опарина, первые органические соединения на Земле имели абиогенное происхождение. Источниками углерода служили (СН4) и цианистый водород (HCN), содержавшиеся в первичной атмосфере Земли. С возникновением жизни единственным источником неорганического углерода, за счет которого образуется всё органическое вещество биосферы, является углерода двуокись (СО2), находящийся в атмосфере, а также растворенная в природных водах в виде НСО3. Наиболее мощный механизм усвоения (ассимиляция) углерода (в форме СО2) - фотосинтез - осуществляется повсеместно зелеными растениями. На Земле существует и эволюционно более древний способ усвоения СО2 путем хемосинтеза; в этом случае микроорганизмы - хемосинтетики используют не лучистую энергию Солнца, а энергию окисления неорганических соединений. Большинство животных потребляют углерод с пищей в виде уже готовых органических соединений. В зависимости от способа усвоения органических соединений принято различать автотрофные организмы и гетеротрофные организмы. Применение для биосинтеза белка и других питательных веществ микроорганизмов, использующих в качестве единственного источника углерода, углеводороды нефти, - одна из важных современных научно - технических проблем.
Помимо стабильных изотопов углерода, в природе распространен радиоактивный 14С (в организме человека его содержится около 0,1мккюри). С использованием изотопов углерода в биологических и медицинских исследованиях связаны многие крупные достижения в изучении обмена веществ и круговорота углерода в природе.
Так, с помощью радиоуглеродной метки была доказана возможность фиксации Н14СО3 растениями и тканями животных, установлена последовательность реакции фотосинтеза, изучен обмен аминокислот, прослежены пути биосинтеза многих биологически активных соединений и т.д. Применение 14С способствовало успехам молекулярной биологии в изучении механизмов биосинтеза белка и передачи наследственной информации.
Определение удельной активности 14С в углеродсодержащих органических остатках позволяет судить об их возрасте, что используется в палеонтологии и археологии.
5. Дайте понятие внутренней энергии. Какие виды внутренней энергии вы знаете? Как измеряется внутренняя энергия? В чем сущность первого начала термодинамики? На сколько градусов повысится температура воды при падении с плотины Саяно-Шушенской ГЭС (высота 222 м), если считать, что 30% потенциальной энергии воды расходуется на нагревание?
Внутренняя энергия, энергия тела, зависящая только от его внутреннего состояния. Понятие Внутренняя энергия объединяет все виды энергии тела, за исключением энергии его движения как целого и потенциальной энергии, которой тело может обладать, если оно находится в поле каких-нибудь сил (например, в поле сил тяготения).
Понятие Внутренняя энергия ввёл У. Томсон (1851), определив изменение Внутренняя энергия (DU) тела (физической системы) в каком-нибудь процессе как алгебраическую сумму количества теплоты Q которой система обменивается в ходе процесса с окружающей средой, и работы А, совершённой системой или произведённой над ней:
DU = Q - A (1)
Принято считать работу А положительной, если она производится системой над внешними телами, а количество теплоты Q положительным, если оно передаётся системе. Уравнение (1) выражает первое начало термодинамики - закон сохранения энергии в применении к процессам, в которых происходит передача теплоты.
Согласно закону сохранения энергии, Внутренняя энергия является однозначной функцией состояния физической системы, т.е. однозначной функцией независимых переменных, определяющих это состояние, например, температуры Т и объёма V или давления р. Хотя каждая из величин (Q и A) зависит от характера процесса, переводящего систему из состояния с В. э. U1 в состояние с энергией U2, однозначность Внутренняя энергия приводит к тому, что DU определяется лишь значениями Внутренняя энергия в начальном и конечном состояниях: DU = U2 - U1. Для любого замкнутого процесса, возвращающего систему в первоначальное состояние (U2 = U1), изменение Внутренняя энергия равно нулю и Q = А.
Изменение Внутренняя энергия системы в адиабатном процессе (при отсутствии теплообмена с окружающей средой, т.е. при Q = 0) равно работе, производимой над системой или произведённой системой.
В случае простейшей физической системы - идеального газа - изменение Внутренняя энергия, как показывает кинетическая теория газов, сводится к изменению кинетической энергии молекул, определяемой температурой. Поэтому изменение Внутренняя энергия идеального газа (или близких к нему по свойствам газов с малым межмолекулярным взаимодействием) определяется только изменением его температуры (закон Джоуля). В физических системах, частицы которых взаимодействуют между собой (реальные газы, жидкости, твёрдые тела), Внутренняя энергия включает также энергию межмолекулярных и внутримолекулярных взаимодействий. Внутренняя энергия таких систем зависит как от температуры, так и от давления (объёма).
Экспериментально можно определить только прирост или убыль Внутренняя энергия в физическом процессе (за начало отсчёта можно взять, например, исходное состояние). Методы статистической физики позволяют, в принципе, теоретически рассчитать Внутренняя энергия физической системы, но также лишь с точностью до постоянного слагаемого, зависящего от выбранного нуля отсчёта.
В области низких температур с приближением к абсолютному нулю (-273,16°С) Внутренняя энергия конденсированных систем (жидких и твёрдых тел) приближается к определённому постоянному значению U 0, становясь независимой от температуры. Значение U 0 может быть принято за начало отсчёта Внутренняя энергия.
Внутренняя энергия относится к числу основных термодинамических потенциалов. Изменение Внутренняя энергия при постоянных объёме и температуре системы характеризует тепловой эффект реакции, а производная Внутренняя энергия по температуре при постоянном объёме определяет теплоёмкость системы.
Закон сохранения и превращения энергии, распространенный на тепловые явления, носит название первого закона термодинамики.
В общем случае при переходе системы из одного состояния в другое внутренняя энергия меняется одновременно как за счет совершения работы А, так и за счет передачи количества теплоты Q:
Δ U = A + Q
Ускорение свободного падения: 10 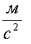 Число Авогадро: 6*1023
Число Авогадро: 6*1023 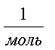 Молярная масса воды: 18*10-3
Молярная масса воды: 18*10-3 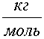
6. Что такое фазовое равновесие, перегретая жидкость, процессы сублимации и десублимации? Опишите физическую картину процесса кипения. Как зависит точка кипения от внешнего давления? Приведите примеры проявления этих процессов в природе
Фазовое равновесие, сосуществование термодинамически равновесных фаз гетерогенной системы. Является одним из основных случаев термодинамического равновесия и включает в себя условия равенства температуры всех частей системы (термич. равновесие), равенства давления во всем объеме системы (мех. равновесие) и равенство хим. потенциалов каждого компонента во всех фазах системы, что обеспечивает равновесное распределение компонентов между фазами. Число фаз f, находящихся одновременно в равновесии, связано с числом компонентов k, числом n независимых параметров, определяющих состояние системы (обычно, когда учитывается только влияние т-ры и давления, n = 2), и числом термодинамич. степеней свободы v ур-нием: v = k + 2 - f.
В общем виде условие фазовое равновесие, согласно принципу равновесия Гиббса, сводится к максимуму энтропии S системы при постоянстве внутр. энергии U, общего объема V и числа молей каждого компонента ni-. Этот принцип можно выразить также как условие минимума любого из термодинамич. потенциалов: внутр. энергии U, энтальпии H, энергии Гиббса G, энергии Гельмгольца А при условии постоянства соответствующих параметров состояния, включая число молей каждого компонента.
Сублимация - переход из твердой фазы в газообразную. Десублимация - переход из газовой фазы в твердую.
Испарение может происходить не только с поверхности, но и в объеме жидкости. В жидкости всегда имеются мельчайшие пузырьки газа. Если давление насыщенного пара жидкости равно внешнему давлению (т.е. давлению газа в пузырьках) или превышает его, жидкость будет испаряться внутрь пузырьков. Пузырьки, наполненные паром, расширяются и всплывают на поверхность. Этот процесс называется кипением. Таким образом, кипение жидкости начинается при такой температуре, при которой давление ее насыщенных паров становится равным внешнему давлению.
В частности, при нормальном атмосферном давлении вода кипит при температуре 100 °С. Это значит, что при такой температуре давление насыщенных паров воды равно 1 атм. При подъеме в горы атмосферное давление уменьшается, и поэтому температура кипения воды понижается (приблизительно на 1 °С на каждые 300 метров высоты). На высоте 7 км давление составляет примерно 0,4 атм, и температура кипения понижается до 70 °С.
В герметически закрытом сосуде жидкость кипеть не может, т.к при каждом значении температуры устанавливается равновесие между жидкостью и ее насыщенным паром. По кривой равновесия p0 (T) можно определять температуры кипения жидкости при различных давлениях.
При заданной температуре T термодинамическое равновесие между двумя фазами одного и того же вещества возможно лишь при определенном значении давления в системе. Зависимость равновесного давления от температуры называется кривой фазового равновесия. Примером может служить кривая равновесия p0 (T) насыщенного пара и жидкости. Если кривые равновесия между различными фазами данного вещества построить на плоскости (p, T), то они разбивают эту плоскость на отдельные области, в которых вещество существует в однородном агрегатном состоянии - твердом, жидком или газообразном (рис.1). Изображенные в координатной системе (p, T) кривые равновесия называются фазовой диаграммой.
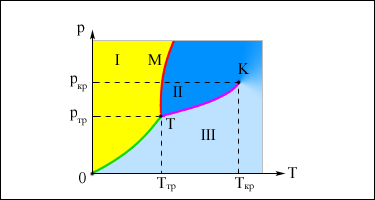
|
| Рисунок 1. Типичная фазовая диаграмма вещества. K - критическая точка, T - тройная точка. Область I - твердое тело, область II - жидкость, область III - газообразное вещество. |
Кривая OT, соответствующая равновесию между твердой и газообразной фазами, называется кривой сублимации. Кривая TK равновесия между жидкостью и паром называется кривой испарения, она обрывается в критической точке K. Кривая TM равновесия между твердым телом и жидкостью называется кривой плавления. Кривые равновесия сходятся в точке T, в которой могут сосуществовать в равновесии все три фазы. Эта точка называется тройной точкой.
Для многих веществ давление pтр в тройной точке меньше 1 атм ≈ 105 Па. Такие вещества при нагревании при атмосферном давлении плавятся. Например, тройная точка воды имеет координаты Tтр = 273,16 К, pтр = 6,02·102 Па. Эта точка используется в качестве опорной для калибровки абсолютной температурной шкалы Кельвина. Существуют, однако, и такие вещества, у которых pтр превышает 1 атм. Так для углекислоты (CO2) давление pтр = 5,11 атм и температура Tтр = 216,5 К. Поэтому при атмосферном давлении твердая углекислота может существовать только при низкой температуре, а в жидком состоянии при p = 1 атм она вообще не существует. В равновесии со своим паром при атмосферном давлении углекислота находится при температуре 173 К или -80 °С в твердом состоянии. Это широко применяемый "сухой лед", который никогда не плавится, а только испаряется (сублимирует).
Дата: 2019-07-30, просмотров: 319.