Химическая связь
1. Соединением с ковалентной неполярной связью является:
1) CrO 3
2) P 2 O 5
3) SO 2
4) F 2
Между атомами водорода и углерода образуется
1) σ - связь
2) π - связь
3) двойная ( σ и π )
4) тройная ( σ и 2 π )
В какой частице есть связь, образованная по донорно-акцепторному механизму?
1) О2
2) SО3
3) Н3О+
4) Н2О2
4. Какое пространственное строение может иметь молекула, центральный атом которой находится в sp 2 -гибридном состоянии?
Тетраэдр
Равносторонний или равнобедренный треугольник
Треугольная пирамида
Плоский квадрат
5. Кратность связи N - N в молекуле N 2 равна:
1) 1
2) 2
3) 2,5
4) 3
6. Геометрическая форма молекулы BCl3
Линейная
Треугольная
Тетраэдрическая
Пирамидальная
Тип гибридизации атомных орбиталей углерода в молекуле HCN
1) sp 3
2) sp 2
Sp
4) sp 2 d
8. Какое утверждение ошибочно: в ионе Н3О+:
1) атом кислорода находится в состоянии sp 3 -гибридизации
Геометрическая форма -пирамида
Положительный заряд сосредоточен на атоме кислорода
Кратность связи равна 1
9. При образовании химической связи электронная плотность между взаимодействующими атомами
Уменьшается
Увеличивается
Исчезает
Не изменяется
10. Условием образования ковалентной химической связи является:
Обязательное возбужденное состояние хотя бы одного из атомов
Наличие у взаимодействующих атомов неспаренных электронов с антипараллельными спинами
Наличие гибридных атомных орбиталей у взаимодействующих атомов
Появление эффективных зарядов на взаимодействующих атомах
Ионная связь не обладает
Длиной
Энергией
Насыщаемостью
Прочностью
Температура кипения воды выше,чем температура кипения сероводорода,потому что
Кислород имеет меньший радиус атома
У атома кислорода отсутствуют d -орбитали
Вода имеет меньшую молекулярную массу
Молекулы воды связаны водородными связями
В каком из перечисленных веществ есть водородные связи?
1) СН4
2) С6Н5ОН
3) NH4Cl
4) CH3COONa
Валентность азота меньше его степени окисления (по абсолютной величине) в молекуле
Аммиака
Азотной кислоты
Азота
Оксида азота (II)
15. Электроотрицательность элементов по ряду N – P – As – Sb :
Возрастает
Убывает
Не изменяется
4) сначала возрастает, а затем остается постоянной
16. Какое утверждение ошибочно: связь О-О в молекуле Н2О2:
Ковалентная
Неполярная
Одинарная( s )
Двойная( s , p )
Ионный характер связи наиболее выражен в соединении
1) CCl 4
2) SiO 2
3) CaBr 2
4) NH 3
18. Элементы с электронной конфигурацией валентных электронов2 s ²2 p 2 и 3 s ² 3 p 2
образуют между собой химическую связь:
Металлическую
Ковалентную неполярную
Ковалентную полярную
Ионную
19. Одна связь (или несколько )образована по донорно-акцепторному механизму в:
1) PCl 5
2) POCl 3
3) PH 3
4) PH 4 +
20. Число σ -связей в молекуле C 2 H 6 :
1) 4
2) 5
3) 6
4) 7
Кратность связи С- O в молекуле оксида углерода ( II )
1) 1
2) 2
3) 2,5
4) 3
22. Геометрическая форма молекулы CH 4 и гибридизация атомных орбиталей углерода :
1) октаэдрическая; sp 3 d 2 - гибридизация атомных орбиталей
2) треугольная; sp 3 - гибридизация атомных орбиталей
3) тетраэдрическая; sp 3 - гибридизация атомных орбитале й
4) пирамидальная ; sp 3 - гибридизация атомных орбиталей
23. Угол между связями (валентный) в молекуле NH 3 и гибридизация атомных орбиталей азота соответственно:
1) 109о28; sp 3
2) 104о5; sp 3
3) 107о; sp 3
4) 120о; sp 2
24. Как меняется прочность ковалентной связи Н-Э в ряду H 2 O → H 2 S → H 2 S е → H 2 Те
Прочность связи возрастает
Уменьшается
Не изменяется
Растет, затем уменьшается
25. К веществам с ионным типом химической связи относятся:
КCl
2) NO2
3) CH3COOH
4) PF5
26. Укажите, молекулы каких соединений из приведенного ряда способны ассоциироваться за счет водородных связей:
1) CCl4, CH4, CaF2
2) CHCl3, H2CO3, NaOH
3) H2O, HF, C2H5OH
4) CH4, CaF2, H2CO3
27. Укажите, какие атомы могут участвовать в образовании донорно- акцепторной связи;
K, Br, Na, Cl
Be, B, O, N а
Cu, Fe, Zn, Al
H, C, Cu, I
28. Механизм образования химической связи между металлом-комплексообразователем и лигандами в комплексных соединениях:
Обменный;
Радикальный
Ионный.
Донорно-акцепторный;
29. Кратность связи в молекуле определяется:
Числом p -связей;
Ионная;
Ковалентная неполярная;
Металлическая.
Донорно- акцепторная
33. Электронная конфигурация 1 s 1 соответствует атому элемента:
Азот
Кислород
Кремний
Водород
Аминокислот
37. Комплексообразователем в молекуле гемоглобина является ион:
1) 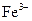 2)
2) 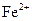 3)
3) 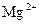 4)
4) 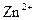
Hb – сильный электролит
Почему нитриты токсичны:
Превращают Hb в мет Hb ;
Блокируют карбоксипептидазу
На усилении гидролиза АТФ
41. Причина образования химической связи - это:
1) уменьшение энергии системы
2) обобществление валентных электронов
3) наличие неспаренных электронов у взаимодействующих атомов
4) наличие гибридных атомных орбиталей (АО) у взаимодействующих атомов
42. s - связь образуется в результате перекрывания АО:
Энергии связи
Типа гибридизации АО
Типа связи ( s или p )
Энергией
Длиной
Ненасыщаемостью
Направленностью
HClO
3) KClO 4
4) Cl 2
48. Пара соединений, все связи в которых – ковалентные:
NaCl, HCl
2) CO2, PbO2
3) CH3Cl, CH3COONa
4) SO2, NO2
49. Электроотрицательность элементов в ряду Si – P – S – Cl :
Возрастает
Убывает
Не изменяется
HI
HBr
HCI
HF
1) 8
2) 6
3) 10
4) 2
53. Какой тип связи в молекуле Н2?
В одородная
К овалентная неполярная
Д онорно-акцепторная
Ионная
54. Какое утверждение ошибочно: в ионе NH 4 +
1) одна из химических связей образована по донорно-акцепторному механизму
2) гибридизация атомных орбиталей азота- sp 3
Геометрия-тетраэдрическая
1) 1
2) 1,5
3) 2
4) 3
Это одно и тоже
58. Какое утверждение ошибочно: при образовании химической связи происходит
Увеличение энергии системы
Требует затраты энергии
I и -2
II и -2
3) II и +1
II и -1
1) 10
2) 3
3) 18
4) 16
HF, HCl, HBr
2) NH3, PH3, AsH3
3) H2Se, H2S, H2O
4) CO2, CS2, CSe2
64. Элементы с электронной конфигурацией 4 s ² и 2 s ² 2 p ³ валентных электронов образуют между собой химическую связь:
Металлическую
Ковалентную неполярную
Ковалентную полярную
Ионную
Ионной
Ковалентной полярной
Ковалентной неполярной
Металлической
1) 1
2) 1,33
3) 1,5
4) 2
70. Геометрическая форма молекулы CO 2
Линейная
Треугольная
Пирамидальная
Уголковая
71. Какое утверждение ошибочно: в ионе AlH 4 -
1) атомные орбитали алюминия находятся в dsp 2 -гибридном состоянии
Геометрия-тетраэдрическая
Поляризуемостью
Степенью окисления атомов
Энергией связи
74. В ряду H2O – H2S – H2Se – H2Te увеличивается :
Полярность связи
Энергия связи
Длина связи
Прочность связи
Возрастает
Убывает
Не изменяется
Аргон
Фтор
Бром
Железо
Водородная, ионная
Ковале нтная, водородная
CaO
3) CO 2
4) CrO 3
79. Элементы с электронной конфигурацией валентных электронов 4 s ¹ и 3 s ² 3р5
Металлическую
Ковалентную неполярную
Ковалентную полярную
Ионную
80. Сколько электронов участвуют в образовании химических связей в молекуле метана?
5) 8
6) 6
7) 10
8) 2
Химическая связь
1. Соединением с ковалентной неполярной связью является:
1) CrO 3
2) P 2 O 5
3) SO 2
4) F 2
Между атомами водорода и углерода образуется
1) σ - связь
2) π - связь
3) двойная ( σ и π )
4) тройная ( σ и 2 π )
Дата: 2019-07-24, просмотров: 413.