Вступление
Для создания электронных приборов необходим целый арсенал материалов и уникальных и тонких технологических процессов. Современная радиотехника и особенно высокочастотная техника (радиосвязь), приборы и аппаратура радиоэлектроники требуют большого количества конструкционных и специальных радиотехнических материалов, свойства которых должны удовлетворять самым разнообразным условиям их применения. Под радиотехническими материалами принято понимать материалы, которые обладают особыми свойствами по отношению к электрическому, магнитному и электромагнитному полям. Они разделяются на 4 группы:
1) проводники
2) диэлектрики
3) полупроводники
4) магнитные материалы
Требования, которым должны удовлетворять радиоматериалы:
1) обладать высокими электрическими (магнитными) характеристиками.
2) нормально работать при повышенных, а иногда при низких температурах.
3) иметь достаточную механическую прочность при различных видах нагрузки, устойчивостью к тряске, вибрации, ударам…
4) обладать достаточной влагостойкостью, химической стойкостью, стойкостью к облучениям.
5) не иметь заметно выраженного старения.
6) удовлетворять технологичности, т.е. сравнительно легко обрабатываться.
7) быть недорогими и не дефицитными.
Глава 1
Классификация и основные сведения о проводниковых материалах
Виды проводников
Проводниками электрического тока могут служить твёрдые тела, жидкости, а при соответствующих условиях и газы
Твёрдыми проводниками являются металлы, металлические сплавы и некоторые модификации углерода. За последнее время получены также органические полимеры. Среди металлических проводников различают:
а) материалы, обладающие высокой проводимостью, которые используют для изготовления проводов, кабелей, проводящих соединений в микросхемах, обмоток трансформаторов, волноводов, анодов мощных генераторных ламп и т.д.
б) металлы и сплавы, обладающие высоким сопротивлением, которые применяются в электронагревательных приборах, лампах накаливания, резисторах, реостатах.
К жидким проводникам относятся расплавленные металлы и различные электролиты. Как правило температура плавления металлов высока за исключением ртути (-39°C), галлия (29,8°C) и цезия (26°C). Механизм протекания тока обусловлен движением свободных электронов. Поэтому металлы называются проводниками первого рода. Электролитами или проводниками второго рода являются растворы солей, кислот и щелочей. Все газы и пары, в том числе пары металлов при низкой напряженности не являются проводниками. При высоких напряженностях может произойти ионизация газа, и ионизированный газ, при равенстве числа электронов и положительных ионов в единице объёма, представляет собой особую равновесную проводящую среду, которая называется плазмой.
Металлическая связь
Как особый вид связи осуществляется в жидком и твёрдом (кристаллическом) состояниях (имеется также и аморфное состояние металлов). В парообразном состоянии металлические атомы имеют ковалентную связь (т.е. общую электронную пару) и, следовательно, являются диэлектриками.
Элементарная решетка лития – кубическая объёмно центрированная, следовательно, надо осуществить связь по крайней мере в элементарной решетке Li9, а валентный электрон всего один и он должен находиться между всеми восемью «соседями», поэтому он должен быть делокализован. МВС (метод валентных связей) не описывает металлическую связь в кристаллах, она может быть описана только методом молекулярных орбиталей (ММО) т.е. зонной теорией твёрдого тела. Согласно зонной теории для всех металлов ширина запрещённой зоны = 0, например: Na…3s1, Mg…3s2, Al…3s23p1.
Na
|
Mg
Содержит 100 атомов, следовательно, 100 уровней, может быть 200 электронов, есть 200, следовательно, 3s зона (ВЗ) полностью заполнена, 3p – зона проводимости ЗП получается из 3p подуровней. В случае с Mg ЗП накладывается на ВЗ, и поэтому электрону не требуется большой энергии для перехода в эту зону (ΔE = 0);
Al
ВЗ полностью заполнена и ΔE = 0.
Классификация металлов
(1)физические свойства металлов
| группа и название металлов | d кг/м3 плотность при 20°С | Температура °С | теплопроводность, Вт/мК при 20°С | ρ удельное сопротивление *106 | |
| плавления | кипения | ||||
| лёгкие цветные металлы | |||||
| Al | 2699 | 660 | 2060 | 211.0 | 0.0265 |
| Mg | 1740 | 650 | 1107 | 157.4 | 0.047 |
| Ti | 4540 | 1800 | 3400 | 14.9 | 0.47 |
| тяжелые цветные металлы | |||||
| Ni | 8900 | 1455 | 2730 | 58.6 | 0.068 |
| Zn | 7140 | 419 | 907 | 111.1 | 0.059 |
| Sn | 7300 | 232 | 2270 | 63.1 | 0.115 |
| Cu | 8960 | 1083 | 260 | 385.2 | 0.0167 |
| Pb | 11340 | 327 | 1740 | 34.6 | 0.2065 |
| малые цветные металлы | |||||
| Mo | 10200 | 2625 | 4800 | 140 | 0.0517 |
| W | 19350 | 3377 | 6000 | 160 | 5.03 |
| благородные цветные металлы | |||||
| Au | 19320 | 1063 | 2600 | 311 | 0.0225 |
| Ag | 10490 | 960 | 2210 | 421 | 0.0159 |
| Pt | 21450 | 1773 | 4410 | 69.9 | 0.109 |
| редкие металлы | |||||
| Ge | 5360 | 958 | 1760 | — | 0.89 (при 0) |
| Nb | 8570 | 2420 | 3700 | — | 0.131 |
| Ta | 11600 | 2850 | 5050 | 54.4 | 0.124 |
(2) Металлы высокой проводимости Cu , Ag , Al .
Медь (Cu), достоинства
1) малое удельное сопротивление (уступает только серебру)
2) достаточно высокая механическая прочность
3) удовлетворительная стойкость к коррозии
4) хорошая обрабатываемость (прокатывается в листы, в ленту, протягивается в проволоку)
5) относительная легкость пайки и сварки
Содержание примесей влияет на различные свойства меди. Медь марки М1 содержит 99.90% меди, примеси 0.10%, медь марки М0 содержит 99.95% меди, примеси 0.05%. Если в примесях Zn, Cd, Ag, то они снижают электропроводность на 5%, а Ni, Sn или Al – на 25 – 40%. Еще более сильное влияние оказывают примеси Be, As, Fe, Si и P, которые снижают электропроводность на 55% и более. Поэтому медь очищают различными способами: до 99.97% электролитическим способом.
В вакуумных печах получают медь, содержащую 99.99% меди. Эта медь имеет электропроводность примерно равную электропроводности Ag. Из специальной меди изготавливают детали магнетронов, аноды мощных генераторных ламп, выводы энергии приборов СВЧ, некоторые типы волноводов и генераторов; ее используют для изготовления фольгированного гетинакса, в микроэлектронике в виде осажденных на подложке пленок, играющих роль проводящих соединений между функциональными элементами схемы.
Алюминий почти в 3.5 раза легче меди. Марка А97 (0.03% примесей) используется для изготовления алюминиевой фольги и электродов. А999 (0.001% примесей). Оксидная пленка предохраняет алюминий от коррозии, но создает большое сопротивление в местах спайки, что затрудняет пайку обычными методами. Из оксидированного алюминия изготавливают различные катушки без дополнительной изоляции, но при большой толщине Al2O3 уменьшается гибкость, и увеличивается гигроскопичность.
(3) Тугоплавкие металлы
Температура плавления более 1700°С. Основными тугоплавкими металлами являются металлы, стоящие в середине периода, у которых наряду с металлическими связями есть еще и ковалентные
|
 W
W
Cr
Mo
Один электрон участвует в металлической связи, т.е. делокализован, обобществлен всем кристаллом, а остальные d электроны принимают участие в ковалентной связи. Ковалентная связь прочна. Кристаллическая решетка имеет высокую энергию связи, и требуются высокие температуры, чтобы эту связь разрушить. Для этих металлов характерна высокая твердость, но в то же время они обладают низкой пластичностью. К металлам с высокой температурой плавления относятся W, Mo, Ta, Nb, Cr, V, Ti, Re, Zr; температура плавления [1700;3500]°C. W самый тугоплавкий. Имеет высокую механическую прочность. Используется в качестве нитей в лампах, электронных лампах, в рентгеновских трубках, используется при глубоком вакууме. Недостатки: трудная обрабатываемость и образование оксидных пленок.
(4) Благородные металлы
Не взаимодействуют (почти) с окружающей средой в связи со своей химической стойкостью
Au 99.998%
Ag 99.9999%
Pt 99.9998%
Pd 99.94%
Au – является контактным материалом для коррозионно стойких покрытий
Ag с высокой проводимостью используется в качестве высоких контактов в качестве электродов, производстве конденсаторов
Pt – для изготовления термопар, чувствительных приборов
Pd – заменитель платины (дешевле в 4-5 раз)
(5) Металлы со средним значением температуры плавления.
Fe, Ni, Co
(6) Металлы с невысокими температурами плавления.
Стоят они в нижней части периодической системы: имеют большой радиус, и, как правило, у них нет свободных (не спаренных) d-электронов, и для них характерна металлическая связь. Pb, Sn, Ga, In, Hg. Hg применяется в качестве жидких катодов.
Сплавы
Одним из важнейших свойств металлов является образование сплавов. Расплавленные металлы растворяются друг в друге, образуя при отвердевании твердые смеси – сплавы. Металлическим сплавом называется фаза или комплекс фаз, образующихся при сплавлении металлов при условии сохранения металлических свойств: электро- и теплопроводность. В металлических сплавах сохраняются связи, т.е. и наличие свободных электронов. Если образуются ковалентные связи, то образуются интерметаллические неорганические соединения.
Все металлы по величине диаметра атомов делятся на:
1) при диаметре 2.2-3Å металлы образуют между собой непрерывные твердые растворы. (Mn, Fe, Ni)
2) при диаметре >3Å – не смешиваются с металлами середины длинных периодов. (K, Ca, Si)
3) при диаметре <2Å (не металлы) – образуют ограниченные твердые растворы или фазы внедрения. (Ti, V, Cr)
3-х компонентные системы представляют собой треугольник Гиббса, вершины которого – чистые вещества А, В, С. Соответствующие свойства – в области, перпендикулярной к треугольнику.
Существуют 3-7 компонентные сплавы
Сплавы высокой проводимости.
1) Бронзы – сплавы на основе Cu. Помимо чистой Cu применяют сплавы, содержащие небольшое количество олова (Sn), кремния (Si), фосфора (P), бериллия (Be), хрома (Cr), магния (Mg), кадмия (Cd). При этом ρ увеличивается, зато сплавы обладают более высокими механическими свойствами. Предел при растяжении = 8350 Па. Особенно удачен Cd. При малом уменьшении σ, приводит к значительному увеличению прочности. Еще больше прочности у бериллиевой бронзы.
Латуни – повышенное значение относительного удлинения при увеличении предела прочности. Это обеспечивает технологические преимущества (изготовление токопровдящих деталей).
2) Сплавы алюминия.
Альдрей – содержит 0.3-0.5% Mg, 0.4-0.7% Si, 0.2-0.3% Fe; сохраняет лёгкость алюминия, близок ему по сопротивлению, приближен по механической прочности к твердотянутой меди.
Сплавы для электровакуумных приборов.
На основе металлов со средней температурой плавления (Fe,Ni) созданы сплавы, которые широко применяются в электровакуумных технологиях, т.к. они обладают αL – коэффициент линейного температурного расширения, позволяют получать сокращенные металлические конструкции и спаи со стеклом.
Инвар (Н36) – сплав Fe и 36% Ni
αL = 1*10-6 К-1 при Т = (-100)-100°С.
Ковар – Fe + 29% Ni + 17% Сo
αL = 4.8*10-6 К-1
ρ = 0.5 ρ инвара.
Инвар и ковар применяют для герметизации изделий путём сварки со стеклом, для изготовления конденсаторов с переменной ёмкостью.
Платинид (Н47) – Fe и 47% Ni
αL≈ αL Pt и стекол.
Используется как вводы в стеклянные баллоны
Припои – сплавы для пайки.
Температура плавления припоя < температуры плавления соединения.
На границе металл – припой: припой смачивает металл, растекается и заполняет зазоры, при этом компоненты припоя диффундируют в основной металл, следовательно образуется промежуточная прослойка. Припои делят на мягкие и твердые: мягкие - температура плавления < 300°С, твердые - температура плавления > 300°С. Механическая прочность мягких припоев 16-100 МПа, у твердых 100-500 МПа. Мягкие припои – оловянно-свинцовые, твердые – Cu, Zn, Ag с добавлением вспомогательных материалов.
Вспомогательные материалы (флюсы):
1) растворять и удалять оксиды из спаиваемых металлов.
2) защищать в процессе пайки поверхность от окисления.
3) уменьшать поверхностные натяжения
4) уменьшать растекаемость и смачиваемость припоя
По оказываемому действию:
1) активные (кислотные: HCl, ZnCl2, хлористые и фтористые металлы) – интенсивно растворяют оксидную пленку, но после пайки вызывают коррозию, следовательно, нужна тщательная промывка. При монтажной пайке применение активных флюсов запрещено.
2) Бескислотные флюсы – канифоль и флюсы на ее основе с добавлением спирта и глицерина.
3) Активированные – канифоль + активаторы (солянокислый диметиламин) – пайка без предварительного удаления оксидов после обезжиривания.
4) Антикоррозийные флюсы на основе H2PO3 с добавлением контактол
Контактолы:
1) Ag, Ni, Pd, в порошкообразном виде используют в качестве проводящей фазы в пасте.
2) Высокомолекулярные вещества. Применяются для получения контактов между металлами, металлами и полупроводниками, создания электродов, экранирования от помех…
Керметы
Металлоэлектрические композиции с неорганическими связующими для резисторов, волноводных нагрузок с повышенным значением ρ.
Сплавы высокого сопротивления
Для электроизмерительных приборов, образцовых резисторов, реостатов, электронагревательных приборов.
Среди большого количества сплавов наиболее распространены сплавы на медной основе: манганин и константан. Хромоникелевые и железо-хромо-алюминивые сплавы.
Манганин: Mg – 12%, Ni – 2%, Cu – 86%
Константан: Cu – 60%
max ρ и min αρ ≈ 0 или < 0. При нагреве образуется пленка оксида – оксидная изоляция. Константан в паре с Fe или Cu дает термо-ЭДС.
Хромоникелевые сплавы – изготовление нагревательных элементов, резисторов.
Fe-Cr-Ni (фехроль, хромель) – дешевые сплавы для мощных нагревательных устройств. Недостаток – хрупкость и твердость.
Резистивные сплавы: РС 37-10 – Cr 37%, Fe 10%, Ni 53%. РС 37-01 - Cr 37%, Fe 1%, Ni 69%.
Сплавы для термопар:
1) капель – 56% Cu, 44% Ni
2) олимель – 95% Ni, 5% Al, Si, Mg
3) хромель – 90% Ni, 10% Cr
4) платинородий – 90% Pt, 10% Rd
Наибольшую термо-ЭДС имеют 1) и 2).
Глава 2
Не металлические материалы (полупроводники, диэлектрики и т.д.)
П/п соединения.
Химическая связь в п/п соединениях.
Специальной связи в п/п соединениях нет. Химические связи в п/п разнообразны, исключается только металлическая связь. Преимущественно связь ковалентная.
(1) Классификация полупроводниковых соединений.
1) По типу образователя: оксиды, сульфиды, арсениды, фосфиды и т.д.
2) По типу кристаллической решетки: алмазоподобные …
3) По положению в периодической системе.
|
 АIII BV
АIII BV
АII BVI
АI BVII
А2III B3VI
АI BIIIC2VI
А2IBVIIICIVDVI
И т.д.
(2) П/п соединения А III BV
| АIII | BV | |
| B | N | диэлектрик |
| Al | P |
полупроводник |
| Ga | As | |
| In | Sb | |
| Te | Bi | металл |
С увеличением (ZA+ZB)/2 наблюдается закономерное измение ΔЕ и температуры плавления (из увеличения радиуса атома следует уменьшение прочности ковалентной связи).
| соединение | энергия к.р. | температура плавления | ΔЕ, эВ | подвижность носителей тока, u | |
| е | р | ||||
| AlP | 190 | 2000 | 2.42 | – | – |
| GaP | 170 | 1467 | 2.25 | 300 | 150 |
| InP | 150 | 1055 | 1.28 | 6000 | 650 |
| AlAs | 170 | 1700 | 2.16 | – | – |
| GaAs | 146 | 1237 | 1.4 | – | – |
| InAs | 130 | 943 | 0.46 | – | – |
| AlSb | 160 | 1070 | 1.6 | – | – |
| GaSb | 133 | 712 | 0.79 | – | – |
| InSb | 121 | 536 | 0.18 | – | – |
| Si | 204 | 1421 | 1.21 | – | – |
| Ge | 178 | 937 | 0.78 | – | – |
АIII BV
Алмазоподобные п/п, изоэлектронные ряды, имеют тетраэдрическую структуру. 3 ковалентные связи + 1 донорно-акцепторная.
| IV | АIII BV | АII BVI | АI BVII |
| Ge | GaAs | ZnSe | CuBr |
| ковалентная неполярная | 3 ковалентные + 1 д-а | 2 ковалентные + 2 д-а | 1 ковалентная + 3 д-а |
| χ | |||
Элементы удаляются друг от друга, следовательно, растет доля ионности связи и ширина запрещенной зоны, и уменьшается подвижность носителей тока.
| Соединение | Ge | GaAs | ZnSe | CuBr |
| ΔЕ, эВ | 0.78 | 1.53 | 2.6 | 2.94 |
(3)
Алмазоподобную структуру имеет большая группа соединений, состоящая из трех.
АIBIIIC2VI (CuZnS2, CuAlS2)
АIIBIVC2 (CdGeAs2, ZnGeAs2)
4 – и более элементов.
Стеклообразные п/п.
Селениды, теллуриды, сульфиды элементов V группы образуют аморфные (стеклообразные п/п)
Sb23+Te32-; As23+S32-; As23+Se32-; As25+Se52-;
Для аморфного состояния характерен только ближний порядок, поэтому зонная теория к ним не применима (она выведена только для кристаллического состояния), и свойства таких п/п можно объяснить с точки зрения валентной связи. Их проводимость мало зависит от примесей. Она зависит от размеров атомов, образующих соединения. С уменьшением радиуса атома п/п свойства переходят в диэлектрические.
Органические п/п
В основном органические соединения – диэлектрики (см. ниже). Однако есть большая группа органических п/п. Её особенностью является наличие сопряженных связей:
σ π σ π σ π
= С – С = С – С = С – С = С
σ σ σ
т.е. есть электроны коллективного пользования, значит вся молекула обладает свойствами металла и представляет собой одномерный кристалл, а к нему применима зонная теория. Дискретные уровни p-электронов представляют собой валентную зону. Энергия активации электронов есть запрещенная зона. Проводимость внутри молекулы очень велика поскольку p-электроны обладают высокой подвижностью и небольшой энергией возбуждения.
Жидкий бензол является диэлектриком, т.к. электронам трудно преодолеть энергетический барьер, связанный с межмолекулярными взаимодействиями.
 Если соединить молекулы бензола так как показано на рисунке, то энергетический барьер уменьшится.
Если соединить молекулы бензола так как показано на рисунке, то энергетический барьер уменьшится.
Диэлектрики
это вещества, которые обладают следующими:
1) Большое удельное сопротивление
ρ = 1010 - 1020 [Ом/см]
2) E – электрическая прочность или пробивное напряжение [В/см]
3) Диэлектрическая проницаемость ε. В одних случаях она мала: 1, 2, 3… в других случаях (для конденсаторов) 40, 80 и более.
4) Тангенс угла диэлектрической потери (tgδ)
Диэлектрическими свойствами обладают вещества, которые имеют либо ковалентную решетку, при очень маленьких радиусах атома (C (алмаз)), либо ионную решетку с большой долей ионности и с малыми дефектами кристаллической решетки.
Молекулярные кристаллические решетки
Поскольку молекулярные кристаллические решетки в обычных условиях для неорганических соединений не существует, то речь идет только об органических веществах.
Органические диэлектрики
Практически все органические вещества являются диэлектриками. За исключением рассмотренных соединений с сопряженными связями, но диэлектрические свойства органических соединений выражены неодинаково, и зависит это от состава и строения этих соединений.
Различают высоко- и низкочастотные диэлектрики.
μ = g*l – дипольный момент
 |
l
если μ = 0 (l = 0), то молекула неполярна, поэтому всё равно как ей располагаться в электрическом поле, и при измени полярности она ведет себя индифферентно. Такой диэлектрик называется высокочастотным. Если μ > 0, появляется диполь,и когда полярность быстро меняется, молекула не успевает ориентироваться, а если между молекулами прочная связь и ориентирование происходит в “вязкой” среде, происходит разогрев и пробой диэлектрика

высокочастотный низкочастотный
Если в молекуле отсутствуют сильно электроотрицательные атомы, такие как O, F, Cl, то связи будут малополярны и молекула в целом тоже будет малополярна, значит диэлектрик может считаться высокочастотным. В молекуле могут быть очень электроотрицательные элементы, но они должны быть симметрично расположены, и, несмотря на большую полярность связи, в результате их симметричного расположения в целом молекулы будут неполярны и тоже могут использоваться в токах высокой частоты. Если же имеющиеся полярные связи не симметричны, то в молекуле наличествует дипольный момент. Такие соединения не могут быть использованы в качестве диэлектриков высокой частоты.
Дипольный момент не всегда отрицательное качество. Его наличие упрочняет химические связи между макромолекулами => увеличивают температуру плавления и механическую прочность. Наличие полярных групп придает хорошие адгезионные свойства, а такие вещества могут быть использованы в составе клеящих копозиций.
Полимеры могут иметь
1)линейное
2)разветвленное
3)сетчатое
4)пространственное строение
1и2 обладют термопластичными (термообратимыми) свойствами, т.е. могут быть расплавлены, а затем, без изменения свойств. Закристаллизованы. 3и4 являются термореактивными, т.е. термонеобратимыми. При нагреве они теряют свои исходные свойства. (В кристаллическом и смолообразном состоянии) 100% кристалличности быть не может. Максимальная кристалличность = 80%. Чем больше степень кристалличности, тем выше температура плавления и ниже морозостойкость. Аморфные полимеры более морозостойки.
Полимеры образуются из мономеров (низкомолекулярные вещества) в результате двух видов реакций: полимеризации и поликонденсации.
(-А-)n – элементарный состав моно- и полимеров одинаков. В результате полимеризации нет побочных продуктов.
(-A-B-)n – сополимеризация
(-A-A-A-A-A-)n – привитая полимеризация
| | |
B B B
| | |
B B B
(-A-A-A-A-B-B-B-B-)n – блок полимеризация
Возникает за счет разрыва двойных или тройных связей и присоединения мономеров друг к другу.
na-A-a+nb-B-b→
Синтезируются за счет взаимодействия функциональных групп с выделением побочных низкомолекулярных соединений, что может абсорбироваться в объеме полимера и снижать его в частности диэлектрические свойства.
CH2=CH2 – этен
(-CH2-CH2-)n – полиэтилен.
1) полиэтилен высокого давления при Т = 200°С, Р = 1.5-3 *103 Атм.
2) низкого давления в присутствии катализаторов. Т = 100°С, Р = 30 Атм, катализаторы: соединения Al, Ti, Cl.
Степень кристалличности полиэтилена низкого давления 65-85% температура плавления = 125-135°С. У полиэтилена высокого давления Степень кристалличности < 60%, температура плавления = 115°С. Полиэтилен весьма устойчив к действию агрессивных сред. Но он стареет под действием ультрафиолетового излучения. При комнатной температуре под действием ультрафиолетового излучения он может храниться до трех лет, при температуре = 160°С уже через час. Катализирует разрушение влага. Ценные качества – диэлектричность. Широко применяется для изготовления выскочастотных кабелей. Этот материал может использоваться как в чистом виде, так и в совокупности с другими полимерами, в виде пленок, лаков, компаундов, обладающих высокой водо- и химической стойкостью. Подобными свойствами обладает полибутилен, полистирол. Он линеен и неполярен Полистирол термопластичен, не гигроскопичен и обладает устойчивостью к воде, кислотам и щелочам, но растворяется в ацетоне, эфире и некоторых других растворителях. Он является очень хорошим диэлектриком и широко применяется в высококачественной изоляции, в телевидении и средствах связи. Из него готовят конденсаторы, антенны, высокочастотные кабели. Используется как важный материал в приборостроении осбенно когда нужно высокое сопротивление деформации, на его основе изготавливают компаунды, лаки, пленки, поропласты… Недостаток – низкая теплостойкость и хрупкость, температура размягчения 80-85°С
Фторопласт 4.
(-CF2-CF2-)n
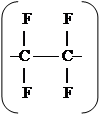 – фторопласт 4 (поли-тетра-фтор-этилен)
– фторопласт 4 (поли-тетра-фтор-этилен)
Имеет симметричное строение => несмотря на полярность связи, в целом молекула неполярна. Линейный, неполярный, термопластичный, обладает исключительно высокой химической стойкостью, в том числе на него не действуют растворители. Он разрушается под действием расплавленных щелочных металлов и фтора. Очень термостойкий, сохраняет свойства при (-190 – 300°С), плавится при 327°С, разрушается при 400°С с выделением токсичных отходов. Он является наилучшим диэлектриком, особенно в полях высоких и сверхвысоких частот. Его свойства не зависят от частоты. Применяется в агрессивных средах, при высокой влажности. Недостаток – холодная текучесть.
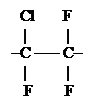 Фторопласт 3
Фторопласт 3 
Ассиметричное строение.
Вступление
Для создания электронных приборов необходим целый арсенал материалов и уникальных и тонких технологических процессов. Современная радиотехника и особенно высокочастотная техника (радиосвязь), приборы и аппаратура радиоэлектроники требуют большого количества конструкционных и специальных радиотехнических материалов, свойства которых должны удовлетворять самым разнообразным условиям их применения. Под радиотехническими материалами принято понимать материалы, которые обладают особыми свойствами по отношению к электрическому, магнитному и электромагнитному полям. Они разделяются на 4 группы:
1) проводники
2) диэлектрики
3) полупроводники
4) магнитные материалы
Требования, которым должны удовлетворять радиоматериалы:
1) обладать высокими электрическими (магнитными) характеристиками.
2) нормально работать при повышенных, а иногда при низких температурах.
3) иметь достаточную механическую прочность при различных видах нагрузки, устойчивостью к тряске, вибрации, ударам…
4) обладать достаточной влагостойкостью, химической стойкостью, стойкостью к облучениям.
5) не иметь заметно выраженного старения.
6) удовлетворять технологичности, т.е. сравнительно легко обрабатываться.
7) быть недорогими и не дефицитными.
Глава 1
Классификация и основные сведения о проводниковых материалах
Виды проводников
Проводниками электрического тока могут служить твёрдые тела, жидкости, а при соответствующих условиях и газы
Твёрдыми проводниками являются металлы, металлические сплавы и некоторые модификации углерода. За последнее время получены также органические полимеры. Среди металлических проводников различают:
а) материалы, обладающие высокой проводимостью, которые используют для изготовления проводов, кабелей, проводящих соединений в микросхемах, обмоток трансформаторов, волноводов, анодов мощных генераторных ламп и т.д.
б) металлы и сплавы, обладающие высоким сопротивлением, которые применяются в электронагревательных приборах, лампах накаливания, резисторах, реостатах.
К жидким проводникам относятся расплавленные металлы и различные электролиты. Как правило температура плавления металлов высока за исключением ртути (-39°C), галлия (29,8°C) и цезия (26°C). Механизм протекания тока обусловлен движением свободных электронов. Поэтому металлы называются проводниками первого рода. Электролитами или проводниками второго рода являются растворы солей, кислот и щелочей. Все газы и пары, в том числе пары металлов при низкой напряженности не являются проводниками. При высоких напряженностях может произойти ионизация газа, и ионизированный газ, при равенстве числа электронов и положительных ионов в единице объёма, представляет собой особую равновесную проводящую среду, которая называется плазмой.
Кристаллическая структура металлов
Металлы имеют кристаллическое строение, но есть и аморфные. В сплошном куске металла кристаллы его расположены случайным образом. Их очертания имеют неправильную форму, но путём медленного выращивания из расплавленного металла можно получить крупный кристалл, который называется монокристаллом.
Метод Чохральского: получение монокристалла и очистка металла.
Медленно вытягивают из расплава монокристалл, примеси остаются в расплаве. Монокристалл отличается мягкостью, но для его разрыва требуется большее усилие чем для разрыва металла.
Возможны 6 вариантов кристаллических решеток металлов:
1) простая кубическая Kr = 6.
2) объёмно центрированная кубическая Kr = 8; Li, Na, K, Rb, Cs, Fe.
3) кубическая гранецентрированная, Kr = 12; Cu, Ag, Au, Cr, Mo, W, Ca, Ni, Pt, Pd, Co, Ro, Ir, Rh, Fe.
4) октаэдрическая структура Kr = 6.
5) тетраэдрическая Ge, Pb, α-Sn
6) гексагональная Mg, Be, Cd, Ru, Os.
Решетки металлов, принадлежащих одной подгруппе периодической системы, обычно являются одинаковыми. Железо может кристаллизоваться в гранецентрированную и в объёмно центрированную.
Металлическая связь
Как особый вид связи осуществляется в жидком и твёрдом (кристаллическом) состояниях (имеется также и аморфное состояние металлов). В парообразном состоянии металлические атомы имеют ковалентную связь (т.е. общую электронную пару) и, следовательно, являются диэлектриками.
Элементарная решетка лития – кубическая объёмно центрированная, следовательно, надо осуществить связь по крайней мере в элементарной решетке Li9, а валентный электрон всего один и он должен находиться между всеми восемью «соседями», поэтому он должен быть делокализован. МВС (метод валентных связей) не описывает металлическую связь в кристаллах, она может быть описана только методом молекулярных орбиталей (ММО) т.е. зонной теорией твёрдого тела. Согласно зонной теории для всех металлов ширина запрещённой зоны = 0, например: Na…3s1, Mg…3s2, Al…3s23p1.
Na
|
Mg
Содержит 100 атомов, следовательно, 100 уровней, может быть 200 электронов, есть 200, следовательно, 3s зона (ВЗ) полностью заполнена, 3p – зона проводимости ЗП получается из 3p подуровней. В случае с Mg ЗП накладывается на ВЗ, и поэтому электрону не требуется большой энергии для перехода в эту зону (ΔE = 0);
Al
ВЗ полностью заполнена и ΔE = 0.
Дата: 2019-07-24, просмотров: 300.