Развитие хирургии до Х I Х века.
Хирургия - раздел клинической медицины , изучающий болезни и повреждения при диагностике и лечении которых используется методы и приемы нарушающие целостность покровных тканей организма
Развитие хирургии идет по спирали.
4 периода:
Эмпирический с 6-7 тысячелетия д н э и до конца 16 века
Анатомический – конец 16-начало 19
Период великих открытий конца 19 – начала 20
Физиологический период – 20 век
Эмпирический:
Древние люди – опий конопля мох листья
Индийцы : ринопластика
Гиппократ : гной, вывих плеча, наложение шин
Цельс – признаки воспаления, лигатура на сосуд
Гален: операция при заячьей губе
Авиценна
Анатомический:
Везалий Андреас – книги по пат анатомии
Паре – зажим, поворот плода на ножке, огнестрельные – разновидность ушибленных
Мальпиги – красные кровяные тельца
2. Развитие хирургии в Х I Х -ХХ веках. Открытия хирургического обезболивания, антисептики и асептики. Становление научной хирургии на основе фундаментальных открытий естественных наук.
Достижения:
1. Асептика антисептика
2. Возникновение обезболивания .
3.группы крови и возможности переливания.
Физиологический 20 век
История асептики
Эмпирический период
-удаление инородных тел из раны
-запрет на касание раны руками
-чистота рук врача , короткие ногти , брить волосы
Долистеровская 19 века
Земмельвейс возможность развития эндометрита с септическими осложнениями вследствие занесения трупного яда при обследовании, обработка хлорной известью
Пирогов антисептики
Луи Пастер
Антисептика листера
1865 год карболовая кислота распылял в операционной Обрабатывал руки и инструментов операционного пола многослойная пропитанная повязка
Асептика
Бергман шиммельбуш
Кох высокая температура
Эсмархт текущий пар
Автоклав 1884
Анестезиология
1800 деви - веселящий газ
1818 эфир , фарадей
1844 год первая операция под наркозом , дантист удалял зуб
16 октября 1846 года дата рождения анестезиологии , удалили опухоль подчелюстной области
В 1947 хлороформный наркоз
1922 этилен ацетилен
1956 фторотан, в 1959 метоксифлюран
Внутривенным наркозом :
1902 - гедонал
1960 оксибутират натрия
Эндотрахеальный наркоз
Макинтош - управляемое дыхание
Современное состояние хирургии. Роль и место хирургии в современной медицине.
По-прежнему лидирует, новые операции, новые инструменты, разделение на отрасли итд
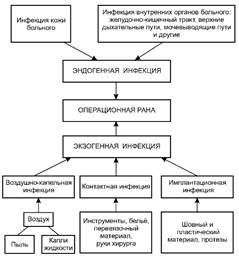
Асептика (определение). Источники и пути распространения хирургической инфекции.
Асептика - совокупность методов и приёмов работы, направлен- ных на предупреждение попадания инфекции в рану, в организм больного, создание безмикробных, стерильных условий для хирургической работы путём использования организационных мероприятий, активных обеззараживающих химических веществ, а также технических средств и физических факторов.
Следует особо подчеркнуть значение организационных мероприятий: именно они становятся определяющими. В современной асептике сохранили своё значение два основных её принципа:
• всё, что соприкасается с раной, должно быть стерильно;
• всех хирургических больных необходимо разделять на два потока: «чистые» и «гнойные».
Борьба с микрофлорой на путях, воздушного инфицирования.
При воздушно-капельном пути распространения инфекции микроорганизмы попадают в рану из окружающего воздуха, где они находятся на частицах пыли или в каплях выделений из верхних дыхательных путей либо раневого отделяемого.
Для профилактики воздушно-капельной инфекции применяют комплекс мер, главные из них - организационные мероприятия, связанные с особенностью работы хирургических отделений и стационара в целом.
Разделение потоков больных
Разделение «чистых» и «гнойных» больных - основной принцип асептики. Применение всех самых современных способов профилактики инфекции будет сведено на нет, если в одной палате чистый послеоперационный больной будет лежать рядом с гнойным!
В зависимости от мощности стационара существуют разные способы решения этой проблемы.
При наличии в больнице только одного хирургического отделения в нём специально выделяют палаты для гнойных больных, должно быть две перевязочные: чистая и гнойная, причём гнойная должна располагаться в том же отсеке, что и палаты для гнойных больных. Желательно также выделить палату для послеоперационных больных - в противоположной части отделения.
Если в больнице несколько хирургических отделений, их разделяют на чистые и гнойные. В масштабе крупных городов возможно даже разделение стационаров на чистые и гнойные. При этом при госпитализации больных врач скорой помощи знает, какие чистые и какие гнойные стационары по оказанию экстренной хирургической помощи сегодня дежурят, и в соответствии с характером заболевания решает, куда везти больного.
Обеззараживание
Непосредственно после использования инструменты погружают в ёмкость с дезинфицирующими средствами (накопитель). При этом они должны быть полностью погружены в раствор. В качестве дезинфицирующих средств используют 3% раствор хлорамина (экспозиция 40- 60 мин) или 6% раствор перекиси водорода (экспозиция 90 мин). После обеззараживания инструменты промывают проточной водой.
Мытьё
Инструменты погружают в специальный моющий (щелочной) раствор, в его состав входят моющее средство (стиральный порошок), пероксид водорода и вода. Температура раствора 50-60 ?С, экспозиция 20 мин. После замачивания инструменты моют щётками в том же растворе, а затем - в проточной воде.
Высушивание можно осуществлять естественным путём. В последнее время, особенно при последующей стерилизации горячим воздухом, инструменты сушат в сухожаровом шкафу при температуре 80 ?С в течение 30 мин. После высушивания инструменты готовы к стерилизации.
Собственно стерилизация
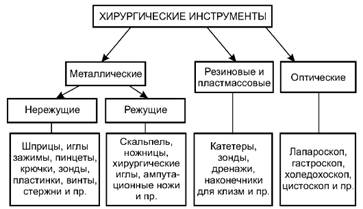
Выбор метода стерилизации в первую очередь зависит от вида хирургических инструментов.
Подготовка и обработка операционного поля.
Предварительно проводят санитарно-гигиеническую обработку (мытьё в ванне или под душем, смену постельного и нательного белья). В день операции сбривают волосяной покров в области операционного поля (сухое бритьё). На операционном столе операционное поле обрабатывают химическими антисептиками (органическими йодсодержащими препаратами, хлоргексидином, первомуром, АХД, стерильными клеящимися плёнками). При этом соблюдают следующие правила:
• широкая обработка;
• последовательность «от центра - к периферии»;
• загрязнённые участки обрабатывают в последнюю очередь;
• многократность обработки в ходе операции (правило Филончикова-Гроссиха): обработку кожи выполняют перед отграничением стерильным бельём, непосредственно перед разрезом, а также перед наложением кожных швов и после него.
16. Профилактика имплантационного инфицирования ран. Стерилизация шовного материала, протезов, конструкций.
Имплантация – внедрение, вживление в организм искусственных и чужеродных материалов и приспособлений с лечебной целью.
Строжайшая стерильность всех предметов для внедрения:
1) Шовный материал
2) Дренажи
3) Протезы клапанов, сосудов, скобки клипсы итд
Шовный материал:
Естественного происхождения – шелк, кетгут(рассасывается).
Искусственного – капрон, лавсан, дакрон, полиэстер, дексон,викрил (рассасывающиеся)
Атравматический – соединен с иглой, травматический – вдевается перед наложением шва
Способы стерилизации:
Лучевая в заводских условиях (атравматический шовный)
Метод кохера – шелк, кетгута это уже история
Сейчас: капрон, лавсан, скрепки – кипячение / автоклавирование
Протезы:
Автоклав, сухожаровой шкаф, кипячение – металлические конструкции для остеосинтеза
Сосудистые из лавсана – кипячение
В газовом стерилизаторе / в антисептике – сложные протезы, состоящие не только из металла
Имплантаты – обмываются в растворе и хранятся в стерильном контейнере
Разделение потоков больных
Разделение «чистых» и «гнойных» больных - основной принцип асептики. Применение всех самых современных способов профилактики инфекции будет сведено на нет, если в одной палате чистый послеоперационный больной будет лежать рядом с гнойным!
В зависимости от мощности стационара существуют разные способы решения этой проблемы.
При наличии в больнице только одного хирургического отделения в нём специально выделяют палаты для гнойных больных, должно быть две перевязочные: чистая и гнойная, причём гнойная должна располагаться в том же отсеке, что и палаты для гнойных больных. Желательно также выделить палату для послеоперационных больных - в противоположной части отделения.
Если в больнице несколько хирургических отделений, их разделяют на чистые и гнойные. В масштабе крупных городов возможно даже разделение стационаров на чистые и гнойные. При этом при госпитализации больных врач скорой помощи знает, какие чистые и какие гнойные стационары по оказанию экстренной хирургической помощи сегодня дежурят, и в соответствии с характером заболевания решает, куда везти больного.
Физическая антисептика.
Уничтожение с помощью физических методов
1) Гигроскопический перевязочный материал (вата,марля) – увеличивает оббьем экксудата, действует 8 часов, поэтому надо укладывать рыхло
Метод Микулича :салфетка в ране с длинной нитью, вся полость внутри заполнена шариками
2) Сорбенты – угли вводятся в рану
3) Гипертонические растворы 10%NaCL, усиливают отток
4) Дренирование
Пассивное – сигарообразный дренаж, полоска перчаточной резины, полихлорвиниловые трубки
Активное – создается отрицательное давление
Проточно-промывное – не меньше двух дренажей, по одному вводят раствор по другому вытекает
5) Факторы внешней среды – высушивание при ожогах
6) Технические средства
УЗ
Лазер
Рентгенотерапия
Выявление противопоказаний
Недооценка противопоказаний для назначения антибиотиков может привести к тяжёлым осложнениям. Большинство осложнений удаётся предупредить, если учитывать анамнестические сведения о неперено- симости тех или иных антибиотиков в прошлом, наличии аллергических реакций в прошлом или в настоящее время, перенесённых или имеющихся заболеваниях почек и печени, поражениях слухового аппарата и т.д. Заболевания почек, сопровождающиеся почечной недостаточностью (нефрит, пиелонефрит, нефроз), являются противопоказанием для назначения аминогликозидов, заболевания крови (анемия) - для хлорамфеникола; при заболеваниях органа слуха, особенно неврите слухо- вого нерва, противопоказаны аминогликозиды, полимиксины, препараты группы стрептомицина. По строгим показаниям следует назначать антибиотики при беременности из-за их токсического действия на развивающийся плод. При назначении антибиотиков следует учитывать основные аллергические и токсические реакции на антибактериальные препараты. Анамнестические сведения о повышенной чувствительности к антибиотикам, различные заболевания аллергической природы (бронхиальная астма, крапивница) должны служить показанием к проведению специальных проб на переносимость больным антибиотиков.
Консервированная кровь
Готовят с применением одного из консервирующих растворов. Роль стабилизатора при этом играет цитрат натрия, который связывает ионы кальция и предупреждает свёртывание крови, роль консерванта - декстроза, сахароза и др. В состав консервирующих растворов входят антибиотики. Консерванты добавляют в соотношении с кровью 1:4. Хранят кровь при температуре 4-6 ?С. Кровь, консервированная раствором глюгицир, хранится 21 день, раствором циглюфад - 35 дней. В консервированной крови менее устойчивы к хранению факторы гемостаза и иммунные факторы, функция связывания кислорода сохраняется в течение длительного периода. Поэтому с целью остановки кровотечения переливают кровь со сроком хранения не более 2-3 сут, с целью иммунокоррекции - не более 5-7 сут. При острой кровопотере, острой гипоксии целесообразно использовать кровь небольших (3-5 дней) сроков хранения.
Свежецитратная кровь
В качестве стабилизирующего раствора используют 6% раствор цитрата натрия в соотношении с кровью 1:10. Такую кровь используют непосредственно после заготовки или в ближайшие часы.
Гепаринизированная кровь
Гепаринизированную кровь применяют для заполнения аппаратов искусственного кровообращения. В качестве стабилизатора и консерванта используют гепарин натрия с декстрозой и хлорамфениколом. Гепаринизированную кровь хранят при температуре 4 ?С. Срок хранения - 1 сут.
Компоненты крови
В современных условиях в основном используют компоненты (отдельные составные части) крови. Трансфузии цельной крови проводят всё реже из-за возможных посттрансфузионных реакций и осложнений, обусловленных большим количеством антигенных факторов, имеющихся в цельной крови. Кроме того, лечебный эффект компонентных трансфузий выше, так как при этом осуществляется целенаправленное воздействие на организм. Существуют определённые показания к компонентной трансфузии: при анемии, кровопотере, кровотечении показаны трансфузии эритроцитарной массы; при лейкопении, агранулоцитозе, иммунодефицитом состоянии - лейкоцитарной массы; при тромбоцитопении - тромбоцитарной массы; при гиподиспротеинемии, нарушениях свёртывающей системы, дефиците ОЦК - плазмы крови, альбумина, протеина.
Компонентная гемотрансфузионная терапия позволяет получить хороший лечебный эффект при меньшем расходовании крови, что имеет большую экономическую значимость.
Эритроцитарная масса
Эритроцитарную массу получают из цельной крови, из которой удалено 60-65% плазмы путём отстаивания или центрифугирования. Она отличается от донорской крови меньшим объёмом плазмы и высокой концентрацией эритроцитов (гематокритное число 0,65-0,80). Выпускают во флаконах или пластиковых мешках. Хранят при температуре 4-6 ?С.
Эритроцитарная взвесь
Эритроцитарная взвесь представляет собой смесь эритроцитарной массы и консервирующего раствора в соотношении 1:1. Стабилизатор - цитрат натрия. Хранят при температуре 4-6 ?С. Срок хранения - 8-15 дней.
Показаниями к переливанию эритроцитарной массы и взвеси служат кровотечение, острая кровопотеря, шок, заболевания системы крови, анемии.
Замороженные эритроциты
Замороженные эритроциты получают путём удаления из крови лейкоцитов, тромбоцитов и белков плазмы, для чего кровь подвергают 3- 5-кратному отмыванию специальными растворами и центрифугирова- нию. Замораживание эритроцитов может быть медленным - в электрохолодильниках при температуре от -70 до -80 ?С, а также быстрым - с использованием жидкого азота (температура -196 ?С). Замороженные эритроциты хранят в течение 8-10 лет. Для размораживания эритроцитов контейнер опускают в водяную баню температуры 45 ?С и затем отмывают от ограждающего раствора. После размораживания эритроциты хранят при температуре 4 С не более 1 сут.
Преимущество размороженных эритроцитов - отсутствие или низкое содержание сенсибилизирующих факторов (белков плазмы, лейкоцитов, тромбоцитов), факторов свёртывания, свободного гемоглобина, калия, серотонина. Это определяет показания к их трансфузии: аллергические заболевания, посттрансфузионные реакции, сенсибилизация больного, сердечная, почечная недостаточность, тромбоз, эмболия. Можно использовать кровь универсального донора и избежать синдрома массивной гемотрансфузии. Отмытые нативные или размороженные эритроциты переливают больным при наличии несовместимости по лейкоцитарным антигенам системы HLA или сенсибилизированным к плазменным белкам.
Тромбоцитарная масса
Тромбоцитарную массу получают из плазмы консервированной донорской крови, хранившейся не более 1 сут, путём лёгкого центрифугирования. Хранят её при температуре 4 ?С в течение 6-8 ч, при темпе-
ратуре 22 ?С - 72 ч. Целесообразно использовать свежезаготовленную массу. Продолжительность жизни перелитых тромбоцитов - 7-9 дней.
Показаниями к трансфузии тромбоцитарной массы служат тромбоцитопении различного происхождения (заболевания системы крови, лучевая терапия, химиотерапия), а также тромбоцитопении с геморрагическими проявлениями при массивных гемотрансфузиях, проводимых по поводу острой кровопотери. При трансфузии тромбоцитарной массы следует учитывать групповую (по системе АВ0) совместимость, совместимость по Rh-фактору, проводить биологическую пробу, так как при получении тромбоцитарной массы возможна примесь эритроцитов донорской крови.
Лейкоцитарная масса
Лейкоцитарная масса представляет собой среду с высоким содержанием лейкоцитов и примесью эритроцитов, тромбоцитов и плазмы.
Получают препарат путём отстаивания и центрифугирования. Хранят во флаконах или пластиковых мешках при температуре 4-6 ?С не более 24 ч, целесообразнее переливать свежезаготовленную лейкоци- тарную массу. При переливании следует учитывать групповую и резус- принадлежность донора и реципиента, а в необходимых случаях - совместимость по антигенам HLA. Проведение биологической пробы на совместимость является обязательным. Трансфузии лейкоцитарной массы показаны при заболеваниях, сопровождающихся лейкопенией, при агранулоцитозе, угнетении кроветворения, обусловленном лучевой и химиотерапией, при сепсисе. Возможны реакции и осложнения в виде одышки, озноба, повышения температуры тела, тахикардии, падения АД.
Плазма крови
Плазму крови жидкую (нативную) получают из цельной крови путём либо отстаивания, либо центрифугирования. Плазма содержит белки, большое количество биологически активных компонентов (ферменты, витамины, гормоны, антитела). Используют её сразу после получения (не позднее чем через 2-3 ч). При необходимости более длительного хранения применяют замораживание или высушивание (лиофилизацию) плазмы. Выпускают во флаконах или пластиковых мешках по 50-250 мл. Замороженную плазму хранят при температуре -25 ?С в течение 90 дней, при температуре -10 ?С - в течение 30 дней. Перед применением её оттаивают при температуре 37-38 ?С. Признаки непригодности плазмы для переливания: появление в ней массивных сгустков, хлопьев, изменение цвета на тусклый серовато-бурый, неприятный запах.
Плазму применяют с целью возмещения плазмопотери при дефиците ОЦК, шоке, для остановки кровотечения, комплексного парентерального питания. Показаниями к трансфузии служат кровопотеря (если она превышает 25% ОЦК), сочетают трансфузии плазмы, цельной крови, эритроцитарной массы), шок (травматический, операционный), ожоговая болезнь, гемофилия, тяжёлые гнойно-воспалительные заболевания, перитонит, сепсис. Противопоказания для трансфузии плазмы - тяжёлые аллергические заболевания.
Обычные дозы переливаемой плазмы - 100, 250 и 500 мл, при лечении шока - 500-1000 мл. Переливание осуществляют с учётом групповой (AB0) совместимости донора и реципиента. Необходимо проведение биологической пробы.
Сухая плазма
Сухую плазму получают из замороженной в условиях вакуума. Выпускают во флаконах вместимостью 100, 250, 500 мл. Срок хранения препарата 5 лет. Перед употреблением разводят дистиллированной водой или изотоническим раствором хлорида натрия. Показания к применению те же, что и для нативной или замороженной плазмы, за исключением того, что использование сухой плазмы с гемостатической целью неэффективно. Проводят биологическую пробу.
Препараты крови Альбумин
Альбумин получают путём фракционирования плазмы. Применяют в растворах, содержащих 5, 10, 20 г белка (альбумина 97%) в 100 мл раствора. Выпускают в виде 5%, 10%, 20% растворов во флаконах вмести- мостью 50, 100, 250, 500 мл. После разлива во флаконы их пастеризуют на водяной бане при 60 ?С в течение 10 ч (во избежание опасности передачи сывороточного гепатита). Препарат обладает выраженными онкотическими свойствами, способностью удерживать воду и тем самым увеличивать ОЦК, оказывать противошоковое действие.
Альбумин назначают при различных видах шока, ожогах, гипопротеинемии и гипоальбуминемииу больных с опухолевыми заболеваниями, тяжёлых и длительных гнойно-воспалительных процессах, проведении плазмафереза. В сочетании с трансфузией крови и эритроцитарной массы альбумин оказывает выраженный терапевтический эффект при кровопотере, постгеморрагической анемии. Трансфузии препарата показаны при гипоальбуминемии - содержании альбумина менее 25 г/л. Доза:
20% раствор - 100-200 мл; 10% - 200-300 мл; 5% - 300-500 мл и более. Вводят препарат капельно со скоростью 40-60 капель в минуту, при шоке - струйно. Показано проведение биологической пробы.
Относительные противопоказания для трансфузии альбумина - тяжело протекающие аллергические заболевания.
Протеин
Протеин является 4,3-4,8% изотоническим раствором стабильных пастеризованных белков человеческой плазмы. В его состав входят альбумин (75-80%) и стабильные α- и β-глобулины (20-25%). Общее количество белка составляет 40-50 г/л. По терапевтическим свойствам протеин близок к плазме. Выпускается во флаконах по 250-500 мл. Показания к применению протеина те же, что и для плазмы. Ежедневная доза препарата у больных гипопротеинемией - 250-500 мл раствора. Препарат вводят в течение нескольких дней. При тяжёлом шоке, массивной кровопотере доза может быть увеличена до 1500-2000 мл. Протеин применяют обязательно в сочетании с донорской кровью или эритроцитарной массой. Вводят капельно, при тяжёлом шоке или низком АД - струйно.
Криопреципитат
Криопреципитат готовят из плазмы крови, выпускают во флаконах по 15 мл. Препарат содержит антигемофильный глобулин (VIII фактор), фибринстабилизирующий фактор (XII фактор), фибриноген. Примене- ние препарата показано для остановки и профилактики кровотечений у больных, страдающих нарушениями свёртывающей системы крови, обусловленными дефицитом VIII фактора (гемофилией А, болезнью фон Виллебранда).
Протромбиновый комплекс
Протромбиновый комплекс готовят из плазмы крови. Препарат отличается высоким содержанием II, VII, К, X факторов свёртывающей системы крови. Применяют для остановки и профилактики кровотече- ний у больных, страдающих гемофилией В, гипопротромбинемией, ги- попроконвертинемией.
Фибриноген
Фибриноген получают из плазмы, содержащей в концентрированном виде фибриноген. Применяют с лечебной и профилактической це-
лью у больных с врождённой и приобретённой гипо- и афибриногенемией, а также при профузных кровотечениях, для профилактики кровотечений в послеоперационном периоде, во время и после родов.
Тромбин
Тромбин готовят из плазмы, в его состав входят тромбин, тромбопластин, хлорид кальция. Выпускается в порошке во флаконах. Применяют местно для остановки капиллярного, паренхиматозного кровотечения при обширных ранах, операциях на паренхиматозных органах.
Реинфузия крови
Ранее других стал известен метод реинфузии крови, или обратного переливания крови, излившейся в серозные полости - брюшную или плевральную - вследствие травматического повреждения, заболеваний внутренних органов или операции. Реинфузию крови применяют при нарушенной внематочной беременности, разрыве селезёнки, печени, сосудов брыжейки, внутригрудных сосудов, лёгкого. Противопоказаниями для реинфузии служат повреждения полых органов груди (крупных бронхов, пищевода), полых органов брюшной полости - (желудка, кишечника, жёлчного пузыря, внепечёночных жёлчных путей), мочевого пузыря, а также наличие злокачественных новообразований. Не рекомендуют переливать кровь, находившуюся в брюшной полости более 24 ч.
Для консервации крови пользуются специальным раствором в соотношении с кровью 1:4 или раствором гепарина натрия - 10 мг в 50 мл изотонического раствора хлорида натрия на флакон вместимостью 500 мл. Кровь берут металлическим черпаком или большой ложкой путём вычерпывания и сразу же фильтруют через 8 слоёв марли или с помощью отсоса с разрежением не менее 0,2 атм. Метод сбора крови с помощью аспирации наиболее перспективен. Кровь, собранную во флаконы со стабилизатором, подвергают фильтрованию через 8 слоёв марли. Вливают кровь через систему для переливания с использованием стандартных фильтров.
Реинфузия весьма эффективна при восполнении кровопотери во время операции, когда собирают и вливают больному кровь, излившуюся в операционную рану. Кровь собирают с помощью вакуумирования во флаконы со стабилизатором с последующей фильтрацией через 8 сло- ёв марли и переливанием через систему со стандартным микрофильтром. Противопоказаниями для реинфузии крови, излившейся в рану, служат загрязнение крови гноем, кишечным, желудочным содержимым, кровотечения при разрывах матки, злокачественные новообразования.
Производные декстрана
В зависимости от молекулярной массы выделяют:
• среднемолекулярные растворы (декстран [ср. мол.масса 50 000- 70 000]);
• низкомолекулярные растворы (декстран [мол.масса 30 000- 40 000], декстран [ср. мол. масса 30 000-50 000] + маннитол + натрия хлорид, декстран [мол. масса 30 000-40 000]).
Основной среднемолекулярный препарат декстрана - декстран [ср. мол.масса 50 000-70 000], низкомолекулярный - декстран [мол.
масса 30 000-40 000].
Декстран [ср. мол.масса 50 000-70 000] - 6% раствор среднемоле- кулярной фракции декстрана (молекулярная масса 60 000-80 000) в изотоническом растворе натрия хлорида. При внутривенном введении он быстро увеличивает ОЦК, повышает и стойко поддерживает АД. Декстран [ср. мол.масса 50 000-70 000] увеличивает объём циркулирующей жидкости в кровеносном русле на величину, превышающую объём введённого препарата, что обусловлено его высоким коллоид- но-осмотическим давлением. В организме циркулирует от 3 до 7 сут, в первые сутки выводится 45-55% препарата, преимущественный путь выведения - через почки. Введение декстрана [ср. мол. масса 50 000-70 000] усиливает окислительно-восстановительные процессы в организме и утилизацию тканями кислорода из притекающей крови. Струйное введение препарата повышает тонус сосудов.
Декстран [ср. мол.масса 50 000-70 000] показан при лечении травматического, операционного или ожогового шока, острой кровопотери, острой циркуляторной недостаточности при различных забо- леваниях. Побочные реакции при введении декстрана [ср. мол.масса 50 000-70 000] чрезвычайно редки. Однако у некоторых лиц (менее 0,001%) наблюдают индивидуальную повышенную чувствительность к препарату, проявляющуюся в развитии симптомов анафилаксии вплоть до анафилактического шока. Для предупреждения этой реакции при использовании декстрана [ср. мол.масса 50 000-70 000] необходимо проводить биологическую пробу.
Декстран [мол.масса 30 000-40 000] - 10% раствор низкомолекулярного декстрана (молекулярная масса 20 000-40 000) в изотоническом растворе хлорида натрия или 5% растворе глюкозы. Так же, как и декстран [ср. мол.масса 50 000-70 000], является гиперонкотическим коллоидным раствором, при внутривенном введении значительно увеличивает ОЦК. Каждый грамм препарата связывает в кровяном русле 20-25 мл воды. Этим обусловлено его гемодинамическое
действие. Декстран [мол.масса 30 000-40 000] циркулирует в организме 2-3 сут, 70% препарата выводится за первые сутки с мочой.
Основной эффект действия декстрана [мол.масса 30 000-40 000], в отличие от декстрана [ср. мол.масса 50 000-70 000], - улучшение реологических свойств крови и микроциркуляции. Это обусловлено спо- собностью препарата вызывать дезагрегацию эритроцитов, купировать стаз крови и предупреждать тромбообразование. Возникшая в крови высокая концентрация препарата способствует поступлению жидкости из тканей в кровеносное русло, что приводит к гемодилюции и снижению вязкости крови. Молекулы декстрана покрывают поверхность клеточных элементов крови, изменяют электрохимические свойства эритроцитов и тромбоцитов. Антитромботическое действие декстрана [мол.масса 30 000-40 000], вероятно, обусловлено увеличением отрицательного заряда тромбоцитов и снижением их способности к адгезии и агрегации. Показаниями к применению декстрана [мол.масса 30 000-40 000] считают нарушения микроциркуляции при шоке различного происхождения, тромбоэмболические осложнения, операции на открытом сердце, сосудистые заболевания, хирургические вмешательства на сосудах, посттрансфузионные осложнения.
Реакции и осложнения при использовании декстрана [мол.масса 30 000-40 000] такие же, как при применении декстрана [ср. мол.масса 50 000-70 000]. Перед введением также необходимо проводить био- логическую пробу.
Препараты желатина
Родоначальник группы и наиболее распространённый препарат - желатин.
Желатин - 8% раствор частично расщеплённого пищевого желатина в изотоническом растворе хлорида натрия (молекулярная масса 15 000-25 000). Желатин - белок, содержащий аминокислоты: глицин, пролин и др. Лечебное действие в основном связано с его высоким коллоидно-осмотическим давлением, обеспечивающим быстрое поступление тканевой жидкости в сосудистое русло. Как гемодинамические препараты желатин и его аналоги менее эффективны, чем декстраны. Они быстрее покидают сосудистое русло и распределяются во внеклеточном пространстве. Желатин нетоксичен, апирогенен, антигенные реакции нехарактерны. Основная часть препарата выводится почками.
Показания для применения: острая гиповолемия, различные виды шока и интоксикации. Препарат противопоказан при острых забо- леваниях почек и жировой эмболии.
Из-за возможных аллергических реакций при применении желатина обязательно проведение биологической пробы.
Кристаллоидные растворы
Кристаллоидные растворы имеют низкую молекулярную массу и быстро проникают через стенку капилляров в межклеточное пространство, восстанавливая дефицит жидкости в интерстиции. Они довольно быстро покидают сосудистое русло. В связи с этим целесообразно сочетанное применение кристаллоидных и коллоидных растворов.
Кристаллоиды наряду с гемодинамическими коллоидными кровезаменителями включают в комплексную терапию травматического и геморрагического шока, гнойно-септических заболеваний, а также применяют для профилактики и коррекции нарушений водно-солевого баланса и кислотно-щелочного равновесия крови при больших операциях и в послеоперационном периоде. При этом не только восполняется дефицит внеклеточной жидкости, происходят компенсация метаболического ацидоза и детоксикация, но и возникает некоторый гемодинамический эффект, заключающийся в частичной коррекции гиповолемии и стабилизации АД.
Все кристаллоидные растворы можно разделить на две группы:
1. Растворы, соответствующие по электролитному составу, рН и осмолярности плазме крови, - так называемые базисные кристаллоидные растворы. Основные препараты - раствор Рингера, раствор Рингера-Локка, лактосол.
• Раствор Рингера:
- хлорид натрия - 8,0 г;
- хлорид калия - 0,075 г;
- хлорид кальция - 0,1 г;
- гидрокарбонат натрия - 0,1 г;
- дистиллированная вода - до 1 л.
• Раствор Рингера-Локка:
- хлорид натрия - 9,0 г;
- гидрокарбонат натрия - 0,2 г;
- хлорид кальция - 0,2 г;
- хлорид калия - 0,2 г;
- глюкоза - 1,0 г;
- бидистиллированная вода - до 1 л.
• Лактасол:
- хлорид натрия - 6,2 г;
- хлорид калия - 0,3 г;
- хлорид кальция - 0,16 г;
- хлорид магния - 0,1 г;
- лактат натрия - 3,36 г;
- гидрокарбонат натрия - 0,3 г;
- дистиллированная вода - до 1 л.
В клинической практике указанные растворы применяют для коррекции изотонических гидроионных нарушений, так как они содержат наиболее оптимальный набор ионов.
2. Растворы, отличающиеся по электролитному составу, рН и осмолярности от плазмы крови, - так называемые корригирующие растворы, предназначенные для коррекции нарушений гидроионного и кислотно-щелочного баланса.
К этой группе препаратов относят физиологический (изотонический) раствор хлорида натрия (0,9% раствор), ацесоль, хлосоль, дисоль, трисоль, раствор гидрокарбоната натрия, 4-5% раствор гидрокарбоната натрия (соды) (применяют для коррекции метаболического ацидоза).
Осмотические диуретики
К осмотическим диуретикам относят многоатомные спирты - маннит и сорбит.
Маннитол - 15% раствор маннита в изотоническом растворе хло- рида натрия.
Сорбитол - 20% раствор сорбита в изотоническом растворе хло- рида натрия.
Механизм диуретического действия этих препаратов связан с повышением осмолярности плазмы и притоком интерстициальной жидкости в кровеносное русло, что способствует увеличению ОЦК и возрастанию почечного кровотока.
В результате увеличения почечной фильтрации возрастает экскреция натрия, хлора и воды, при этом подавляется их реабсорбция в
канальцах почек. Препараты вводят внутривенно капельно или струйно из расчёта 1-2 г/кг массы тела в сут.
Показания для применения осмотических диуретиков: ранняя стадия острой почечной недостаточности, гемолитический шок, сердечная недостаточность, отёк мозга, парез кишечника (стимулируют перистальтику), заболевания печени и желчевыводящих путей и др. Противопоказания к их назначению: нарушение процесса фильтрации в почках, сердечная недостаточность с резко выраженной анасаркой и другими состояниями экстрацеллюлярной гипергидратации, внутричерепные гематомы.
Белковые препараты
Среди белковых препаратов выделяют гидролизаты белков и смеси аминокислот.
Источниками получения белковых гидролизатов служат казеин, белки крови крупного рогатого скота, мышечные белки, а также эрит- роциты и сгустки донорской крови. При получении белковых гидролизатов исходное сырьё подвергают ферментативному или кислотному гидролизу. Наибольшее применение нашли гидролизат казеина, гидролизин, аминокровин, амикин, аминопептид, фибриносол, аминозол, аминон, амиген и др.
Белковые гидролизаты вводят внутривенно капельно со скоростью 10-30 капель в мин. Объём вводимых гидролизатов может дос- тигать 1,5-2,0 л в сут. Противопоказания к применению белковых гидролизатов: острые нарушения гемодинамики (шок, массивная кровопотеря), декомпенсация сердечной деятельности, кровоизлияние в головной мозг, почечная и печёночная недостаточность, тромбоэмболические осложнения. Белковые гидролизаты можно вводить через зонд в желудок (зондовое питание).
Отдельную группу составляют растворы аминокислот, они легко усваиваются организмом, так как нет необходимости расщеплять пептиды. Преимущества смесей кристаллических аминокислот: более простая технология получения, высокая концентрация аминокислот, возможность создания препаратов с любым соотношением аминокислот и добавлением в смесь электролитов, витаминов и энергетических соединений. Основные препараты: полиамин, инфузамин, вамин, мориамин, фреамин, альвезин, аминоплазмаль и др. Аминокислотные смеси вводят внутривенно со скоростью 20-30 капель в мин при полном парентеральном питании в дозе 800-1200 мл ежедневно. Возможно их введение через зонд в желудок.
При переливании любых белковых препаратов необходимо выполнять биологическую пробу.
Жировые эмульсии
Включение жировых эмульсий в комплекс парентерального питания улучшает энергетический обмен организма больного, ока- зывает выраженное азотсберегающее действие, корригирует липидный состав плазмы и структуру мембран клеток. Жиры обеспечивают организм незаменимыми жирными кислотами (линоленовой, линолевой, арахидоновой), жирорастворимыми витаминами (А, К, D), фосфолипидами. В клинической практике применяют жировые эмульсии (эмульгированные жиры не вызывают жировой эмболии). Наибольшее распространение получили интралипид, липифизиан, инфузолипол, липофундин, липомул, инфонутрол, фатген и др.
Препараты жировых эмульсий вводят внутривенно со скоростью 10-20 капель в мин или через зонд в желудок.
Применение жировых эмульсий противопоказано при шоке, черепно-мозговой травме, нарушении функций печени, резко выражен- ном атеросклерозе. Перед выполнением инфузии проводят биологическую пробу.
Углеводы
Углеводы используют в парентеральном питании для обеспечения энергетических потребностей, а также как энергетическую добавку к гидролизатам белков. Вводимые в организм углеводы способствуют расщеплению гидролизатов белков и построению из аминокислот собственных белков.
Наибольшее распространение получили растворы глюкозы (5%, 10%, 20% и 40%). Противопоказание к её применению - сахарный диабет.
Из других углеводов используют фруктозу и углеводные спирты (ксилит, сорбит, маннит). Усвоение этих препаратов прямо не связано с действием инсулина и возможно у пациентов с сахарным диабетом.
40. Показания, противопоказания и методы инфузионной терапии. Принципы инфузионной терапии, контроль за ее проведением.
Оценка состояния больного позволяет выявить необходимость трансфузии гемодинамических кровезамещающих жидкостей, которые показаны при различных видах шока, острой кровопотери, при нарушении микроциркуляции связанной с тромбофлебитом и тромбоэмболией. При гнойной интоксикации, травматическом токсикозе проводят трансфузию кровезаменителей без интоксикационного действия. При полной или частичной гипопротеинемии назначают препараты для парентерального питания. При обезвоживании, нарушении электролитного баланса, кислотно-основного состояния показано переливание переливание электролитных растворов гидрокарбоната натрия, трисамина.
Регистрация переливания.
По окончании переливания необходимо ввести соответствующую запись в истории болезни и журнал регистрации переливаний кровезамещающих жидкостей, отметив вид и количество введенных препаратов, наличие реакции.
Гемотрансфузионные реакции.
Гемотрансфузионные реакции развиваются остро, их частота представлена в табл. 18-2. Отсроченные реакции (например, гепатит) в данном разделе на рассматриваются.
Таблица 18-2
Гемотрансфузионные реакции
| Реакция | Частота возникновения | Причина |
| Лихорадка | 1:50-1:100 | Антитела к лейкоцитам донора |
| Крапивница | 1:100 | Сенсибилизация к белкам плазмы донора |
| Острое повреждение легких | 1:5000 | Лейкоагглютинины в донорской крови |
| Острый гемолиз | 1:6000 | АВО-антитела к эритроцитам донора |
| Гемолиз с летальным исходом | 1:100000 | АВО-антитела к эритроцитам донора |
Аллергические реакции
Аллергические реакции встречаются у 1-3% реципиентов, и их развитие связано с сенсибилизацией организма к белкам плазмы доноров при предыдущих гемотрансфузиях [З]. Пациенты с дефицитом иммуноглобулина А предрасположены к аллергическим реакциям разной степени тяжести даже без введения препаратов плазмы или её белков в анамнезе.
Клиническая картина. Наиболее типичные признаки аллергических реакций — крапивница и зуд, нарастающие в процессе переливания крови. Не исключена лихорадка. Более выраженные проявления анафилаксии (например, острая гипотензия, нарушения функции органов дыхания) наблюдаются редко, но они вполне возможны.
Лечение. При слабовыраженных аллергических реакциях и отсутствии лихорадки гемотрансфузию можно продолжить. Обычно переливание крови прекращают при неэффективности антигистаминных средств. Иногда зуд можно купировать внутримышечным введением 25-50 мг димедрола. Препарат можно использовать и с профилактической целью перед трансфузией у больных с повышенной чувствительностью. Анафилактические реакции устраняют с помощью интенсивной инфузионной терапии (предпочтение отдают коллоидным растворам) и адреналина (0,1 мл в разведении 1:1000 внутривенно или 0,3-0,5 мл подкожно), что уже обсуждалось в главе 15.
Рекомендации. По возможности следует избегать гемотрансфузий больным с аллергией. Если все же она необходима, то следует использовать отмытые эритроциты. Для высоко-сенсибилизированных пациентов можно специально приготовить деглицеролизированную эритроцитную массу. Все введения препаратов крови должны быть разрешены трансфузиологом, и их следует проводить под его постоянным контролем. Всех больных с проявлениями анафилаксии в анамнезе обследуют на предмет дефицита иммуноглобулина А.
Острое повреждение легких
Острая дыхательная недостаточность (ОДН) является довольно редким осложнением переливания крови — 1:5000 проведённых гемотрансфузий [14]. ОДН можно наблюдать даже после однократного переливания как цельной крови, так и эритроцитной массы [14]. Сегодня патогенез ОДН связывают со способностью антилейкоцитарных антител донорской крови взаимодействовать с циркулирующими гранулоцитами реципиента. Сформировавшиеся лейкоцитарные комплексы поступают в лёгкие, где высвобождающийся клетками ряд токсических продуктов повреждает капиллярную стенку, в результате чего изменяется её проницаемость и развивается отёк лёгких; при этом сложившаяся картина напоминает респираторный дистресс-синдром взрослых (РДСВ). Тем не менее ОДН — не РДСВ (хотя ОДН при нём имеет место), поскольку первая практически всегда благополучно разрешается, а РДСВ сопровождается весьма высокой летальностью. В настоящее время природа ОДН до конца не изучена.
Клиническая картина. Признаки дыхательной недостаточности, как правило, развиваются в течение 1-2 ч с момента трансфузии. Обычно бывает лихорадка, отмечаются случаи острой гипотензии [14]. Рентгенограмма грудной клетки выявляет отёк лёгких, но давление в лёгочных капиллярах при этом сохраняется в пределах нормы. Хотя состояние у больных с ОДН может быть тяжелым, сам лёгочный процесс обычно разрешается в течение 4-5 дней, не нанося существенного повреждения лёгочной ткани.
Лечение. При первых признаках ОДН трансфузию следует прекратить (если она еще продолжается). Основные лечебные мероприятия направлены на коррекцию дыхательных расстройств (см. главу 23). Специфической терапии для данного вида дыхательной недостаточности нет.
Рекомендации относительно гемотрансфузий в будущем неоднозначны. Одни авторы рекомендуют в дальнейшем использовать только отмытые эритроциты (с целью отделения плазмы), другие предостерегают от каких-либо трансфузий вообще, исключая жизненно необходимые [14].
Несовместимая кровь
В основном перекрестную пробу делают для определения вероятности развития острых гемолитических трансфузионных реакций. Эта процедура включает инкубацию форменных элементов крови донора с плазмой реципиента и может занимать 45 мин и более [15].
Универсальный донор
В случаях экстренного переливания традиционно используют резус-отрицательную кровь группы 0 — кровь универсального донора. Эритроциты этой группы лишены АВО и Rh-антигенов на мембранной поверхности, поэтому возникновение большинства гемолитических трансфузионных реакций (плазма реципиента против форменных элементов донора) попросту невозможно. Однако донорская сыворотка имеет анти-А и анти-В антитела, которые будут вызывать незначительную гемотрансфузионную реакцию (донорская сыворотка против форменных элементов крови реципиента) при введении больным с группами крови А, В и АВ. Подобные реакции обычно проходят без осложнении, которые, однако, могут быть и тяжелыми при попадании в кровь реципиента достаточно большого количества антител. Действительно, после массивной гемотрансфузии резус-отрицательной крови группы 0 реципиент будет иметь в достаточном количестве анти-А и анти-В антитела, которые при взаимодействии с его кровью могут вызвать выраженную гемолитическую реакцию (её не будет, если у реципиента группа крови 0). Поэтому и в экстренных ситуациях необходимо переливание только одногруппной резус-совместимой крови.
Основы клинической хирургии
Общие проявления
Клиническими признаками общей реакции организма на воспаление являются повышение температуры тела, озноб, возбуждение или, наоборот, вялость больного, в крайне тяжёлых случаях затемнение (а иногда и потеря) сознания, головная боль, общее недомогание, разбитость, учаще- ние пульса, выраженные изменения состава крови, признаки нарушения функций печени, почек, снижение АД, застой в малом круге кровообращения. Перечисленные симптомы могут носить ярко выраженный характер или быть малозаметными (в зависимости от характера, распространён- ности, локализации воспаления и особенностей реакции организма).
Температура тела при хирургической инфекции может достигать 40 ?C и выше, возникают повторные озноб и головная боль, резко уменьшаются уровень гемоглобина и число эритроцитов, увеличивается содержание лейкоцитов, в тяжёлых случаях до 25,0-30,0х109/л. В плазме крови увеличивается уровень глобулинов и уменьшается количество альбуминов, у больных пропадает аппетит, нарушаются функции кишечника, появляется задержка стула, в моче определяются белок и цилиндры. Развивающаяся интоксикация приводит к нарушению функций органов кроветворения, в результате чего наступают анемизация больного и значительные изменения в составе белой крови: появляются незрелые форменные элементы, отмечается сдвиг лейкоцитарной формулы влево (уменьшение числа сегментоядерных и увеличение - палочкоядерных форм нейтрофилов). Для воспалительных процессов характерно резкое увеличение скорости оседания эритроцитов (появляясь в начале процесса, оно обычно наблюдается ещё долго после ликвидации воспаления). Иногда увеличиваются селезёнка, печень, появляется желтушная окраска склер.
При сильно выраженной (гиперергической) общей реакции организма на хирургическую инфекцию все перечисленные изменения проявляются в резкой степени; если реакция средняя или слабая, они бывают умеренными и даже малозаметными. Тем не менее любой местный воспалительный про- цесс сопровождается общими проявлениями, которые при гнойной инфек-
ции имеют клиническую картину, весьма сходную с таковой при сепсисе и некоторых инфекционных заболеваниях (тифе, бруцеллёзе, паратифе, ту- беркулёзе и др.). Поэтому такие больные нуждаются в тщательном клиническом обследовании, одна из важных целей которого - выявление первич- ного гнойного очага, входных ворот для гноеродных микроорганизмов. При выраженной общей реакции у больных с местным воспалительным процессом необходимо не только помнить о возможности инфекционного заболевания, но и повторными посевами крови установить наличие или отсутствие бактериемии. Обнаружение бактерий в крови, особенно при отсутствии клинического улучшения после хирургического воздействия на первичный очаг инфекции, свидетельствует о наличии сепсиса, а не просто об общей реакции на местный гнойный процесс.
Основным отличием общей реакции организма на гнойный процесс от сепсиса является то, что в первом случае все симптомы её резко ослабевают или исчезают при вскрытии гнойного очага и создании условий для хорошего дренирования; при сепсисе симптомы после этого почти не изменяются. Определение степени выраженности общей реакции на местную гнойную инфекцию имеет большое значение для правильной оценки состояния больного, характера развития воспаления и прогноза возможных осложнений.
Клинические признаки эндогенной интоксикации зависят от степени её тяжести: чем выраженнее интоксикация, тем значительнее её проявления. При лёгкой степени интоксикации отмечается бледность кожного покрова, при тяжёлой - кожа землистого оттенка, определяются акроцианоз, гиперемия лица. Соответственно пульс частый - до 100- 110 в минуту, в тяжёлых случаях - более 130 в минуту, снижается АД. Развивается одышка - число дыханий до 25-30 в минуту, при тяжёлой интоксикации - более 30 в минуту. Важный показатель интоксикации - нарушение функций ЦНС: от лёгкой эйфории вначале до заторможён- ности или психического возбуждения при развитии токсемии, при тя- жёлой интоксикации развивается интоксикационный делирий. Большое значение в оценке тяжести интоксикации имеет определение диуреза: при тяжёлой интоксикации количество мочи снижается, в крайне тяжёлых случаях развивается острая почечная недостаточность с выраженной олигурией и даже анурией.
Диагностика
Из лабораторных тестов, характеризующих интоксикацию, большое значение имеет увеличение в крови уровня мочевины, некротических тел,
полипептидов, ЦИК, протеолитической активности сыворотки крови. Тяжёлая интоксикация проявляется также нарастающей анемией, сдвигом влево лейкоцитарной формулы, появлением токсической зернистости форменных элементов крови, развитием гипо- и диспротеинемии.
Для уточнения диагноза гнойно-воспалительных заболеваний используют специальные методы исследования - пункцию, рентгенологические, эндоскопические методы, лабораторные клинические и биохи- мические исследования крови, мочи, экссудата.
Микробиологические исследования позволяют не только определить вид возбудителя, его патогенные свойства, но и выявить чувствительность микроорганизмов к антибактериальным препаратам. Важную роль в комплексном обследовании при гнойно-воспалительных заболеваниях играет определение иммунологического статуса больного для проведения целенаправленной, избирательной иммунотерапии.
Своевременное и полноценное хирургическое лечение травм и острых хирургических заболеваний в комбинации с рациональной антибиотикотерапией не только способствовало уменьшению числа больных с гнойной инфекцией, но и значительно изменило классическое течение гнойных заболеваний.
В настоящее время, когда антибиотикотерапия широко применяется до поступления больного в стационар, иногда даже без назначения врача, хирургам нередко приходится наблюдать у поступивших больных запущенный гнойный процесс (например, гнойный аппендицит, эмпиема жёлчного пузыря, перитонит, гнойный плеврит, мастит, флегмона и т.д.) при отсутствии высокой температуры тела, с невысоким лейкоцитозом, малоизменённой СОЭ, слабовыраженными явлениями интоксикации и др. Отмеченные изменения известных клинических проявлений гнойного процесса, особенно при скрытом расположении очага в брюшной, грудной полости, могут существенно затруднить диагноз. Только комплексное обследование больных с гнойно-воспалительными заболеваниями позволяет установить диагноз болезни, определить характер и распространённость воспалительного процесса.
Консервативное лечение
В начальном периоде воспаления лечебные мероприятия направлены на борьбу с микрофлорой (антибактериальная терапия) и использование средств воздействия на воспалительный процесс, чтобы добиться его обратного развития или ограничения. В этот период используют консервативные средства - антибиотики, антисептические, противовоспалительные и противо- отёчные средства (энзимотерапию), физиотерапию, тепловые процедуры (грелки, компрессы), УФ-облучение, ультравысокочастотную терапию (УВЧтерапия), электрофорез лекарственных веществ, лазеротерапию и др. Обязательное условие - создание покоя для больного органа: иммобилизация конечности, ограничение активных движений, постельный режим.
В начальный период воспалительной инфильтрации тканей применяют прокаиновые блокады - циркулярные (футлярные) блокады конечностей, ретромаммарные блокады и др. С целью дезинтоксикации используют инфузионную терапию, переливания кровезамещающих жидкостей и др.
Если воспалительный процесс перешёл в гнойную фазу с формированием абсцесса без значительных воспалительных изменений окружающих тканей, то удаление гноя и промывание полости гнойника можно обеспечить консервативными средствами - пункцией абсцесса, промыванием полости антисептическими растворами, дренированием через пункционный канал. Консервативный метод лечения с использованием лечебных пункций и дренирования применяют также при скоплении гноя в естественных полостях тела: при гнойном плеврите, гнойных артритах, перикардите.
Хирургическая операция
Переход воспалительного процесса в гнойную фазу, неэффективность консервативного лечения считают показанием к хирургическому лечению.
Опасность перехода локализованного гнойного воспаления в общую гнойную инфекцию (сепсис) определяет неотложность хирургической операции. Признаками тяжёлого или прогрессирующего течения воспаления и неэффективности консервативной терапии служат высокая температура, нарастающая интоксикация, местно в области воспаления - гнойный или некротический распад, нарастающий отёк тканей, боли, присоединившийся лимфангиит, лимфаденит, тромбофлебит.
Хирургическое лечение (см. главу 8) больных с гнойно-воспалительными заболеваниями является основным методом терапии. Принцип « Ubi pus ibi evacua», предложенный Гиппократом, не утратил своего значения и в настоящее время. Вопросы предоперационной подготовки, обезболивания изложены в соответствующих главах. Хирургический доступ (операционный разрез) должен быть кратчайшим и достаточно широким, чтобы обеспечивать удаление гноя и некротизированных тканей, и располагаться в нижней части полости - для хорошего оттока отделяемого в послеоперационном периоде. В ряде случаев вскрывают гнойник по игле - предварительно пунктируют гнойник, а получив гной, иглу не удаляют и рассекают ткани по её ходу. Для более полного удаления некротизированных тканей после их иссечения применяют лазерный луч или УЗ-кавитацию. Полость гнойника тщательно промывают антисептическими растворами. Операцию заканчивают дренированием раны (см. Физическая антисептика в главе 2) для активной аспирации в послеоперационном периоде гнойного содержимого и промывания полостей антисептическими растворами. Если подведённый через разрез дренаж не обеспечивает достаточной эвакуации гноя, вводят трубки через небольшие дополнительные разрезы (контрапертуры).
Лечение гнойных ран, образовавшихся в послеоперационном периоде, проводят по общим правилам (см. Раны в главе 10).
Фурункул
Фурункул (furunculus) - острое гнойно-некротическое воспаление волосяного фолликула, сальной железы и окружающей подкожной жировой клетчатки. Наиболее частой локализацией фурункулов являются задняя поверхность шеи, предплечья, тыльная сторона кисти, лицо, бедро. Появление двух и более фурункулов свидетельствует о фурункулёзе. В возникновении фурункулов играют роль микротравмы, например рас- чёсы кожи при заболеваниях, сопровождающихся зудом.
Этиология и патогенез
Наиболее частым возбудителем фурункулёза является золотистый стафилококк, реже - другие гноеродные микробы. Предрасполагающи- ми к развитию фурункула моментами являются ослабление организма, нарушение обмена веществ (чаще сахарный диабет), авитаминоз, кожные заболевания. Развитие фурункула начинается с образования гнойной пустулы: после распространения микрофлоры из волосяного мешочка в сосочковый слой кожи возникает воспалительный инфильтрат. В центре инфильтрата образуется очаг некроза (некротический стержень), вокруг него скапливается гной. После отторжения гноя и некротического стержня дефект кожи заполняется грануляциями с последующим образованием соединительной ткани.
Больные в начале заболевания жалуются на появление гнойничка (пустулы) или болезненного уплотнения в толще кожи. С нарастанием воспаления присоединяются жалобы на общее недомогание, повышение температуры тела, боль в области увеличивающегося уплотнения. Наиболее выраженную болезненность отмечают при локализации фурункула на участках кожи, плотно прилежащих к подлежащим тканям:
на волосистой части головы, затылке, наружном слуховом проходе, тыльной стороне пальцев.
Лечение
Лечение фурункула консервативное. Больных следует предупредить о возможных серьёзных осложнениях при выдавливании фурункула, срезании пустулы бритвой, применении согревающих компрессов. В начале заболевания обрабатывают кожу 70% раствором этанола, 2% салициловым спиртом, проводят УВЧ-терапию. После вскрытия фурункула делают повязки с протеолитическими ферментами, гипертоническим раствором хлорида натрия, применяют УФ-облучение. После отхождения стержня накладывают мазевые повязки с эмульсией хлорамфеникола, мазью диоксометилтетрагидропиримидина. При осложнении фурункула лимфангиитом и лимфаденитом показана антибиотикотерапия.
Больные с фурункулом лица подлежат срочной госпитализации в хирургическое отделение, где проводят местное и общее лечение, включающее антибиотикотерапию. Больным назначают постельный режим, протёртую пищу.
При абсцедировании фурункула прибегают к хирургическому лечению - вскрытию абсцесса.
При рецидивирующих одиночных фурункулах и фурункулёзе необходимо специальное обследование больных, позволяющее выявить нарушения обмена веществ (сахарный диабет, авитаминоз). С целью повышения устойчивости организма к стафилококковой инфекции проводят иммунизацию стафилококковым анатоксином.
Карбункул
Карбункул (carbunculus) - острое разлитое гнойно-некротическое воспаление нескольких волосяных мешочков и сальных желёз, сопровождающееся образованием общего инфильтрата и некрозом кожи и подкожной клетчатки вследствие тромбоза сосудов.
Этиология и патогенез
Наиболее частый возбудитель карбункула - золотистый стафилококк, реже - стрептококк, иногда - смешанная инфекция (стафилококк и стрептококк). Предрасполагающими к развитию карбункула моментами являются ослабление общей резистентности организма при отягчающих заболеваниях, гипо- и авитаминозах, болезнях обмена веществ (сахарном диабете).
Основная локализация карбункула - задняя поверхность шеи, затылок, верхняя и нижняя губа, спина, поясница.
Заболевание начинается с появления инфильтрата, охватывающего несколько волосяных фолликулов и сальных желёз. Возникает расстройство кровообращения, обусловленное местным тромбозом сосудов, с образованием некроза кожи, подкожной клетчатки, иногда и глубжеле- жащих тканей. Наряду с некрозом происходит гнойное расплавление тканей с выделением гноя через устья волосяных фолликулов. После отторжения образуется гнойная рана с глубоким дефектом тканей, заживление которой происходит вторичным натяжением.
Лечение
Лечение карбункула в начальной стадии консервативное. Оно включает полный покой для поражённого органа. При карбункулах лица больным необходим постельный режим. Им запрещают разговаривать, назначают жидкую пищу. После обработки карбункула 70% раствором этанола накладывают асептическую повязку, назначают УВЧ-терапию. Парентерально вводят антибиотики, перорально - сульфаниламидные препараты длительного действия. При карбункулах у больных, страдающих сахарным диабетом, необходимы коррекция нарушений обмена веществ, тщательное проведение инсулинотерапии, что уменьшает развитие воспалительного инфильтрата и некроза.
Безуспешность консервативной терапии в течение 2-3 дней, нарастание некроза, гнойной интоксикации являются показанием для операции, которую выполняют под наркозом. Крестообразным разрезом рассекают инфильтрат до фасции и иссекают некротизированные ткани на всём протяжении, отделяя их от фасции, кожи, вскрывают гнойные затёки (рис. 99). Кровотечение при этом незначительное (сосуды в области воспалительного инфильтрата тромбированы), оно прекраща ется при введении в рану тампонов с гипертоническим раствором натрия хлорида или протеолитическими ферментами. На лице карбункул вскрывают линейным разрезом после его абсцедирования. В послеоперационном периоде лечение карбункула проводят по принципу лечения гнойных ран, для окончательного удаления некротических тканей применяют протеолитические ферменты.
При своевременно начатом лечении карбункула прогноз благоприятный, но у истощённых больных с тяжёлой формой сахарного диабета, а также при карбункуле лица не исключена возможность плохого исхода.
Этиология и патогенез
Гидраденит вызывает в основном золотистый стафилококк, проникающий через выводной проток потовой железы. Предрасполагающими моментами к развитию заболевания служат несоблюдение личной гигиены, повышенная потливость, загрязнения кожи, заболевания кожи (дерматит, экзема).
В потовой железе развивается воспалительная инфильтрация тканей с последующим гнойным расплавлением.
Лечение
Для лечения гидраденита используют антибиотики, сульфаниламиды длительного действия. Проводят иммунизацию стафилококковым анатоксином. В подмышечной впадине сбривают волосы, кожу проти- рают спиртом, смазывают 3% раствором бриллиантового зелёного. Применяют физиотерапию - токи УВЧ, УФ-облучение.
При абсцедировании гидраденита прибегают к хирургическому лечению, вскрытию абсцесса, удалению гноя. При длительном безуспеш-
ном лечении гидраденита и угрозе развития сепсиса иссекают всю жировую клетчатку в подмышечной впадине, как при карбункуле.
Рожа
Рожа (erysipelas) - прогрессирующее острое воспаление собственно кожи, реже - слизистых оболочек.
Этиология и патогенез
Рожа вызывается различными формами стрептококка, относится к контагиозным заболеваниям. В доантисептический период это было одно из основных осложнений ран в госпиталях. Рожа может приводить к внутрибольничным заболеваниям значительного контингента раненых и больных.
Микрофлора проникает в кожу из внешней среды, лимфогенный и, особенно, гематогенный путь инфицирования крайне редок.
В месте внедрения патогенного стрептококка развивается очаг серозного воспаления, локализованный в сетчатом слое кожи. В экссудате определяются нейтрофильные лейкоциты, стаз в кровеносных, лим- фатических капиллярах. Отмеченные воспалительные изменения распространяются по ширине, захватывая всё новые участки кожи. Подобные изменения характерны для эритематозной формы рожи.
По мере развития процесса происходят десквамация эпидермиса, его отслойка воспалительным экссудатом с образованием пузырей (буллёз- ная форма рожи). Содержимым пузырей является прозрачный желтоватый экссудат, иногда отмечается скопление гноя, редко экссудат в пу- зырях бывает геморрагического характера.
Прогрессирование воспалительного процесса в коже с гнойной инфильтрацией тканей приводит к образованию флегмоны подкожной клетчатки (флегмонозная форма рожи).
Развитие воспалительного процесса в коже может привести к расстройству кровообращения, тромбозу сосудов с образованием некрозов кожи (некротическая форма рожи).
В патогенезе рожи важное значение имеет аллергический фактор. Рожа склонна к рецидивам, в основе которых также лежит сенсибилизация организма. Рецидивы воспаления приводят к склерозу подкожной клетчатки и расстройствам лимфообращения с образованием вначале лимфостаза, а затем слоновости (см. Недостаточность лимфообращения в главе 13).
Рожа может развиваться как результат первичного инфицирования из экзо- и эндогенного источников. Но возможно развитие рожи как проявление вторичного процесса - как следствие осложнений различных гнойно-воспалительных заболеваний (фурункула, карбункула, ос- теомиелита и др.).
Отдельные формы рожи, диагностированные на основании клинических признаков, по существу являются фазами развития процес- са, течение которого может быть приостановлено на той или иной стадии.
Лечение
Лечение проводят в стационаре. Значительных успехов в лечении рожи удалось достичь после того, как начали использовать УФ-лучи и, особенно, комплексную терапию с применением антибактериальных средств
(сульфаниламидных препаратов, антибиотиков). При УФ-облучении обычно назначают эритемные или субэритемные дозы. При эритематозной или буллёзной формах рожи облучение дозируют с учётом локализа- ции процесса: на конечности - 4-5 биодоз, на лице - 3 биодозы. Если облучение начато с первых дней заболевания, обычно уже после одногодвух сеансов температура тела снижается, краснота уменьшается, самочувствие больного улучшается, т.е. процесс прекращается. При флегмонозной форме рожи облучение проводят осторожно, так как оно может привести к усилению отёка и тромбозу мелких сосудов кожи. При гангренозной форме рожи облучение противопоказано.
Одновременно с облучением назначают антибиотики и сульфаниламидные препараты. Из антибиотиков чаще используют пенициллины, полусинтетические пенициллины (до исчезновения красноты и норма- лизации температуры тела). Эффективно в этих случаях одновременное применение сульфаниламидов продлённого действия. Чем раньше начато лечение, тем быстрее наступает выздоровление. В тяжёлых случаях рожи конечностей используют эндолимфатическое введение антибиотиков.
Влажные повязки, компрессы, ванны абсолютно противопоказаны. При буллёзной форме пузыри после обработки спиртом вскрывают, на участок поражения накладывают повязку с эмульсией хлорамфеникола, стрептоцидной суспензией, тетрациклиновой мазью и др. При флегмонозной и гангренозной формах, помимо описанного лечения, производят вскрытие скоплений гноя, дренирование, удаление некротизированных тканей.
Большое значение имеют тщательный уход, высококалорийная молочно-растительная диета с большим содержанием витаминов. Необходимо строжайшее соблюдение асептики, больного лучше изолировать в отдельную палату.
Профилактика рожи сводится к лечению микротравм, тщательному соблюдению правил асептики в хирургических стационарах, выполнению противоэпидемических мероприятий
Эризипелоид
Эризипелоид (erysipeloides), или свиная краснуха, рожа свиней, эритема ползучая, - инфекционное заболевание, выражающееся в воспалении всех слоёв кожи.
Этиология и патогенез
Возбудитель заболевания - палочка свиной рожи, проникает через микротравматические повреждения кожи при разделке инфицирован-
ного мяса животных. Инкубационный период длится 3-7 дней. Наиболее часто поражаются люди, непосредственно связанные с обработкой мяса, рыбы, дичи, т.е. рабочие мясной, рыбной, консервной и кожевен- ной промышленности, домашние хозяйки и др. Заболевание не относится к числу редких, но часто просматривается или диагностируется как «рожа пальца», «дерматит», «панариций», «лимфангиит». В коже развивается серозное воспаление всех слоёв с присоединением лимфангиита и отёка тканей со скоплением в зоне воспаления тучных клеток.
Клинические проявления
Чаще поражаются пальцы рук. С первого дня заболевания на тыльной поверхности пальца появляется болезненное и зудящее пятно розово-красного цвета с резкими границами, возвышающееся над окру- жающей кожей. Через несколько дней зуд нарастает, через 2-3 нед отёк спадает, зуд прекращается, гиперемия исчезает, остаётся шелушение кожи. Воспаление может распространяться на тыльную сторону кисти и на другие пальцы с присоединением лимфангиита и лимфаденита Иногда возникает острый артрит межфаланговых суставов. Общее состояние страдает мало, температура тела обычно не повышается и только при смешанной инфекции может быть высокой.
Лечение
В качестве лечения применяют иммобилизацию кисти, антибиотики в виде внутримышечных инъекций, УФ-облучение кожи, эффективны футлярные прокаиновые блокады с одновременным введением антибиотиков.
Профилактика
Профилактика заболевания сводится к улучшению санитарно-гигиенических условий работы на предприятиях мясной и рыбной промышленности, защите рук от микротравм и инфицирования.
Абсцесс
Абсцесс (гнойник, abscessus) - отграниченное скопление гноя в различных тканях и органах вследствие гнойного расплавления тканей и образования полости (в отличие от эмпиемы, при которой скопление происходит в естественных полостях тела и полых органах).
Различают абсцессы клетчаточных пространств шеи, средостения, забрюшинного пространства, таза и органов (лёгкого, печени и др.). Подкожный абсцесс - ограниченное скопление гноя в подкожной клетчатке.
Этиология и патогенез
Возбудителями гнойной инфекции являются стафилококки - монокультура или в ассоциации с другими микроорганизмами (кишечной палочкой, стрептококком, бактероидами и др.).
Возбудитель инфекции чаще проникает извне (экзогенная инфекция), хотя возможна и эндогенная инфекция - проникновение из соседних или отдалённых органов, метастатические абсцессы при сепсисе. Причиной подкожного абсцесса может быть введение в ткани концентрированных растворов лекарственных веществ - 25% раствора сульфата магния, 50% раствора метамизола натрия и др. Развивающееся гнойное воспаление приводит к расплавлению тканей и иногда к некрозу и отторжению омертвевших тканей - секвестрации. Секвестры могут подвергаться в дальнейшем ферментативному расплавлению.
Полость абсцесса может быть как простой округлой формы, так и сложной, с многочисленными карманами. Стенки абсцесса вначале покрыты гнойно-фибринозными наложениями и обрывками некротизированных тканей. Затем по периферии абсцесса развивается зона воспаления, что приводит к формированию пиогенной мембраны, образованной соединительной тканью.
Возникшие в результате гнойного или асептического воспаления абсцессы имеют различный исход: спонтанное вскрытие с прорывом наружу (абсцесс подкожной жировой клетчатки, мышечный абсцесс, мастит, парапроктит и др.); прорыв и опорожнение гнойника в закрытые полости (брюшную, плевральную, полость суставов и т.д.) с развитием гнойных процессов (перитонита, плеврита, перикардита, артрита и т.д.). Возможен прорыв гнойника в полость органов, сообщающихся с внешней средой (полость кишки, мочевого пузыря и др.). Опорожнившаяся полость абсцесса
при благоприятных условиях уменьшается в размерах, спадается и подвергается рубцеванию, при неполном опорожнении процесс может перейти в хронический с образованием свища на месте прорыва гнойника.
Лечение
Лечение абсцесса заключается во вскрытии, опорожнении и дренировании его полости. Не подлежат вскрытию холодные абсцессы туберку- лёзной этиологии вследствие неизбежно возникающей при этом суперинфекции гноеродной микрофлорой. Сформировавшийся небольшой абсцесс с хорошо выраженной капсулой удаляют полностью.
Для вскрытия абсцесса выбирают кратчайший оперативный доступ с учётом анатомических особенностей и топографии органа. Нередко применяют метод вскрытия абсцесса по игле: первоначально пунктируют абсцесс, затем по игле рассекают ткани. При вскрытии гнойника по возможности подходят к нижнему его полюсу, чтобы создать хорошие условия для дренирования.
С целью уменьшения инфицирования оперативного поля по ходу вскрытия гнойника окружающие ткани тщательно изолируют марлевыми салфетками и, сделав небольшое отверстие в стенке абсцесса, удаляют гной электроотсосом. Аспирировав гной, разрез расширяют, полость абсцесса обследуют пальцем, разделяя имеющиеся перемычки, удаляют секвестры тканей. Следует избегать грубых манипуляций, нарушающих пиогенную мембрану. Полость абсцесса промывают антисептическим раствором, затем дренируют одним или несколькими резиновыми или полихлорвиниловыми трубками или вводят в неё марлевые тампоны, смоченные раствором протеолитических ферментов и антисептических средств. При недостаточном опорожнении гнойника через основной разрез делают дополнительный - контрапертуру. Лечение абсцесса после вскрытия проводят по принципу лечения гнойных ран.
Общее лечение включает укрепляющую терапию, переливания крови и плазмы, применение антибиотиков с учётом чувствительности микробной флоры, средств специфической терапии (иммунизация стафилококковым анатоксином, применение специфического γ-глобулина и др.).
Флегмона
Флегмона (phlegmona) - острое разлитое гнойное воспаление жировой клетчатки, не склонное к отграничению. В зависимости от локализации различают подкожную, межмышечную, забрюшинную флегмону и другие её виды. Флегмоны некоторых локализаций носят специальные названия: гнойный медиастинит, парапроктит, паранефрит, параартикулярная флегмона и др. Флегмоны, развившиеся вследствие перехода гнойного воспаления с лимфатических узлов, называются аденофлегмонами. Флегмоны склонны к распространению по клеточным пространствам, сосудистому ложу, фасциальным футлярам.
Этиология и патогенез
Возбудителем заболевания являются различные гноеродные микроорганизмы (грамположительные и грамотрицательные, аэробные и анаэробные), но чаще - стафилококки, стрептококки, энтеробактерии,
протей, кишечная палочка. Микроорганизмы проникают в жировую клетчатку прямым или гематогенным путём. Возможно образование вторичных флегмон - распространение гнойного воспаления на жировую клетчатку при остеомиелите (параоссальная флегмона), гнойном артрите (параартикулярная флегмона), пиелонефрите (паранефрит) и др.
Развитие флегмоны начинается с серозной инфильтрации подкожной жировой клетчатки. Экссудат быстро приобретает гнойный характер, образуются участки некрозов, которые затем сливаются. Некроз и расплавление клетчатки приводят к абсцедированию флегмоны,
Изменения в тканях при флегмоне зависят от характера возбудителя: гнилостная и анаэробная инфекция приводит к некрозу тканей с образованием пузырьков газов. При кокковой микрофлоре идёт гнойное расплав- ление тканей. Воспалительный процесс при флегмоне не имеет тенденции к отграничению, как это наблюдается при абсцессе, а распространяется по межклетчаточным прослойкам соединительных тканей.
Воспалительный процесс в жировой клетчатке проходит определён- ные стадии развития, начиная с серозного отёка, с последующим образованием воспалительного инфильтрата и затем некроза тканей.
Лечение
Лечение флегмон оперативное. Лишь в самой начальной стадии, когда предполагается серозное воспаление, допустимо консервативное лечение: постельный режим, покой для поражённой конечности, антибиотикотерапия, УВЧ-терапия, электрофорез с химотрипсином. Эффективны футлярные прокаиновые блокады с антибиотиками по Вишневскому. Улучшение общего состояния больных, стихание местных воспалительных явлений являются благоприятными признаками, указывающими на отграничение или обратное развитие процесса. При отсутствии эффекта в течение 12-24 ч или при прогрессировании процесса показана операция.
В экстренном порядке оперируют больных, поступивших поздно, с выраженной интоксикацией, прогрессирующим процессом, наличием гнойного воспаления. Под наркозом производят вскрытие флегмоны, удаление гноя, некротизированных тканей. Вскрывают гнойные затёки и карманы, рану тщательно промывают антисептическими растворами, дренируют. Для обеспечения хорошего дренирования иногда делают дополнительные разрезы - контрапертуры. Лечение после операции проводят по принципу лечения гнойных ран
Глубокая флегмона шеи
Особенности проявления и распространения флегмоны шеи определяются богато развитой в области шеи сетью лимфатических сосудов и узлов, а также особенностями строения фасций шеи, между которыми образуются отграниченные щели и пространства, выполненные рыхлой клетчаткой и лимфатическими узлами.
Острые гнойные процессы в области задней поверхности шеи (в отличие от передней и боковой) весьма редки, к процессам этой локализации относятся глубокие флегмоны между затылочными мышцами. Они могут возникнуть как следствие остеомиелита шейных позвонков или затылочной кости.
Этиология и патогенез
Первичными очагами, послужившими источником флегмоны шеи, могут быть гнойничковые процессы в области волосистой части головы и другие инфицированные очаги (ссадины, трещины) в области ушей, щёк, нижней губы и подбородка, воспалительные процессы в полости рта и носоглотки (ангина, кариозные зубы, стоматит и др.), проникающие ранения в области шеи с непосредственным внесением инфекции, воспалительные процессы в области гортани, трахеи, пищевода, а также повреждение указанных образований инородными телами, остеомиелит шейных позвонков. Иногда возможно развитие гнойников в области шеи вследствие септикопиемии.
Возбудителем флегмоны шеи являются стафилококки, стрептококки, энтеробактерии, неспорообразующие анаэробы и др. Наличие в полости рта гнилостной путридной инфекции, особенно когда её источником являются кариозные зубы, влечёт за собой образование гнилостной флегмоны. Последняя в связи с литическими свойствами представителей этой флоры склонна к образованию затёков, иногда весьма обширных, по межфасциальным щелям и пространствам.
Лечение
Прежде всего должен быть создан покой, как общий, так и в области воспалительного очага: больному предписывают постельный режим, используют антибиотикотерапию - полусинтетические пенициллины, цефалоспорины, аминогликозиды. Местно - тепло в виде грелки, согревающего компресса, УВЧ-терапия. Местное применение холода может быть рекомендовано только на самых ранних стадиях заболевания, до появления воспалительного инфильтрата. В ранних стадиях (стадия серозного отёка) возможно применение диадинамофореза протеолитических ферментов. Сочетание всех перечисленных мер может вызвать обратное развитие воспалительного процесса, о чём будут свидетельствовать уменьшение температуры тела, исчезновение отёка, болей, улучшение самочувствия, уменьшение общих проявлений воспаления.
Нарастание указанных явлений - признак прогрессирования процесса, его перехода в стадию гнойного расплавления, что определяет необходимость оперативного вмешательства. При его выполнении надо строго руководствоваться топографоанатомическими соотношениями органов и локализацией гнойника. Место разреза должно соответствовать участку наиболее отчётливой флюктуации. Осторожное послойное рассечение тканей предотвращает возможность повреждения важных образований, в первую очередь сосудов.
Иногда причиной глубоких флегмон является повреждение стенки пищевода или трахеи инородными телами с последующим развитием по окружности воспаления. Особенно это относится к глотке и пищеводу на уровне шеи, повреждения которых проглоченными инородными телами (иглами, булавками, другими острыми предметами) нередки. Своевременное извлечение инородного тела и назначение противовоспалительной терапии, в том числе антибиотиков, позволяет в ряде случаев избежать грозных осложнений.
Глубокие флегмоны задней поверхности шеи возникают редко, причиной их может послужить гематогенный остеомиелит шейных позвонков или затылочной кости. Гнойники вскрывают с учётом их глубокого расположения между мышцами затылка. При этом необходимо помнить о возможности ранения затылочной артерии или глубокой вены шеи.
Все операции вскрытия флегмон шеи должны заканчиваться дренированием раны (рис. 103, 104). Тампоны помогают остановить капиллярное кровотечение в глубине раны, а также предохраняют полость гнойника от преждевременного (до отторжения некротических тканей и образования грануляций) её спадения.
Клинические проявления
1) В первые 12-24 ч перитонит характеризуется нарастанием воспалительных изменений в брюшине. Больные жалуются на интенсивные боли в животе, которые вначале локализуются в месте расположения источника перитонита, а затем распространяются на соседние области, могут захватывать половину живота или весь живот. Часто отмечается рвота желудочным содержимым, затем жёлчью. Общие клинические проявления заболевания выражаются в повышении температуры тела до 38 °С и выше, тахикардии (пульс учащается до 120 в минуту), повышении артериального давления, учащении дыхания (до 24-28 в минуту), беспокойстве, двигательном возбуждении.
Лицо вначале гиперемировано, затем становится бледным. Живот втянут или умеренно вздут, брюшная стенка или половина её в акте дыхания не участвует. При пальпации живота отмечаются выраженная болезненность и напряжение мышц всей брюшной стенки или в том или ином её отделе (в зависимости от распространённости воспаления по брюшине). Кишечные шумы при аускультации не выслушиваются.
При лабораторном исследовании крови отмечается лейкоцитоз с умеренным сдвигом лейкоцитарной формулы влево.
2) В последующие 24-48 ч перитонит характеризуется тяжёлой интоксикацией и парезом желудочно-кишечного тракта. Больной становится адинамичным, черты лица заострены, кожа бледная, глаза ввалившиеся. Пульс превышает 120 в минуту, наполнение его слабое, АД понижено. Температура тела высокая (39-40 °C), гектического характера, иногда отмечается озноб. Живот вздут, при его пальпации болезненность и напряжение мышц выражены меньше, чем в реактивной фазе, при перкуссии живота выявляют метеоризм, кишечные шумы не выслушиваются. Рвота частая, с кишечным содержимым. В крови лейкоцитоз с выраженным сдвигом лейкоцитарной формулы влево (появление юных форм) и токсической зернистостью лейкоцитов.
3) Развитие полиорганной недостаточности (после 48-72 ч) характеризуется крайней степенью интоксикации. Больной заторможён, адинамичен, безучастен к окружающему, сознание может быть спутанным, нередко развивается токсический психоз (неадекватное поведение, возбуждение, галлюцинации). Лицо землисто-серого цвета, осунувшееся (лицо Гиппократа). Отмечается обильная рвота с каловым запахом.Пульс очень частый, нитевидный, АД понижено. Живот резко вздут, болезнен при пальпации на всём протяжении. Перистальтические кишечные шумы не выслушиваются (симптом гробовой тишины). Температура тела снижается, кожа покрыта холодным липким потом. В крови выраженный лейкоцитоз с резким сдвигом лейкоцитарной формулы влево. Количество мочи уменьшено, в ней определяется высокое содержание белка, цилиндров.
Этиология
Гнойный плеврит вызывают разнообразные гноеродные микроорганизмы: чаще стафилококк, реже - пневмококк, энтеробактерии, а также грамотрицательная микрофлора. Заболевание, вызванное смешанной микрофлорой, протекает тяжелее. Для правильного лечения очень важно знать, какие микробы вызвали процесс, определить их устойчивость к антибиотикам, поэтому крайне необходимо детальное бактериологическое исследование гноя, полученного при первой пункции.
Патогенез
Чаще всего острый гнойный плеврит является осложнением абсцесса лёгкого, прорыв которого в плевральную полость приводит к развитию пиопневмоторакса. В других случаях абсцесса лёгкого инфекция может проникать в плевру по лимфатическим путям.
Плевропневмонии и гриппозные пневмонии нередко осложняются гнойным плевритом. Различают пара- и метапневмонический гнойный плеврит. Парапневмонический плеврит осложняет пневмонию в момент её разгара, а метапневмонический, или постпневмонический, возникает после разрешения пневмонии. Метапневмонический плеврит встречается чаще, чем парапневмонический, и при нём чаще развиваются серозно-гнойная и гнойная экссудация.
Гангрена лёгких также является причиной развития плеврита, обычно гнилостного. Раны, проникающие в плевру, особенно сопровождающиеся значительным гемопневмотораксом, при развитии инфекции приводят к гемопиотораксу. Наконец, гнойный плеврит может развиться при нагноении и прорыве паразитарной (эхинококк) или врождённой кисты лёгкого, распаде злокачественной опухоли лёгкого, кавернозном туберкулёзе лёгких в случае прорыва каверны в плевральную полость.
Инфицирование плевральной полости может произойти лимфогенным или гематогенным путём из внелёгочных очагов гнойной инфекции (гнойный аппендицит, гнойный холецистит, панкреатит, забрюшинные флегмоны, сепсис и др.). Подобное инфицирование возникает реже, оно начинается с образования серозного выпота, который затем переходит в серозно-гнойный и гнойный.
Воспалительный процесс в плевре начинается с гиперемии, отёка, экссудации, появления точечных кровоизлияний, на поверхности плевры откладывается слой фибрина. Гиперемия нарастает, плевра подвергается инфильтрации лейкоцитами, гибель которых приводит к образованию гноя, скапливающегося в плевральной полости. На дне полости гной густой, содержит крошковидные массы, в более поверхностных слоях - жидкий. В самом верхнем слое может находиться прозрачный экссудат. Это следует учитывать при диагностической пункции. Отложение фибрина обусловливает склеивание листков плевры, что приводит к отграничению (осумкованию) эмпиемы. Скопление экссудата в плевральной полости при тотальном поражении плевры может быть значительным и вызывать сдавление лёгкого, смещение органов средостения в здоровую сторону, что ведёт к нарушению дыхания и кровообращения. Всасывание из гнойного очага в кровь бактериальных токсинов, продуктов распада тканей вызывает интоксикацию, тяжесть которой зависит от распространённости воспалительного процесса.
Переход воспаления в продуктивную фазу приводит к образованию соединительной ткани и прорастанию её сосудами с формированием спаек, шварт. Образовавшимися плевральными спайками гнойный экссудат отграничивается от непоражённой части плевральной полости с формированием одной или нескольких камер - осумкованный гнойный плеврит. Воспалительный процесс в плевре при прогрессировании может привести к её расплавлению и прорыву гноя в окружающую клетчатку, мышцы. Через отверстия в фасции гной выходит в мышечные ложа и подкожную клетчатку грудной клетки (empiema necessitatis - эмпиема «по необходимости»). Точно так же воспаление висцеральной плевры ведёт к распространению процесса на лёгочную ткань с образованием воспалительного процесса в лёгком и лимфатических узлах корня лёгкого, расплавление стенки бронха способствует образованию бронхоплеврального свища. Развившийся воспалительный процесс в лёгком может вызвать фиброз лёгочной ткани - необратимые склеротические изменения (пневмосклероз).
Клинические проявления
Клинические проявления заболевания включают:
1) симптомы основного заболевания, послужившего причиной плеврита;
2) признаки гнойной интоксикации;
3) симптомы, обусловленные накоплением жидкости в плевральной полости.
Больные гнойным плевритом жалуются на боль в боку, кашель, ощущение тяжести или распирания в боку, затруднённое дыхание, невозможность глубоко вдохнуть, одышку, повышение температуры тела, слабость. Боль в грудной клетке больше выражена в начале заболевания, носит колющий характер, а по мере распространения воспаления и накопления экссудата ослабевает, присоединяется ощущение тяжести или распирания в боку. Постепенно нарастает одышка. Кашель, как правило, сухой, а при вторичном плеврите на почве пневмонии или абсцесса лёгкого - с мокротой слизистого или гнойного характера, иногда с большим количеством гнойной мокроты. При присоединении плеврита к основному заболеванию изменяется характер кашля, он становится более упорным, мучительным, больше беспокоит по ночам, может быть приступообразным, усиливается в положении на больном боку.
Одышка может быть выраженной, усиливается, как и боль, при положении больного на здоровом боку. Поэтому больные вынуждены лежать на больном боку, что облегчает дыхание и уменьшает боль в груди.
Температура тела высокая (39-40 °С), постоянного или гектического характера. Пульс достигает 120-130 в минуту, что обусловливается как гнойной интоксикацией, так и смещением сердца и сосудов средостения в здоровую сторону вследствие накопления экссудата.
Прорыв абсцесса лёгкого, расположенного под плеврой, с поступлением гноя и воздуха в плевральную полость сопровождается плевральным шоком. Прорыву гноя предшествует сильный мучительный непрекращающийся кашель, который завершается появлением резкой, как «удар кинжалом», боли в боку. Больной не может глубоко вздохнуть, лицо становится бледным, кожа покрывается холодным потом. Пульс частый, слабого наполнения, АД понижается. Из-за выраженной боли дыхание становится поверхностным, частым, появляется акроцианоз, нарастает одышка. Тяжёлая картина заболевания определяется раздражением плевры, вызывающим болевую реакцию, сдавлением лёгкого гноем и воздухом, смещением органов средостения в здоровую сторону с нарушением деятельности сердца. После стихания острых явлений, выведения больного из шока развивается состояние интоксикации, более тяжёлой, чем при мета- и парапневмонических эмпиемах плевры.
При общем осмотре больного отмечаются бледность кожных покровов, одышка, вынужденное положение в постели - полусидячее или на больном боку. Иногда больной сдавливает бок рукой, что уменьшает боль при вдохе. Число дыханий увеличивается до 20-25, в тяжёлых случаях - до 30-40 в минуту.
При осмотре грудной клетки определяется ограничение её дыхательных движений, больная сторона отстаёт при дыхании от здоровой или не участвует в дыхании. При скоплении большого количества экссудата в плевральной полости обнаруживают выбухание грудной клетки в задненижних отделах, межрёберные промежутки сглажены. При пальпации грудной клетки, межрёберных промежутков возможна умеренная болезненность. Голосовое дрожание на стороне поражения ослаблено или вовсе не определяется.
При перкуссии грудной клетки отмечается укорочение перкуторного звука над экссудатом, при тотальном плеврите тупой звук регистрируют над всей половиной грудной клетки, при значительном скоплении экссудата (но не тотальном плеврите) верхняя граница тупости располагается по косой линии Демуазо. При этом определяются треугольники Гарленда и Грокко-Раухфуса. При перкуссии выявляют смещение срединной тупости в здоровую сторону, что обусловлено смещением средостения экссудатом, накапливающимся в плевральной полости.
Аускультация грудной клетки выявляет значительное ослабление или полное отсутствие дыхательных шумов над местом определяемой тупости.
В крови - лейкоцитоз, сдвиг лейкоцитарной формулы влево, увеличение СОЭ. Температура тела повышена до 38-40 °C, постоянная или перемежающегося гектического характера.
Рентгенологическое исследование (рентгеноскопия, рентгенография грудной клетки) показывает скопление жидкости в плевральной полости. Рентгенологическая картина определяется количеством жидкости и её расположением. В начале заболевания жидкость скапливается в задненижних отделах плевральной полости (в рёберно-диафрагмальном синусе), по мере накопления экссудата затемнение лёгочного поля нарастает. В отличие от гидроторакса скопление жидкости при экссудативном плеврите никогда не имеет горизонтального уровня. При пиопневмотораксе над горизонтальным уровнем жидкости в плевральной полости находят слой свободного воздуха.
Данные физикального и рентгенологического исследования позволяют поставить диагноз экссудативного плеврита. Высокая температура тела, тяжёлая интоксикация, изменения в крови (лейкоцитоз, увеличение СОЭ) указывают на наличие гнойного плеврита. Для уточнения диагноза, определения возбудителя и проведения рациональной антибактериальной терапии выполняют диагностическую пункцию плевральной полости.
Точку для пункции выбирают по месту наибольшей тупости, типичная точка расположена в восьмом или девятом межреберье между лопаточной и задней подмышечной линиями. При ограниченном и осумкованном плеврите, небольшом скоплении жидкости точку для пункции намечают совместно с рентгенологом при рентгеноскопии грудной клетки.
Лечение
Терапия гнойного плеврита включает удаление гноя, борьбу с инфекцией, дезинтоксикационную терапию, восстановление нарушенных функций органов.
Основной метод лечения эмпиемы - закрытый, при котором не производят вскрытия плевральной полости. При открытом методе выполняют разрез грудной стенки для удаления гноя, фибрина и шварт.
К закрытым методам лечения гнойного плеврита относятся лечебные пункции плевральной полости и дренирование её путём прокола грудной стенки. Дренажную трубку можно вывести также через ложе резецированного ребра, зашив вокруг неё мягкие ткани для создания герметичности (рис. 157, 158).
Начинают лечение гнойного плеврита с пункций плевральной полости. Обязательно проводят местную анестезию. Пункцию осуществляют иглой с широким просветом (1-1,5 мм), обязательно используя трёхходовой кран или резиновую трубку с зажимом, которыми перекрывают иглу при отсоединении шприца. Это позволяет избежать пиопневмоторакса вследствие попадания атмосферного воздуха в плевральную полость. Удалять гной при большом его скоплении в плевральной полости следует медленно, чтобы не вызвать вследствие быстрого опорожнения полости гиперемию ex vacue и резкого смещения средостения. Это чревато опасностью развития шока.
Пункцию продолжают до полного удаления гноя и появления в шприце отрицательного давления (при оттягивании поршня через иглу содержимое не поступает, а при отпускании поршень возвращается в исходное положение). Заканчивают пункцию введением в плевральную полость раствора протеолитических ферментов и антибиотиков. Пункции производят ежедневно.
Если первые пункции не дали эффекта, прибегают к активной постоянной аспирации гноя из плевральной полости. В плевральную полость вводят постоянный дренаж. Для этого широким троакаром после надреза кожи скальпелем пунктируют через межрёберный промежуток плевральную полость, стилет удаляют, а через трубку троакара в плевральную полость вводят дренажную трубку, после чего трубку троакара также удаляют. Дренажную трубку фиксируют к коже швом или полоской лейкопластыря и подсоединяют к вакуумной системе с постоянным разрежением 50-100 мм вод.ст. за счёт водоструйного или электрического отсоса. Гной из плевральной полости удаляется постоянно, благодаря отрицательному давлению листки плевры соприкасаются между собой, склеиваются, и гнойная полость ликвидируется (рис. 159).
Если обеспечить постоянную аспирацию невозможно, на конец дренажной трубки надевают клапан из перчаточной резины и помещают его в банку с антисептическим раствором (дренирование по Бюлау). Клапан пропускает из плевральной полости гной, воздух (при пиопневмотораксе), закрывается при отрицательном давлении в ней и предупреждает поступление воздуха или жидкости обратно в плевральную полость при вдохе.
В редких случаях при неэффективности закрытых методов лечения применяют открытый метод - торакостомию для удаления густого гноя, фибрина, секвестров лёгочной ткани, которые не удаётся вывести через иглу или дренаж (рис. 160).
Этиология и патогенез
Возбудителями гнойного перикардита являются стафилококки, энтеробактерии, гонококки, туберкулёзная палочка и др. Заболевание в основном вторичное - развивается как осложнение гнойного медиастинита, абсцесса печени, гнойного плеврита, перитонита, рожи, остеомиелита, флегмон различной локализации и др. Основной путь распространения инфекции лимфогенный, реже - гематогенный. Возможен и контактный путь - распространение воспаления с соседних органов на перикард. Гнойный перикардит может встречаться как осложнение внутригрудных операций. Перикардит, возникающий после ранений сердца, перикарда, называют первичным.
Воспаление перикарда развивается по общим правилам и начинается с гиперемии, отёка, образования внутриперикардиального экссудата, который вначале бывает серозным, а затем становится гнойным. Выпот в перикарде может быть геморрагического характера - вследствие микротравмы расширенных сосудов при работе сердца. Количество экссудата может достигать 0,5-1,5 л. В воспалительный процесс вовлекаются эпикард, миокард (вторичный миокардит). Отложение фибрина на эпи- и перикарде приводит к склеиванию их между собой с последующим образованием в этих местах сращений - внутриперикардиальных спаек, массивное развитие которых приводит к облитерации полости перикарда.
Этиология и патогенез
Остеомиелит - заболевание полиэтиологическое, вызывается различными неспецифическими возбудителями гнойной инфекции, среди которых чаще встречаются стафилококки, реже - стрептококки, пневмококки, энтеробактерии и другие, а в 10-15% случаев - микробные ассоциации. Возбудителями могут быть и специфические микроорганизмы (туберкулёзная палочка, палочка брюшного тифа, бледная спирохета), а также грибы (актиномицеты).
Из очагов инфекции, имеющихся в организме (например, фурункул, карбункул, гнойный синусит, тонзиллит, отит, флегмоны, абсцессы, рожа и др.), микробы заносятся током крови в костный мозг, где оседают и при определённых условиях вызывают воспаление. Воспалительный процесс обычно локализуется в длинных трубчатых костях (голень, бедро, плечо).
К факторам, влияющим на развитие остеомиелита, относятся:
1) особенности кровоснабжения костей у детей, у которых диафизы костей имеют магистральный тип кровоснабжения, а для эпифизов и метафизов характерна петлистая сеть мелких сосудов и капилляров, что способствует оседанию в них микроорганизмов (эмболическая теория Боброва-Лексера);
2) в развитии остеомиелита важную роль играют биологические и иммунологические особенности организма (аллергическая теория С.М. Дерижанова);
3) предрасполагающие моменты, к которым относятся травма кости, снижение общей сопротивляемости организма, обусловленное переутомлением, инфекционным заболеванием, гиповитаминозом и др.
При негематогенных формах остеомиелита микроорганизмы проникают в кость извне (экзогенное инфицирование, наблюдаемое при огнестрельных ранениях, обширных повреждениях мягких тканей, открытых переломах). Развившийся местный воспалительный процесс приводит к нарушению кровообращения вследствие стаза, тромбоза сосудов и нарушения питания кости с последующим её некрозом. В отличие от гематогенного остеомиелита воспалительный процесс может начинаться как с костного мозга, так и с надкостницы. Секвестры могут быть первичными, образовавшимися в результате травматического повреждения (оскольчатые, огнестрельные переломы), в отличие от вторичных - возникающих при развитии некроза кости вследствие остеомиелитического процесса.
Воспалительный процесс при гематогенном остеомиелите начинается в костном мозге в виде его гиперемии и отёка (как проявление серозного воспаления). В последующем развивается гнойная инфильтрация с появлением флегмоны. В этот период возможны тромбоз сосудов и образование некроза кости. По каналам остеона (гаверсовым каналам) гнойно-воспалительный процесс распространяется кнаружи, проходит через слой кости и вовлекает в воспаление надкостницу (периостит). Скопление гноя под надкостницей отслаивает её с образованием поднадкостничного абсцесса. При разрушении надкостницы воспалительный процесс распространяется кнаружи, захватывая окружающие кость ткани с образованием параоссальной флегмоны. Последующее вовлечение в процесс кожи и подкожной клетчатки приводит к самопроизвольному вскрытию флегмоны и образованию гнойного свища. Тромбоз кровеносных сосудов, питающих кость в зоне её компактного слоя, а также воспаление кости (остит) вызывают её некроз и секвестрацию (отторжение). Секвестры могут быть кортикальными, тотальными, центральными. Происходящие одновременно процессы пролиферации кости приводят к развитию периостальных наслоений, иногда с окостенением (оссификацией). Развитие грануляционной ткани в процессе оссификации способствует образованию секвестральной коробки, окружающей секвестр. Образование секвестра и секвестральной коробки, наличие свищей характеризуют переход воспаления в хроническую форму (вторичный хронический гематогенный остеомиелит).
Классификация остеомиелита
I. По этиологии:
1) неспецифический остеомиелит;
2) специфический остеомиелит.
II. В зависимости от пути инфицирования:
1) гематогенный;
2) негематогенный: а) травматический; б) огнестрельный; в) контактный; г) операционный.
III. По клиническому течению:
1) гематогенный: а) острый (токсическая, септикопиемическая, местная формы); б) первично-хронический; в) вторичный хронический;
2) негематогенный: а) острый, б) хронический.
Клиническая картина
Больной острым гематогенным остеомиелитом жалуется на внезапно появившуюся резкую боль в кости, часто в области одного из крупных суставов. Боль распирающего, рвущего характера; интенсивность её столь велика, что больные кричат, не спят, малейшее движение поражённой конечностью усиливает боль. Больные жалуются на недомогание, головную боль, повышение температуры тела, озноб, потерю аппетита.
Острый гематогенный остеомиелит поражает в основном детей и подростков, мальчиков в 3-5 раз чаще, чем девочек. Заболевание начинается внезапно, но иногда больные за 1-2 дня отмечают небольшое недомогание.
При выяснении анамнеза удаётся установить такие предрасполагающие факторы, как ушиб конечности или переохлаждение, перенесённые в прошлом ангины, гнойный фарингит, наличие кариозных зубов, гнойных процессов (фурункулов, панариция, инфицированных ран или ссадин и т.д.). Всё это может быть источником инфекции при гематогенном остеомиелите.
При осмотре больного устанавливают признаки общей гнойной интоксикации: вялость, адинамию, заторможённость, липкий пот, бледность кожи, учащённое дыхание, тахикардию - до 110-120 в минуту. Тоны сердца становятся глуше, появляется систолический шум. Нередко увеличиваются селезёнка и печень, появляются рвота, парез кишечника, боль в области почек (положительный симптом Пастернацкого).
В первые сутки заболевания при осмотре больного обращают внимание на вынужденное (полусогнутое) положение поражённой конечности. Как активные, так и пассивные движения в ближайшем к очагу суставе резко ограничены из-за усиливающейся боли.
Для установления очага остеомиелита необходимо осторожное поколачивание над костью. Поколачивание в области пяточной кости выявляет болевой синдром по оси конечности. Появление резкой боли в одном из метаэпифизов указывает на локализацию острого гнойного воспаления в кости. В более поздние сроки кожные покровы над пора- жённой частью конечности становятся напряжёнными, инфильтрированными, а затем гиперемированными. При пальпации определяются инфильтрация мягких тканей, болезненность и местная гипертермия. При сравнительном измерении конечностей в симметричных областях определяется увеличение окружности поражённой конечности, обусловленное нарастающим отёком.
При запущенном остром гематогенном остеомиелите определяются местные признаки флегмоны: припухлость, гиперемия кожи и флюктуация. Иногда больные поступают с уже самопроизвольно вскрывшейся флегмоной с наличием гнойного свища. При особо неблагоприятно развивающемся остеомиелите через 3-4 нед от начала заболевания может появиться симптом патологической подвижности конечности, что указывает на произошедший в связи с остеонекрозом патологический перелом.
При локализации первичного очага остеомиелита в метаэпифизарной зоне нередко в воспалительный процесс вовлекается прилежащий сустав. При этом возникают типичные признаки гнойного артрита: сглаживание контуров сустава, симптом флюктуации, ограничение объёма движений, болезненность, наличие гнойного выпота при диагностической пункции сустава. Обычно этих местных симптомов бывает достаточно для установления диагноза острого гематогенного остеомиелита. Трудность в диагностике возникает до развития воспаления в мягких тканях. В этих случаях показана диагностическая пункция кости (остеоперфорация) специальной иглой в области соответствующего метафиза. Если при аспирации в шприце появляется жидкий гной или мутная сукровица с фибринозными хлопьями, это свидетельствует об остеомиелите. При обнаружении неизменённой крови следует отвергнуть диагноз остеомиелита, но продолжать динамическое наблюдение за больным. При пункции костномозгового канала у больных острым остеомиелитом, кроме того, обнаруживают повышение внутрикостного давления до 300-400 мм вод.ст. (норма - 50 мм вод.ст.).
Диагностика
Для острого гематогенного остеомиелита характерен лейкоцитоз до 20,0х109/л с увеличением количества нейтрофилов, СОЭ всегда повышена. Отмечают умеренное снижение содержания гемоглобина. Одновременно развивается диспротеинемия - уменьшение альбуминовой фракции белков сыворотки крови, возрастание уровня α1- и α2-глобулинов. Наблюдаются изменения в моче: белок, лейкоциты, цилиндры. При септикопиемической форме остеомиелита нередко определяется бактериурия.
Достоверные рентгенологические признаки остеомиелита обычно появляются не ранее чем через 10-14 дней от начала заболевания. С этого момента удаётся установить утолщение надкостницы, «размывание» архитектоники костной структуры с последующим образованием поло- сти в кости. Наиболее ранним, но непостоянным рентгенологическим признаком острого остеомиелита является уплотнение тени мягких тканей, прилегающих к поражённой части кости.
Для ранней диагностики острого остеомиелита можно использовать радионуклидный метод и тепловидение. При сцинтиграфии в поражённой части кости обнаруживают гиперфиксацию радиофармацевтического пре- парата уже в первые 2-3 сут от начала заболевания. Данные, полученные при использовании тепловизора, тоже в ранние сроки позволяют установить воспалительный процесс в кости и окружающих мягких тканях.
Острый гематогенный остеомиелит в ряде случаев приходится дифференцировать с ревматизмом, последствиями травмы, туберкулёзом кости, поражениями кости при тифе и др. Исключить травматическое поражение кости помогают анамнестические данные, общие признаки воспаления и интоксикации, рентгенологические, лабораторные данные и др. Для ревматизма характерны продромальный период в течение нескольких дней, поражение нескольких мелких суставов; при остеомиелите, как правило, страдает один сустав. При ревматизме выпот в суставе серозный, а не гнойный. При остеомиелите воспаление распространяется на метадиафиз, а при ревматизме оно ограничено эпифизарной областью.
Клиническая картина
Клиническое течение хронического остеомиелита складывается из двух фаз - рецидива и ремиссии. При активной патогенной флоре на фоне ослабления организма, охлаждения, травмы и других факторов происходит обострение хронического остеомиелита - фаза рецидива заболевания. Под воздействием антимикробного лечения или самопроизвольно острота воспалительных изменений проходит и наступает фаза ремиссии заболевания. Такая смена фаз может повторяться многократно.
Хронический остеомиелит характеризуется основными признаками: рецидивирующее течение, наличие секвестра (или остеомиелитической полости), гнойного свища, остеосклероза.
Рецидив хронического остеомиелита проявляется ухудшением общего состояния. У больного отмечаются недомогание, слабость, головная боль, повышение температуры тела, потливость, может быть озноб, появляется боль в конечности, открывается гнойный свищ. В ряде случаев над хроническим остеомиелитическим очагом кожа становится гиперемированной, появляются сильная боль и инфильтрация мягких тканей, а в последующем - симптом флюктуации, открывается ранее закрывшийся гнойный свищ либо происходит самопроизвольное вскрытие флегмоны в новом месте. После опорожнения гнойника интоксикация уменьшается, температура тела становится субфебрильной, местное воспаление постепенно ликвидируется, гнойный свищ продолжает функционировать или тоже постепенно закрывается. Наступает фаза ремиссии остеомиелита, которая вновь может смениться фазой рецидива.
Клиническое течение различных видов хронического остеомиелита в принципе идентично - происходит смена фаз заболевания. Но при посттравматическом (в том числе огнестрельном) остеомиелите воспаление кости обычно ограничено областью перелома, где образуются гнойные свищи. Для хронического гематогенного остеомиелита характерно остеомиелитическое поражение кости на значительном протяжении метаэпифиза и диафиза с различной локализацией гнойных свищей, нередко нескольких. Соответственно большему распространению воспаления при хроническом гематогенном остеомиелите более выражены проявления хронической гнойной интоксикации, изменения в крови (лейкоцитоз, увеличение СОЭ, диспротеинемия), нарушение функций почек и др.
Диагностика
При сборе анамнеза удаётся установить, что больной в прошлом перенёс острый гематогенный остеомиелит или перелом костей, осложнившийся нагноительным процессом. Необходимо уточнить количество рецидивов заболевания, продолжительность ремиссии, было ли отхождение из свищей мелких костных секвестров. Выясняют количество операций в прошлом, их характер, вид пластики костной полости, ближайший послеоперационный результат.
При выяснении жалоб следует уточнить иррадиацию болей в суставы, наличие болей по ходу сосудисто-нервных пучков, что может указывать на образование новых гнойных затёков.
Общие симптомы при рецидиве остеомиелита идентичны таковым при любом гнойном хирургическом заболевании, поэтому определяют температуру тела, делают необходимые анализы крови и мочи.
При определении местных изменений следует обратить внимание на распространённость гиперемии кожных покровов, инфильтрацию мягких тканей, наличие симптома флюктуации. Важно уточнить степень функционирования свища, исследовать его пуговчатым зондом, что позволяет у некоторых больных установить локализацию остеомиелитического очага.
При наличии язв в местах длительно существующего гнойного свища тщательно осматривают их поверхность и края и при малейшем подозрении на малигнизацию выполняют биопсию.
Для уточнения распространённости воспалительного процесса на соседние суставы определяют объём движений, наличие болезненности и выпота в них.
Важнейшим диагностическим методом при хроническом остеомиелите является рентгенологический, он позволяет установить наличие секвестров, остеомиелитических полостей, хронического периостита, определить протяжённость остеомиелитического поражения костей (рис. 135). Очень ценные сведения даёт фистулография, позволяя получить представление о направлении свищевых ходов, связи их с костными полостями, что необходимо знать при планировании хирургической операции и выборе операционного доступа (рис. 136).
Сцинтиграфия костей позволяет установить наличие в них воспалительного процесса.Метод помогает в дифференциальной диагностике хронического остеомиелита и опухолей костей. При остром остеомиелите в первые дни заболевания рентгенография малоинформативна, радиоизотопное исследование более эффективно при выявлении ранних воспалительных изменений в костной ткани (рис. 137, см. цв. вкл.).
Для определения тонких структурных изменений в костной ткани (обнаружения мелких секвестров, остеомиелитических очагов и т.д.), а также состояния окружающих тканей большое значение имеет компьютерная томография (рис. 138).
Обязательным является исследование патогенной микрофлоры на её чувствительность к антибиотикам, а также изучение показателей специфической и неспецифической иммунобиологической реактивности организма больных хроническим остеомиелитом. Чаще всего обнаруживают стафилококковую и грамотрицательную микрофлору в монокультуре или в ассоциациях, устойчивую ко многим антибиотикам. У больных хроническим остеомиелитом отмечают умеренное снижение титра стафилококкового антитоксина и показателей неспецифической иммунобиологической реактивности: титра комплемента, фагоцитарной активности лейкоцитов, Т-лимфоцитов и др.
Лечение
Хирургическое лечение больных хроническим остеомиелитом показано при наличии секвестров, гнойных свищей, остеомиелитических полостей в костях, остеомиелитических язв, при малигнизации, ложном суставе, частых рецидивах заболевания с выраженным болевым синдромом, интоксикацией и нарушением функций опорно-двигательного аппарата, а также при обнаружении выраженных функциональных и морфологических изменений паренхиматозных органов, вызванных хронической гнойной инфекцией.
Противопоказаниями для радикальной операции при хроническом остеомиелите (некрэктомия) являются выраженная почечная недостаточность на почве амилоидоза, декомпенсация сердечно-сосудистой, дыхательной систем и др.
Главнейшим звеном комплексного лечения хронического остеомиелита является радикальная операция - некрэктомия, которую часто называют ещё секвестрэктомией (рис. 139, см. цв. вкл.). Цель операции - ликвидация хронического гнойного очага в кости и окружающих мягких тканях. При радикальной некрэктомии удаляют секвестры, вскрывают и ликвидируют все остеомиелитические полости с их внутренними стенками, грануляции и детрит, иссекают все гнойные свищи.
Следующий важный этап радикальных операций - санация и пластика костной полости. В настоящее время применяют пластику мышечным лоскутом на кровоснабжаемой ножке, костную пластику (с использованием аутогенной и консервированной костной ткани), хондропластику (с использованием консервированного хряща), реже осуществляют кожную пластику (рис. 140).
Используют различные биополимерные материалы: коллагеновую губку, импрегнированную антибиотиками, клеевые композиции с различными ингредиентами и биополимерные пломбы, содержащие антисептики. Все эти материалы содержат в своём составе препараты, активирующие регенерацию костной ткани.
Санацию костных полостей после некрэктомии проводят методом активного длительного промывного дренирования и методом вакуумирования (рис. 141). Нередко их используют одновременно: через приводящий дренаж промывают костную полость, отводящий дренаж присоединяют к отсосу. Для промывной санации, которая проводится в течение 7-15 сут, используют различные антисептические растворы: антибиотики, гидроксиметилхиноксилиндиоксид, нитрофурал, фуразидин, этакридин, гипохлорит натрия и др. Эффективность санации костной полости контролируется микробиологическими исследованиями.
После выполнения некрэктомии лечение направлено главным образом на подавление остаточной микрофлоры в области хирургического вмешательства, что обеспечивает хорошие результаты в ближайшем послеоперационной периоде. Эта цель достигается следующими лечебными мероприятиями: 1) антибиотикотерапией, 2) иммунотерапией, 3) местным проведением физиотерапевтических процедур: УЗ-терапии, электрофореза лекарственных веществ.
В послеоперационном периоде осуществляют инфузионную терапию: переливание препаратов крови, белковых кровезамещающих жидкостей, электролитных растворов; коррекцию обменных процессов; иммобилизацию конечности, а затем лечебную физкультуру (для улучшения функций опорно-двигательного аппарата).
Внутрикостный абсцесс Броди
Внутрикостный абсцесс Броди - ограниченный некроз губчатого вещества кости с последующим её расплавлением и образованием полости. Последняя заполнена гнойной, серозной или кровянистой жидкостью, иногда в ней находят тканевый детрит. Возбудителем в большинстве случаев является стафилококк. Локализуется процесс чаще в проксимальном отделе большеберцовой кости. Этот вид остеомиелита патогенетически связан с маловирулентной инфекцией и пониженной реактивностью организма.
Клинические проявления заболевания различны. Наблюдается ограниченная чувствительность при надавливании на кость, однако нередко очаги ничем не проявляются, боль возникает лишь временами - ночью, после физического напряжения, при перемене погоды. Повышение температуры тела, озноб и другие общие симптомы обычно отсутствуют. Встречаются, однако, и формы с периодическим обострением, повышением температуры тела, покраснением кожи, болезненностью при надавливании и движениях. Процесс может длиться годами, периоды обострения сменяются временной ремиссией. Осмотр обычно малоинформативен, в более выраженных случаях находят утолщение в области метафиза, нередки реактивные явления в суставе.
На рентгеновских снимках можно видеть в губчатой части метафиза полость диаметром 2-2,5 см, округлой или овальной формы, окружённую хорошо выраженной зоной склероза в виде узкой или широкой каймы, на поверхности кости нередко видны нежные периостальные наложения (рис. 142).
Основной метод лечения абсцесса хирургический. Производят трепанацию полости, выскабливают внутреннюю стенку. Рану зашивают наглухо. При больших полостях применяют мышечную пластику.
Лечение
Лечение острого гнойного артрита включает как местные, так и общетерапевтические мероприятия. Местное лечение: а) пункция сустава с эвакуацией гнойного выпота, промывание полости сустава антисептическим раствором и затем введение антибиотиков (рис. 149); лечебные пункции проводят ежедневно - до прекращения скопления воспалительного экссудата в полости сустава; б) иммобилизация конечности с помощью гипсовой лонгеты или лечебной шины; в) физиотерапия: УВЧ, кварцевое облучение, электрофорез трипсина, антибиотиков и др.; г) после стихания воспалительного процесса - лечебная физкультура, массаж и другие мероприятия для восстановления функций сустава.
Общее лечение включает антибиотикотерапию, проводимую с учётом данных микробиологических исследований, иммунотерапию, переливания крови, плазмы, белковых кровезамещающих жидкостей, дезинтоксикационную терапию, рациональное питание, насыщенное белками и витаминами.
Хирургическое вмешательство - артротомия - показано лишь в случаях, когда пункционный метод лечения с общей и местной антибактериальной терапией оказывается безуспешным. При артротомии из полости сустава эвакуируют гнойный выпот, фибринозные плёнки, после чего вводят дренажи для активного длительного промывного санирования (рис. 150). При параартикулярной флегмоне необходимы её вскрытие и дренирование, дальнейшее лечение - по обычным правилам.
Мерами профилактики острого гнойного артрита являются тщательная первичная хирургическая обработка ран при ранениях сустава, строгое соблюдение асептики при ортопедических операциях и правильное лечение гнойных процессов в тканях, прилежащих к суставу.
Лечение
При посттравматическом остеомиелите показана хирургическая операция, при которой удаляют секвестры, некротизированные костные осколки, гнойные грануляции, иссекают свищи. Поспешное удаление металлических конструкций при осложнении перелома остеомиелитом не всегда приводит к улучшению состояния больного (возможно даже его ухудшение). Удаление металлической конструкции необходимо, если она не обеспечивает иммобилизации (при интрамедуллярном остеосинтезе) или когда поражается кость на большом протяжении по ходу конструкции.
Внеочаговый остеосинтез при осложнении остеомиелитом перелома кости выполняет роль лечебной иммобилизации, которая необходима при остеомиелите. При наличии несросшегося перелома и остеомиелита производят экономное освежение костных отломков с последующей их репозицией. Такой сложный вопрос, как иммобилизация костных отломков, в этих случаях решают строго индивидуально. Методом выбора является внеочаговый компрессионный остеосинтез (рис. 146). При неэффективности лечения ложного сустава, осложнённого хроническим остеомиелитом, после ликвидации остеомиелитического процесса возможна резекция кости в пределах здоровых тканей с одновременной аутотрансплантацией кости.
Главное в профилактике посттравматического остеомиелита состоит в предотвращении вторичного инфицирования открытых ран, в особой тщательности первичной хирургической обработки раны при открытом переломе костей и в учёте показаний и противопоказаний к металлоостеосинтезу в этих условиях.
106. Сепсис. Классификация. Этиология и патогенез.
Сепсис (sepsis) - общая гнойная инфекция - тяжёлое вторичное инфекционное заболевание полимикробной природы с особой реакцией организма и клинической картиной болезни.
Классификация сепсиса
I. По этиологии: а) стафилококковый; б) стрептококковый; в) пневмококковый; г) гонококковый; д) колибациллярный; е) анаэробный; ж) смешанный; з) грибковый.
II. По локализации первичного очага: 1) раневой; 2) абдоминальный; 3) ангиогенный; 4) гинекологический; 5) урологический; 6) отогенный; 7) одонтогенный; 8) катетерный; 9) криптогенный и др.
III. По времени развития: а) ранний (развившийся до 10-14 дней с начала болезни или момента повреждения); б) поздний (развившийся позже 2 нед).
IV. По клинической картине: а) молниеносный; б) острый; в) подострый; г) рецидивирующий; д) хронический.
V. По характеру реакции организма больного: а) гиперергическая форма; б) нормергическая форма; в) гипергическая форма.
Сепсис - вторичное заболевание, осложняющее течение различных гнойных процессов (абсцесса, флегмоны, карбункула, гнойного плеврита, остеомиелита и др.). Для сепсиса не характерен определённый инкубационный период, но имеется первичный гнойный очаг или входные ворота инфекции (травматические повреждения, ожоги). После развития сепсиса первичный очаг чаще всего поддерживает общую гнойную инфекцию, но в ряде случаев он может стать малозаметным.
Быстрота развития общей гнойной инфекции, как и длительность заболевания, различна - от нескольких часов (молниеносные формы) до нескольких дней или недель (острый сепсис).
Сепсис - редкое заболевание, что обусловлено улучшением профилактики хирургической инфекции при травмах, операциях, а также эффективностью лечения гнойных хирургических заболеваний.
Теории сепсиса
Существует несколько теорий возникновения сепсиса, среди которых в историческом плане представляют интерес следующие.
По микробиологической теории (Р. Кох) сепсис - гнилокровие, представляется как процесс развития, размножения микробов в крови человека.
По Х. Шотмюллеру, сепсис представляет собой особый характер местного воспалительного процесса. Эту теорию поддерживал Р. Вирхов.
И.В. Давыдовский представлял сепсис как особую реакцию организма на инфекцию, на воспаление. В этом отношении существенная роль отводилась сенсибилизации организма, аллергии. Эта теория является по существу основной, общепризнанной, и предлагаемые в последние годы новые теории не только не отвергают, но и подтверждают, дополняют эту теорию на современном уровне научных исследований.
Так, по Росслю бактериальные токсины могут быть аллергенами, а сепсис представляет собой аллергическую реакцию организма на бактериальные токсины - аллергическая теория сепсиса. Её поддерживал А.И. Абрикосов.
Цитокиновая теория В. Эртель в развитии сепсиса предполагает ведущую роль выброса цитокинов и секреции интерлейкинов (IL-1, IL-6, IL-8), имеющих основное значение в развитии общего ответа организма на воспаление. Это является пусковым моментом в развитии сепсиса, а падение секреции IL-2 приводит к снижению уровня Т- и В-лимфоцитов, уменьшению синтеза иммуноглобулинов. Изменения в иммунной системе являются при этом одной из основных причин развития сепсиса.
Этиология
Сепсис - заболевание полиэтиологическое, его вызывают различные гноеродные микробы, как грамположительные (стафилококки, стрептококки, пневмококки), так и грамотрицательные (кишечная палочка, протей, синегнойная палочка и др.), а также анаэробные микроорганизмы. Характер возбудителя сказывается на особенностях клинического течения сепсиса. При грамотрицательной микрофлоре сепсис редко приводит к септикопиемии, но сопровождается токсическим шоком у трети больных, протекает с выраженной интоксикацией; при грамположительной флоре септический шок возникает в 3-5% случаев.
Вид возбудителя сказывается на частоте и локализации метастазов при сепсисе. Так, типичными метастазами инфекции при стафилококковом сепсисе являются кожные покровы, лёгкие, мозг, печень, эндокард, кости, почки; при сепсисе, вызванном гемолитическим стрептококком, метастазы чаще возникают в кожных покровах и суставах; при зеленящем стрептококке, энтерококках - в эндокарде; бактероиды приводят к метастазированию в лёгкие, плевру, печень, мозг.
Источником общей гнойной инфекции могут стать любые воспалительные заболевания (абсцесс, флегмона, карбункул, остеомиелит, перитонит и др.) и травматические повреждения (открытые переломы костей, раны, ожоги и др.). Источником сепсиса бывают гнойные заболевания зубов, челюстей, полости рта (одонтогенный сепсис), уха (отогенный сепсис), сосудов (ангиогенный сепсис), он может возникнуть при длительном стоянии катетеров (катетерный сепсис) и др.
Возможным источником инфекции при сепсисе могут стать невыявленные её очаги («дремлющая» инфекция) или хроническая инфекция (хронический тонзиллит, назофарингит, синуситы, пародонтоз, гнойные кисты корня зуба и др.). Эти очаги эндогенной инфекции при повреждении капсулы гнойного очага во время операции, травмы, при снижении устойчивости организма вследствие других заболеваний могут стать источником генерализации инфекции. Влияние первичного очага проявляется не только в качестве источника инфекции и токсинов, его роль велика также в развитии состояния сенсибилизации организма как фона для возникновения общей гнойной инфекции. С удалением первичного очага подобную роль в поддержании септического процесса могут выполнять развившиеся вторичные (метастатические) очаги гнойной инфекции.
В крайне редких случаях источник сепсиса установить не удаётся, такой вид сепсиса называют криптогенным.
Гноеродные микроорганизмы из первичного гнойного очага проникают в кровь (бактериемия), что может приводить к развитию метастазов в различных органах. Другим проявлением общей гнойной инфекции является токсемия, при которой микробные токсины и продукты распада тканей вызывают поражение различных органов; при этом процесс протекает по типу аллергической реакции без образования метастатических гнойников (септицемия). В этих случаях в развитии септической реакции решающее значение имеют токсические воздействия на организм.
Развитие общей гнойной инфекции определяется воздействием следующих основных факторов.
1. Микробиологический фактор (вид, вирулентность, количество, длительность воздействия попавших в организм бактерий и их токсинов).
2. Очаг внедрения инфекции (область, характер и объём разрушения тканей, состояние кровообращения в очаге внедрения, место и пути распространения инфекции и др.).
3. Реактивность организма (иммунологическое состояние, аллергия, состояние различных органов и систем и др.).
Основная роль в развитии сепсиса принадлежит состоянию макроорганизма. В одних случаях незначительные повреждения (ссадины, уколы и др.) приводят к развитию сепсиса, а в других обширные повреждения, распространённые гнойные процессы протекают без генерализации инфекции.
Вид микроорганизма также сказывается на тяжести и характере течения септического процесса. Так, для стрептококкового сепсиса малохарактерно развитие метастазов гнойной инфекции, в то время как стафилококковый сепсис протекает с образованием метастазов в 90-95% случаев. Различия в течении общей гнойной инфекции обусловлены биологическими свойствами микроорганизмов: стрептококки выделяют фермент фибринолитического действия (стрептокиназу), что не способствует оседанию и фиксации микробов в тканях; стафилококк же, наоборот, способствует выпадению фибрина и легко оседает в различных тканях.
Распространение (генерализация) инфекции из очага поражения происходит гематогенным или лимфогенным путём, либо по тому и другому одновременно. При распространении инфекции гематогенным путём обычно поражаются региональные вены - развиваются восходящие флебит, тромбофлебит, перифлебит, являющиеся источником образования тромбов, эмболов, перенос которых приводит к появлению вторичных гнойных очагов. Лимфогенный путь распространения инфекции из очага более редок, так как здесь играет роль фильтрующий барьер, каким являются лимфатические узлы, где микроорганизмы задерживаются и уничтожаются. Вторичные гнойники обычно развиваются на месте оседания инфицированного тромба, принесённого током крови из первичного очага гнойного воспаления при восходящем тромбофлебите, иногда - в результате нагноения инфарктов при местных тромбозах. Вторичные гнойные очаги (метастазы инфекции) могут быть одиночными и множественными, развиваются в различных тканях и органах (подкожной клетчатке, почках, печени, лёгких, головном мозге, предстательной железе и др.), при этом на первом месте по частоте находится подкожная клетчатка, затем - лёгкие.
На развитие сепсиса оказывает влияние состояние иммунологических сил организма. Устойчивость организма к сепсису снижают шок, анемия, истощение больного (в связи с предшествующими заболеваниями, недостатком питания), авитаминоз, повторные травмы, нарушения обмена веществ или патология эндокринной системы.
Патогенез сепсиса
Следует исходить из того, что сепсис - процесс вторичный, суть его сводится к необычной (неадекватной) реакции организма на очаг инфекционного воспаления. Генерируют такую реакцию очаг гнойного воспаления и состояние макроорганизма. Для развития генерализованной инфекции должны быть определённые условия. Известно, что воспаление независимо от его характера и локализации вызывает обычную (адекватную) реакцию организма, это выражается в повышении температуры тела, интоксикации, изменениях со стороны внутренних органов. Степень выраженности общих проявлений соответствует тяжести и распространённости гнойного воспаления. При определённых неблагоприятных для организма условиях (иммунодефицитном состоянии, аллергии) общий его ответ на воспаление, инфекцию, бактериальные токсины выходит за рамки обычной реакции, развивается чрезмерная (неадекватная) общая воспалительная реакция - синдром системной воспалительной реакции (ССВР). Развитие ССВР может быть не столь быстрым, когда аллергия наступает в процессе развития воспаления в гнойном очаге. Пусковым моментом ССВР являются угнетение иммунной системы (срыв нормальной иммунной реакции), аллергия, что приводит к лавинообразному высвобождению и выбросу медиаторов воспаления (цитокинов, протеаз, кининов, простагландинов и др.). ССВР следует рассматривать как этап перехода к генерализованной инфекции (сепсису).
В условиях ССВР возможны два состояния: контролируемая общая реакция (компенсированная система защиты) и неконтролируемая (декомпенсированная система зашиты). При первом варианте процесс для организма в той или иной мере ещё управляем и возможно обратное развитие процесса. При втором варианте, когда система защиты организма декомпенсирована, истощена, развивается сепсис с такими проявлениями, как септический шок, органно-системная недостаточность, появление вторичных гнойных очагов (метастазов).
Для установления ССВР при сепсисе необходимы следующие перечисленные признаки: температура тела выше 38 °C, частота сердечных сокращений более 90 в минуту, частота дыхания более 20 в минуту, количество лейкоцитов более 12х109/л или сдвиг лейкоцитарной формулы влево (более 10% незрелых форм лейкоцитов).
Сепсис характеризует наличие трёх основных факторов:
1) источник (очаг) инфекции;
2) ССВР;
3) органно-системная недостаточность или наличие вторичных (метастатических) очагов инфекции.
Общая гнойная инфекция, осложняющая течение раневого процесса, развивается по типу позднего сепсиса при обширных, гнойных ранах. Генерализации инфекции способствует наличие в ране большого количества некротизированных тканей и сгустков крови, что создаёт благоприятные условия для бурного роста и развития микрофлоры. Бактериальные экзо- и эндотоксины вызывают повреждение грануляционной ткани, новообразованных сосудов, что приводит к их тромбозу, повышению проницаемости сосудистой стенки, развитию вторичных некрозов и нарушению или разрушению защитного барьера, который становится проницаемым для микрофлоры.
Схема 4. Патогенез сепсиса.
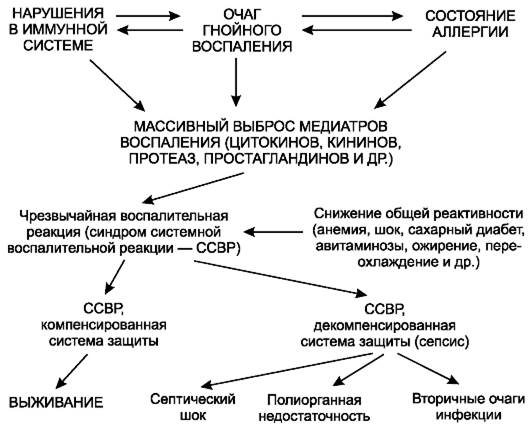
Помимо бактерий и их токсинов, большое влияние на течение общей гнойной инфекции оказывают продукты распада тканей первичного и вторичного очагов: всасываясь в кровь, они приводят к тяжёлой интоксикации. Развитие сепсиса, тяжесть его течения, прогноз и исход в значительной степени определяются эндогенной интоксикацией, которая вначале приводит к тяжёлым нарушениям функций, а затем к морфологическим изменениям органов.
Общая гнойная инфекция вызывает тяжёлые метаболические нарушения в организме, изменения белкового, углеводного, витаминного, водно-электролитного баланса, кислотно-основного состояния. Выраженные катаболические процессы приводят к гипо- и диспротеинемии, истощению гликогенных запасов печени, гипо- и авитаминозу и др.
Нарушение дезинтоксикационной функции печени и выделительной функции почек усугубляет эндогенную интоксикацию, с ростом уровня токсемии увеличивается токсическое повреждение органов. Интоксикация приводит к значительному нарушению функций кроветворных органов, развитию анемии, нарушению лейкопоэза.
Клостридиальная анаэробная инфекция. Гнилостная инфекция. Классификация газовой гангрены. Этиология и патогенез. Клиника, диагностика. Современные принципы профилактики и лечения анаэробной и гнилостной инфекции.
ЭТИОЛОГИЯ
Все бактерии – возбудители - анаэробные спороносные палочки.
Все возбудители анаэробной инфекции устойчивы к термическим и химическим факторам. Выделяют мощные экзотоксины (гемолизины, миотоксины, нейротоксины и др.) → некроз соединительной ткани и мышц. Вызывают гемолиз, тромбоз сосудов, поражение миокарда, печени, почек. Газообразование в тканях → отек.
Характер местных изменений в тканях
Острое серозно-альтеративное воспаление → мертвение тканей + общая интоксикация.
ПАТОГЕНЕЗ
Массивный некроз тканей, быстро развивающийся отек → повышение давления в фасциальных футлярах и тканях → ишемия. Тромбоз вен → ухудшение кровоснабжения. Отечная жидкость + токсины: поражение кожи (отслоение эпидермиса + образование пузырей), имбибирование клетчатки продуктами гемолиза и миолиза → голубые/бронзовые пятна. Скопление в тканях пузырьков углекислого газа и сероводорода. В кровь попадают токсины микроорганизмов и продукты распада → интоксикация, полиорганная недостаточность. В связи с интенсивной экссудацией – обезвоживание.
Местные симптомы
Боли в области раны, ощущение тесноты (нарастание отека), характерный внешний вид раны(сухой, безжизненный вид, скудное отделяемое с неприятным запахом, цианоз кожи вокруг раны, бронзовые пятна, мышцы вида «вареного мяса»), отек (Симптом Мельникова), газообразование(крепитация, симптом лезвия бритвы, симптом шпателя, симптом пробки шампанского), рентгенологический симптом Краузе, посев микрофлоры.
Общие симптомы
Слабость, жажда, наличии тошноты, рвота; бледность кожи иногда с желтушным оттенком, заострившиеся черты лица, сухой и обложенный язык.
Пульс значительно учащен, АД обычно понижается. Температура чаще субфебрильная. Быстро нарастающая анемия, высокий лейкоцитоз со сдвигом влево. Диурез снижается, в моче появляется белок и цилиндры.
Хирургическое лечение должно проводиться немедленно после постановки диагноза
§ Широкие, так называемые «лампасные» разрезы
§ Широкая некрэктомия
§ Ампутация и экзартикуляция
Общее лечение
Специфическое лечение 150 ООО МЕ поливалентной противогангренозной сыворотки (или по 50 ООО МЕ сывороток антиперфрингенс, антисептикум, антиэдематиенс).
Неспецифическая терапия складывается из следующих мероприятий: инфузии кровезаменителей и фракций крови, антибактериальная терапия, покой, коррекция жизненных показателей.
ТУБЕРКУЛЕЗ
Хроническая специфическая возвратная инфекция, наиболее часто поражающая легкие. После установления наличия инфекции, клинический туберкулез может развиться через месяцы или может не проявлять себя в течение многих месяцев, лет и даже десятилетий.
Патогенез:Стадии туберкулеза следующие: 1) первичная или начальная инфекция; 2) латентная или дремлющая инфекция; 3) рецидивирующая или туберкулез взрослых. 90-95% первичных туберкулезных инфекций не распознается, вызывая только положительный кожный туберкулиновый тест и латентную или дремлющую инфекцию. Первичный туберкулез может стать активным в любом возрасте, приводя к клиническому туберкулезу любого органа, наиболее часто – верхушечных отделов легких, но также почек, длинных костей, позвонков, лимфатических узлов и др. Часто активация процесса происходит через 1-2 года после начального инфицирования, но это может случаться и позже, через годы и десятилетия, после манифестации сахарного диабета, длительного периода стресса, после лечения кортикостероидами или другими иммунодепрессантами, а также инфицирования ВИЧ. Первичная инфекция оставляет следы в виде рубцово измененных лимфоузлов в верхушечных отделах одного или обоих легких, называемых очаги Симона, которые являются наиболее вероятными источниками последующего активного туберкулеза. Частота активации не зависит от кальцифицированных зон первичной инфекции (очагов Гона) или остаточных кальцификатов лимфоузлов в воротах легких. Предрасполагающими факторами развития активного туберкулеза считаются также субтотальная резекция желудка и силикоз легких.
Лечение:Химиотерапия чрезвычайно эффективна и обычно излечивает пациентов при условии получения полного курса. Противотуберкулезные препараты включают пять, которые обладают бактерицидным действием, и три бактериостатика.
Сибирская язва – общее острое инфекционное заболевание из группы зоонозных инфекций. Сибирская язва может протекать с образованием специфических карбункулов (язв) на коже и слизистых оболочках или с поражением легких или кишечника – кожная, легочная и кишечная форма болезни. Сибирской язве свойственно эпидемическое распространение.
Этиология. Споры сибирской язвы проникают в организм человека или животного через кожу, верхние дыхательные пути или слизистую оболочку желудочно-кишечного тракта, прорастают в вегетативную (палочковую) форму бактерий, имеющую вид палочки, окруженной капсулой.
Патогенез и патологическая анатомия. Патогенез болезни определяется общим характером инфекции (серозно-геморрагические процессы в тканях и органах, лихорадочная реакция и склонность к развитию острой септицемии), реактивностью организма (тяжесть болезни) и конкретным механизмом заражения (возможность развития кожной, легочной или кишечной формы).
Клиническая картина. Продолжительность инкубационного периода в среднем 2–3 дня с колебаниями в зависимости от механизма заражения (через кожу, дыхательные пути, желудочно-кишечный тракт) в пределах до 8 дней.
Чаще других встречается кожная форма, при которой образуется сибиреязвенный карбункул. В области входных ворот инфекция на коже первоначально появляется небольшое, сильно зудящее красное пятнышко; вскоре оно превращается в плотный узелок – папулу. По прошествии нескольких часов на вершине папулы возникает пузырек (везикула). Этот пузырек постепенно наполняется мутным содержимым, превращаясь, таким образом, в пустулу. Затем пустула лопается, и на ее месте остаются омертвевшие ткани, образующие черный струп. По виду струп напоминает уголь, что и определило латинское название болезни – Anthrax (уголь).Продолжая увеличиваться, струп западает. Вокруг него образуется несколько мелких добавочных, «дочерних», пузырьков (везикул) составляющих как бы периферический венчик, окаймляющий расположенный в центре черный некротический струп; еще далее по периферии от области центрального некроза тканей развивается массивный отек мягких тканей. Зона отека может быть очень обширной. Отечность развивается главным образом на тех участках, где имеется рыхлая подкожная клетчатка. Степень развития отека до известной степени характеризует тяжесть болезни. Характерно, что в области отека, так же как и на месте самого струпа, совершенно отсутствует болевая чувствительность при легком покалывании иголкой (стерильной!) или при ощупывании рукой, защищенной тонкой резиновой перчаткой.
В области периферического отека кожа напряжена, блестит, лоснится. Вокруг черного струпа имеется узкая желтоватая гнойная каемка, по периферии – багровый, слегка приподнятый над поверхностью валик.
Степень повышения температуры при сибирской язве значительно варьирует: возможно небольшое повышение температуры, но иногда уже ко 2-му дню болезни наблюдается повышение температуры, достигающее 40–40,5ºС. Температурная кривая малозакономерна.Уже с первых часов заболевания появляются общее недомогание, разбитость во всем теле, бессонница, головные боли. Нередко возникает тоскливое, угнетенное настроение.По мере выздоровления некротический струп отторгается с последующим замещением его молодой грануляционной тканью.
У многих больных вслед за появлением карбункула развивается регионарный лимфаденит. Кожная форма сибирской язвы может осложниться сибиреязвенным сепсисом со вторичной локализацией инфекции в эндокарде или мозговых оболочках (острый геморрагический эндокардит, геморрагический менингит). Наиболее часто сибиреязвенный карбункул локализуется на открытых частях тела, особенно на коже головы и верхних конечностей.
Диагноз. Распознавание сибирской язвы возможно на основе анализа клинических данных, свойственных той или иной форме болезни (кожной, легочной, кишечной), и эпидемиологических данных (контакт с больным животным, работа с зараженными кожами и мехом, ношение полушубков, шерстяных платков, подозрительных на зараженность их спорами сибирской язвы). Помимо строго учета клинических и эпидемиологических данных, ставя диагноз сибирской язвы, рекомендуется подтвердить его бактериологически, исследуя под микроскопом на окрашенных препаратах содержимое карбункулов, а при легочной форме – мокроту.
Лечение. Основным средством лечения больных сибирской язвой является пенициллин. Его следует назначать внутримышечно по 1000000 ЕД 4 раза в день до получения достаточно полного клинического эффекта, но в течение не менее 7–8 дней. Дополнительно применяется введение стрептомицина (по 250000 ЕД 2 раза в сутки).Противосибиреязвенную сыворотку вводят внутримышечно в дозах соответственно тяжести и форме болезни (от 50 до 200 мл/сут).
Профилактика. Основными профилактическими мероприятиями являются ветеринарный контроль за сельскохозяйственными животными, контроль на реакцию Асколи и обезвреживание в случае надобности поступающего в производство и переработку всего сырья животного происхождения (кожа, шерсть, щетина), изоляция больных людей и рациональное их лечение, специфические прививки животных живой вакциной (СТИ-1) накожно или химической вакциной (протективным антигеном).
Дифтерия – передающееся воздушно-капельным путём общее острое инфекционное заболевание, вызываемое дифтерийной палочкой, образующей сильный экзотоксин. Болезнь сопровождается выраженной интоксикацией организма с наличием фибринозного воспаления в области входных ворот инфекции. Дифтерийные бактерии неподвижны, не образуют спор, хорошо окрашиваются фуксином, а также по Граму.
Патологоанатомические изменения в области входных ворот инфекции характеризуется развитием фибринозного (дифтеритического) воспаления с образованием грязновато-белых или пепельно-серых налётов (плёнок), тесно связанных с подлежащей тканью. Эти налёты состоят из огромного количества нитей фибрина с примесью лейкоцитов слущившегося эпителия слизистой оболочки; в плёнках содержатся вирулентные дифтерийные бактерии. Вследствие тесных связей нити фибрина с подлежащими тканями плёнки с трудом могут быть отделены от этих последних при помощи ватного тампона или шпателем.
Патогенез :Продолжительность инкубационного периода при дифтерии в среднем составляет от 4 до 7 дней с возможными колебаниями от 2 до 10 дней.
Клинически дифтерия ран проявляется образованием на поверхности раны трудно снимающихся серых или серовато-жёлтых плёнок. В окружности раны отмечается отёк тканей и покраснение кожи. Течение раневого процесса медленное, вялое. Общие явления выражаются в симптомах общей интоксикации. Действию дифтерийного токсина особенно подверженно сердце, нервная система, почки. Бактериологическое исследование плёнок позволяет уточнить диагноз.
Лечение. Всех больных дифтерией госпитализируют и обязательно изолируют. Основным средством лечения больных дифтерией служит антитоксическая противодифтерийная сыворотка. При дифтерии ран рекомендуется покой, повязки с раствором антисептиков, антибиотиков, с антитоксической сывороткой. Важное знания в лечении имеет сбалансированное питание и симптоматическая терапия.
Первая помощь при ожогах.
1)Прекратить действие термического агента на кожу(вынести из огня)
2)Охладить обожжённые участки(пузырь со людом или вода, на протяжение 10-15 минут)
3)Наложить асептическую повязку(на лицо не накладывать! +предварительно срезать одежду)
4)Обезболить и начать противошоковые мероприятия (промедол, морфин, омнопон -внутривенно, кровезаменители – внутривенно – полиглюкин, реополиглюкин, желатиноль)
Пострадавших необходимо согреть! Их укутывают, дают выпить тёплый чай, обильное щелочное питьё.
Классификация травм.
Травмы непроизводственного характера:
· транспортные (авиационные, железнодорожные, автомобильные и т.д.);
· бытовые;
· спортивные;
· прочие.
Травмы производственного характера:
· промышленные;
· сельскохозяйственные.
По характеру повреждения выделяют: открытые и закрытые травмы.
Открытые – травмы, при которых имеется повреждение наружных покровов (кожа, слизистая оболочка).
Виды закрытых повреждений: ушиб, растяжение, разрыв, сотрясение, синдром длительного сдавления, вывихи переломы.
По соотношению локализации повреждения и точки действия агента: прямые и непрямые.
Поверхностные (кожные) – ушиб, рана; подкожные (разрыв связок, мышц, вывихи, переломы) и полостные (сотрясения и разрывы внутренних органов)
Проникающие в полость и непроникающие.
Одиночные, множественные.
Изолированные, сочетанные, комбинированные.
Сочетанные повреждения (политравма) – повреждение 2-х и более анатомических областей.
Комбинированные повреждения –воздействия двух и более повреждающих фактор.
Механизм травмы зависит от:
- величины внешней силы;
- точки приложения силы;
- направления действия силы;
- характера произошедших изменений
КЛИНИЧЕСКАЯ КАРТИНА:Проснувшись и придя в себя, больные отмечают значительные боли и резкое нарушение функций пострадавшей конечности. Слабость, головная боль отягощают общее состояние. Местные расстройства выражаются в бледности и похолодании больной конечности, снижении чувствительности кожи, резком ограничении функций, вялости, ослаблении или полном отсутствии пульсации артерий. Температура тела нормальная или незначительно повышена, артериальное давление не изменено. Если больной поступил через несколько часов от начала заболевания, то на конечности появляется нарастающий отек, кожа становится багровой. В правильном распознавании страдания огромную роль играет анамнез. Между тем больные неохотно сообщают о сильном опьянении, говорят о травме или о неизвестной причине. Чаще всего врачи ставят диагноз «тромбофлебит», а в отдельных запущенных случаях — «анаэробная инфекция», в связи с чем делают широкие разрезы. Нарастающий отек деревянистого характера, выраженные сосудисто-нервные расстройства усугубляются тяжелыми нарушениями функций почек. Суточное количество мочи резко уменьшается, вплоть до развития анурии.
ПРИНЦИПЫ ЛЕЧЕНИЯ:Основные лечебные мероприятия при позиционном сдавлении должны быть направлены на нормализацию функционирования сердечно-сосудистой системы и почек, показано введение анальгетиков, антигистаминных препаратов, осмодиуретиков, обязательна эндотелиотропная терапия. Для профилактики отеков конечность туго бинтуют эластичным бинтом и охлаждают. При тяжелых отеках показана фасциотомия с небольшим разрезом кожи. Вливание жидкостей контролируют по выделительной функции почек. При тяжелом течении процесса применяют гемосорбцию и гемодиализ с помощью аппарата «искусственная почка» в специализированных отделениях.
Перелом грудины
Переломы грудины возникают вследствие прямого воздействия травмирующей силы, типичны "рулевые" переломы от удара грудью о руль автомобиля.
Клиническая картина. Перелом локализуется в большей части в верхней половине грудины, причем тело ее смещается кзади, заходя под верхний отломок. Распознавание переломов грудины не представляет трудностей: в области перелома видна деформация, имеется болезненность и может определяться патологическая подвижность отломков. Решает вопрос рентгенография грудины в боковой проекции.
Диагностика. После установления диагноза перелома грудины необходимо провести запись ЭКГ, так как очень часто переломы грудины осложняются ушибами сердца.
Лечение. Репозиция отломков грудины осуществляется после введения в гематому 20 мл 1% раствора новокаина или под общим обезболиванием. Обычно она удается одномоментно при сильном оттягивании плеч с одновременным надавливанием на выступающий фрагмент. В случае неудачи или при значительном смещении верхнего отломка кзади с захождением нижнего кпереди и кверху — показано скелетное вытяжение. Для этого накладывают двое пулевых щипцов: верхние — за наружные края грудины через второе межреберье, нижние — по оси грудины (одну браншу вводят в кость по средней линии после рассечения кожи, вторую — под нижний край грудины у мечевидного отростка. Больного укладывают на дугообразные валики, грудь укрепляют через блоки на продольной раме. Если через несколько дней вправление не удается, следует прибегнуть к оперативному вмешательству, которое заключается в сшивании грудины аппаратом СГР-20 с помощью танталовых скобок, либо к фиксации отломков двумя перекрещивающимися спицами Киршнера или металлическим штифтом. Прогноз благоприятный.
Пневмоторакс. Виды пневмоторакса. Клиническая картина и диагностика пневмоторакса. Особенности оказания первой медицинской помощи при напряженном, клапанном и открытом пневмотораксе. Принципы лечения.
Пневмотораксом называется скопление воздуха в плевральной полости. Различают открытый, закрытый и клапанный пневмоторакс. Скопление воздуха в плевре, который через рану грудной стенки или через крупный бронх сообщается с атмосферным воздухом, называется открытым пневмотораксом. При закрытом пневмотораксе воздух в плевральной полости не сообщается с внешней средой.
При разрывах легкого в виде лоскута может развиться клапанный пневмоторакс, когда при вдохе воздух проникает в плевру, а при выдохе не может выйти из плевральной полости через бронх, так как лоскут легкого закрывает поврежденный бронх и не пропускает его. Таким образом, при клапанном пневмотораксе количество воздуха в плевре с каждым вдохом увеличивается и его давление повышается, поэтому он носит еще название напряженного пневмоторакса.
Симптомы и течение.
Скопление воздуха в плевре в небольшом количестве обычно не вызывает нарушений и если его дальнейшее поступление прекращается, то он рассасывается. Значительное скопление воздуха, особенно под давлением (клапанный пневмоторакс), приводит к сдавлению легкого, смещению средостения, нарушая дыхание и сердечную деятельность. Опасность открытого пневмоторакса в том, что при дыхании воздух входит и выходит из плевры, что инфицирует плевру и приводит к баллотированию средостения, раздражению нервных окончаний и уменьшению дыхательной поверхности легких. При этом проявляется выраженная одышка, цианоз, учащение пульса, ограничение дыхательных экскурсий больной стороны грудной клетки, появление подкожной эмфиземы, коробочного звука при перкуссии и ослабление дыхательных шумов. Рентгенологически выявляется скопление воздуха в плевре и ателектаз легкого. Открытый пневмоторакс осложняется шоком более, чем у 60 % больных.
Лечение.
Помощь при открытом пневмотораксе должна заключаться в наложении герметической (окклюзионной) повязки. Лечение оперативное. При клапанном пневмотораксе показана пункция грудной стенки тонким троакаром для удаления воздуха. Если одномоментное удаление воздуха из плевры неэффективно и он опять накапливается, то плевру дренируют (подводный дренаж или постоянная аспирация), при неэффективности этих методов показана операция.
Общее состояние таких больных обычно тяжелое, они нуждаются в покое, в борьбе с анемией и в восстановлении нарушенных функций жизненно важных органов.
Подкожная эмфизема при травме грудной клетки является внешним выражением закрытого повреждения легкого. Она сама не требует применения специальных лечебных мероприятий даже при сильных степенях развития. При разрыве же легкого по показаниям производится операция. Из подкожной клетчатки воздух обычно вскоре рассасывается.
Хроническое нарушение артериального кровотока (хроническая артериальная недостаточность). Стадии хронической артериальной недостаточности нижних конечностей. Клиническая картина. Диагностика. Оперативное и консервативное лечение.
Хронические нарушения артериального кровоснабжения.
Окклюзионные поражения ветвей дуги аорты. Сущность заболевания, состоит в облитерации ветвей дуги аорты, приводящей к ишемии головного мозга и верхних конечностей.
Наиболее частыми причинами поражения ветвей дуги аорты являются атеросклероз и неспецифический аортоартериит. Реже к нарушению проходимости экстракраниальных сосудов дуги аорты приводят экстравазальные компрессии: сдавление подключичной артерии между лестничными мышцами или ключицей и I ребром, добавочным шейным ребром, сдавление позвоночной артерии остеофитами при выраженном шейном остеохондрозе и др. Одной из причин нарушения проходимости брахицефальных артерий может быть их патологическая извитость. В патогенезе возникающих расстройств основная роль принадлежит большей или меньшей ишемии участков головного мозга, кровоснабжаемых пораженной артерией. При этом степень мозговой сосудистой недостаточности определяется темпом развития окклюзии, ее уровнем и состоянием коллатерального кровообращения.
Клиника и диагностика, клиническая картина слагается из признаков недостаточности кровоснабжения головного мозга, глаз и верхних конечностей. Отмечается многообразие симптомов, обусловленных общемозговыми, стволовыми и мозжечковыми нарушениями Больные часто жалуются на головные боли, головокружения, звон в ушах, ухудшение памяти, кратковременные приступы потери сознания, пошатывание при ходьбе, двоение в глазах. У них можно наблюдать заторможенность, снижение интеллекта, дизартрию, афазию, дисфонию, слабость конвергенции, птоз, нистагм, изменения координации движений, расстройства чувствительности, моно- и гемипарезы. В зависимости от степени сосудистой недостаточности мозга указанные неврологические нарушения имеют либо преходящий, либо постоянный характер. Нарушения зрения возникают при поражении как сонных, так и позвоночных артерий. Нередки жалобы больных на наличие пелены, сетки перед глазами, отмечается преходящая односторонняя слепота, птоз, миоз. Недостаточное кровоснабжение верхних конечностей проявляется их повышенной утомляемостью, слабостью, зябкостью Выраженные ишемические расстройства встречаются лишь при окклюзии дистальных сосудов руки. Пульсация дистальнее места поражения сосуда, как правило, отсутствует или ослаблена. При поражении подключичной артерии артериальное давление на соответствующей руке снижается до 80-90 мм рт. ст., над стенозированными артериями слышен систолический шум. При стенозе бифуркации и внутренней сонной артерии он отчетливо определяется у угла нижней челюсти, при сужении брахицефального ствола - в правой подключичной ямке позади грудиноключичного сочленения. В диагностике поражений ветвей дуги аорты наряду с общеклиническими методами используются и инструментальные методы исследования, позволяющие оценить пульсацию магистральных артерий, кровоснабжение головного мозга и верхних конечностей (реовазография, термография верхних конечностей, сфигмография сонных и поверхностных височных артерий, электроэнцефалография, ультразвуковая флоуметрия). Точный топический диагноз возможен лишь при рентгеноконстрастном исследовании брахицефальных сосудов – панаортографии.
Лечение ввиду высокой частоты ишемических инсультов поражения брахицефальных сосудов требуют хирургической коррекции. При сегментарных окклюзиях общей и внутренней сонных артерий, облитерации устья позвоночной артерии производят эндартериэктомию. При поражении подключичной артерии выполняют резекцию измененного сегмента с последующим протезированием или шунтирующую операцию (наложение шунта между восходящей аортой и неизмененным участком подключичной артерии в подмышечной ямке). При распространенном поражении общей сонной артерии операцией выбора является ее резекция с протезированием. При множественных поражениях ветвей дуги аорты производят одномоментную реконструкцию нескольких артерий. У больных с нарушениями проходимости сосудов, обусловленными экстравазальным сдавлением, необходимо устранить фактор компрессии. Это достигается операцией. По показаниям производят скаленотомию, резекцию I ребра, пересечение малой грудной или подключичной мышцы и др. При патологической извитости сосудов чаще производят их резекцию с последующим наложением прямого сосудистого анастомоза. Если выполнить реконструктивную операцию невозможно, целесообразны хирургические вмешательства на симпатической нервной системе-верхняя шейная или грудная симпатэктомия. После них уменьшается периферическое сопротивление и наступает улучшение кровообращения в коллатералях
Хронические нарушения висцерального кровообращения. Заболевание характеризуется ишемическими расстройствами кровообращения органов брюшной полости.
Этиология и патогенез. Наиболее частыми причинами поражения мезентериальных сосудов являются атеросклероз и неспецифический аортоартериит, реже бывают фиброзно-мышечная дисплазия, гипоплазии, аномалии развития висцеральных артерий. Нарушение их проходимости возникает и при экстравазальном сдавлении серповидной связкой, медиальной ножкой диафрагмы, уплотненной поджелудочной железой. Гипоксические состояния ведут, прежде всего, к снижению продукции пищеварительных ферментов и нарушению всасывания, нарушается функция печени и поджелудочной железы.
Клиника и диагностика: атеросклеротическое поражение мезентериальных артерий чаще наблюдается у людей среднего и пожилого возраста. Основная жалоба больных с хронической абдоминальной ишемией боли в животе, возникающие через 20-40 мин после приема пищи и продолжающиеся в течение 2-2 часов. Боли локализуются в эпигастральной области, реже в мезогастральной и левой подвздошной областях. Больные отмечают уменьшение болей при ограничении приема пищи. Дисфункция кишечника выражается во вздутии живота, неустойчивом стуле, запорах, прогрессивном похудании. При аускультации живота в эпигастральной области нередко выслушивается характерный систолический шум, обусловленный стенозом чревного ствола или верхней брыжеечной артерии.
При рентгенологическом исследовании обращают на себя внимание медленное прохождение бария по кишечнику, метеоризм, сегментарные спазмы кишечника. Аортография, произведенная в переднезадней и боковой проекциях позволяет оценить состояние устьев чревной и верхней брыжеечной артерий.
Лечение: в легких случаях больные подлежат консервативной терапии, включающей диету, спазмолитические и антисклеротические препараты, средства, улучшающие метаболизм тканей и реологические свойства крови. Оперативное лечение определяется причиной, приведшей к развитию заболевания. И может заключатся в рассечении рубцово-измененных медиальных ножек диафрагмы, серповидной связки или волокон солнечного сплетения, эндартериэктомии или резекция пораженного участка сосуда с последующим его протезированием или шунтирование.
Вазоренальная гипертензия – заболевание, развивающееся вследствие сужения почечных артерий. Встречается у 3-5% больных, страдающих артериальной гипертонией.
Среди причин, вызывающих поражение почечных артерий на первом месте по частоте стоит атеросклероз (40-65%), на втором – фиброзно-мышечная дисплазия (15-30%), на третьем – неспецифический аортоартериит (16-22%). Эти патологические процессы приводят к уменьшению пульсового давления в почках, вызывая гиперплазию юкстагломерулярных клеток. Последние в этих условиях выделяют большое количество ренина, что способствует образованию ангиотензина, обладающего мощным вазопрессорным действием. Определенное значение в развитии вазоренальной гипертензии придают и уменьшению некоторых депрессорных и вазодилататорных субстанций, которые могут вырабатываться почками (простагландины, кинины и др.).
Клиника и диагностика. больные жалуются на головные боли, ноющие боли в области сердца, головокружение, шум в ушах, ощущение приливов, тяжесть в голове, ухудшение зрения, сердцебиение. Артериальное давление резко повышено. Систолическое давление у большинства больных выше 200 мм рт. ст., а диастолическое 100 мм рт. ст. и выше. Гипертензия носит стойкий характер и практически не поддается консервативной терапии. Границы сердца расширены влево, верхушечный толчок усилен. На аорте определяется акцент II тона. У некоторых больных в проекции брюшной аорты и почечных артерий выслушивается систолический шум.
Большое значение для диагностики имеет экскреторная урография и радиоизотопная ренография. При неясном диагнозе применяют биопсию почек, определение активности ренина в периферической крови и в крови, оттекающей от почек, ангиографию сосудов почек. При поражении сосудов на ангиограмме видно характерное сужение устья и начального отдела почечной артерии.
Лечение: только хирургическое. Оперативное лечение определяется основной патологией и может быть основано на чрезаортальной эндартериэктомии, резекции пораженного участка артерии с последующей аутопластикой или протезированием, нефроэктомии.
Облитерирующий эндартериит артерий нижних конечностей. В основе заболевания лежит дистрофическое поражение артерий, преимущественно дистальных отделов нижних конечностей, приводящее к стенозу и облитерации сосудов с развитием ишемического симптомокомплекса.
Заболевание чаще наблюдается у мужчин в возрасте 20-30 лет. Соотношение мужчин и женщин при облитерирующем эндартериите составляет 99:1.
Этиология и патогенез. Развитию эндартериита способствуют длительные переохлаждения, травмы, курение, авитаминозы, эмоциональные и психические расстройства, инфекции, нарушения аутоиммунных процессов, другие факторы, вызывающие стойкий спазм сосудов.
Длительно существующий спазм артерий ведет к хронической ишемии сосудистой стенки, вследствие чего наступают гиперплазия интимы, фиброз адвентации и дегенеративные изменения собственного нервного аппарата сосудистой стенки. На фоне изменений интимы образуется тромб, происходит сужение и облитерация просвета сосуда. Резкое ослабление кровотока по артериям ухудшает кровообращение в сосудах микроциркуляторного русла, обеспечивающего тканевый обмен, снижается доставка кислорода тканям и развивается тканевая гипоксия, которая усиливается благодаря раскрытию артериоло-венулярных анастомозов. В этих условиях возрастают вязкость крови и ее коагуляционная активность, усиливается агрегация эритроцитов, повышаются адгезивно-агрегационные и снижаются дезагрегационные свойства тромбоцитов. Образуются тромбоцитарные агрегаты, которые, блокируя микроциркуляторное русло, усугубляют степень ишемии пораженной конечности. Повышается проницаемость оболочек клеток и внутриклеточных мембран. Происходит некроз гканей, накопление протеолитических ферментов. Организм сенсибилизируется к продуктам распада белков. Возникают патологические аутоиммунные процессы, усугубляющие нарушения микроциркуляции и усиливающие местную гипоксию и некроз тканей.
Различают четыре стадии облитерирующего эндартериита.
I стадия - стадия функциональной компенсации. Больные отмечают зябкость, иногда покалывание и жжение в кончиках пальцев, повышенную утомляемость, усталость. При охлаждении конечности приобретают бледную окраску становятся холодными на ощупь, возникает перемежающаяся хромота. Пульс на артериях стоп в этой стадии ослаблен или не определяется.
II стадия - стадия субкомпенсации. Интенсивность перемежающейся хромоты нарастает и при указанном темпе ходьбы она возникает уже после прохождения 200 м (Па стадия) или несколько раньше (IIб стадия).
Кожа становится сухой, шелушащейся, на подошвенной поверхности выявляется гиперкедатоз. Замедляется рост ногтей, они утолщаются, становятся ломкими, тусклыми, приобретая матовую или бурую окраску. Нарушается и рост волос на пораженной конечности, что приводит к появлению участков облысения. Пульсация на артериях стоп не определяется.
III стадия - стадия декомпенсации. Появляются боли в пораженной конечности в покое, ходьба становится возможной на расстоянии 25–50 м. Окраска кожных покровов резко меняется в зависимости от положения пораженной конечности: подъем ее сопровождается побледнением, опускание - покраснением кожи. Последняя истончается и становится легкоранимой. Незначительные травмы вследствие потертостей, ушибов, стрижки ногтей приводят к образованию трещин и поверхностных болезненных язв. Для облегчения страданий больные придают конечности вынужденное положение, опуская ее книзу. Прогрессирует атрофия мышц голени и стопы. Трудоспособность больных значительно снижена.
IV стадия - стадия деструктивных изменений. Боли становятся постоянными и невыносимыми, образуются язвы в дистальных отделах конечностей. Присоединяется отек стопы и голени. Развивающаяся гангрена пальцев и стоп чаще протекает по типу влажной. Трудоспособность больных полностью утрачена.
Облитерирующий эндартериит характеризуется длительным течением с периодами обострений и ремиссий. Обострения чаще наблюдаются в осенний и весенний периоды времени
Для диагностики облитерирующего эндартериита существенное значение имеют функциональные пробы:
- симптом плантарной ишемии Оппеля - побледнение подошвы стопы пораженной конечности, поднятой вверх.
- проба Гольдфлама. При нарушении кровообращения уже через 10-20 движений больной, находящийся в положении на спине с приподнятыми над кроватью ногами, испытывает утомление в ноге при выполнять сгибания и разгибания в голеностопных суставах.
Специальные методы исследования: реовазография, ультразвуковая флоуметрия, термография, ангиография нижних конечностей.
Основные принципы консервативного лечения облитерирующего эндартериита: 1) устранение воздействия неблагоприятных факторов (предотвращение охлаждения, запрещение курения, употребления спиртных напитков и др.); 2) устранение спазма сосудов с помощью спазмолитиков (но-шпа, галидор, вазодилан, баметан сульфат и др.) и ганглиобдокаторов (дипрофен, дикалин, гексоний); 3) снятие болей (анальгетики, внутриартериальные блокады 1% раствором новокаина, эпидуральные блокады, блокады пара-вертебральных симпатических ганглиев на уровне Lg-1, 3); 4) улучшение метаболических процессов в тканях (витамины В1, B6, В15, B12, никотиновая кислота, компламин, солкосерил, ингибиторы брадикининов -ангинин, продектин, пармидин); 5) нормализация процессов свертывания крови, адгезивной и агрегационной функции тромбоцитов, улучшение реологических свойств крови (антикоагулянты непрямого действия, при соответствующих показаниях – гепарин, реополиглюкин, курантил, трентал). Целесообразно применение гипербарической оксигенации, санаторно-курортного лечения.
При отсутствии эффекта от консервативной терапии возникают показания к операции. Наиболее эффективны – операции на симпатической нервной системе, в частности поясничная симпатэктомия, устраняющая спазм периферических артерий.
При наличии некроза или гангрены возникают показания к ампутации (некрэктомия, экзартикуляция фаланг, ампутация пальцев, ампутация стопы, или бедра).
Все больные с облитерирующим эндартериитом должны находиться под диспансерным наблюдением. Контрольные осмотры необходимо проводить через каждые 3–4 мес. Существенное влияние на течение заболевания оказывает назначение курсов профилактического лечения, которые следует проводить не реже 2 раз в год.
Облитерирующий атеросклероз (артериосклероз). Облитерирующий атеросклероз аорты и магистральных артерий нижних конечностей находится на первом месте среди других заболеваний периферических артерий. Поражает в основном мужчин старше 40 лет.
Процесс локализуется преимущественно в крупных сосудах (аорта, подвздошные артерии) или артериях среднего калибра (бедренные, подколенные). Основные изменения при атеросклерозе развиваются в интиме артерий. В окружности очагов липоидоза появляется молодая соединительная ткань, созревание которой приводит к формированию фиброзной бляшки. На бляшках оседают тромбоциты и сгустки фибрина. При обильном накоплении липидов происходит нарушение кровообращения в бляшках, некроз которых обусловливает появление атером, т. е. полостей, заполненных атероматозными массами и тканевым детритом. Атероматозные массы отторгаются в просвет сосуда. Попадая с током крови в дистальное кровеносное русло, они могут стать причиной эмболий. Одновременно в измененных тканях бляшек, в участках дегенерирующих эластических волокон откладываются соли кальция, что является конечным этапом в развитии атеросклероза и ведет к нарушению проходимости сосуда.
В течении облитерирующего атеросклероза различают те же четыре стадии, что и при облитерирующем эндартериите. В анамнезе у больных нередко имеется гипертоническая болезнь, приступы стенокардии, перенесенные инфаркты, нарушения мозгового кровообращения, сахарный диабет.
Симптомы облитерирующего атеросклероза перемежающаяся хромота, проявляющаяся болями в икроножных мышцах, которые появляются при ходьбе и исчезают после кратковременного отдыха. На поздних стадиях кожа стоп и пальцев приобретает багрово синюшную окраску. Развитие трофических расстройств ведет к выпадению волос, нарушению роста ногтей. При окклюзиях бедренно-подколенного сегмента оволосение обычно отсутствует на голени, при облитерациях аортоподвздошной области зона облысения распространяется и на дистальную треть бедра. С прогрессированием заболевания присоединяются язвенно-некротические изменения мягких тканей дистальных сегментов пораженной конечности, сопровождающиеся отеком и гиперемией стоп. Одним из проявлений окклюзий аортоподвздошного сегмента является импотенция, обусловленная нарушением кровообращения в системе внутренних подвздошных артерий Указанный симптом встречается у 50% больных. При осмотре у больных облитерирующим атеросклерозом не редко отмечается гипотрофия или атрофия мышц нижних конечностей.
Существенную информацию о характере патологического процесса дают пальпация и аускультация сосудов конечностей. Над стенозированными артериями обычно выслушивают систолический шум. Реовазография при облитерирующем атеросклерозе регистрирует снижение магистрального кровотока на нижних конечностях. Ультразвуковое исследование дает возможность определить уровень атеросклеротической окклюзии и степень кровоснабжения дистальных отделов пораженной конечности. Основным методом топической диагностики при облитерирующем атеросклерозе является ангиография. Она позволяет определить локализацию и протяженность патологического процесса, степень поражения артерий (окклюзия, стеноз), характер коллатерального кровообращения, состояние дистального кровеносного русла. К ангиографическим признакам атеросклероза относят краевые дефекты наполнения, изъеденность контуров стенок артерий с участками стеноза, наличие сегментарных или распространенных окклюзий с заполнением дистальных отделов через сеть коллатералей.
Лечение, применяют как консервативную терапию, так и хирургическое лечение. В ранних стадиях облитерирующего атеросклероза показано консервативное лечение, оно должно быть комплексным и носить патогенетический характер, принципиально не отличается от терапии, проводимой больным облитерирующим эндартериитом.
Показанием к выполнению реконструктивных операций является наличие декомпенсации кровообращения в пораженной конечности. Восстановление магистрального кровотока достигается с помощью эндартериэктомии, шунтирования и протезирования. Если, несмотря на проводимое лечение, ишемия пораженной конечности нарастает, прогрессирует гангрена - показана ампутация бедра.
Болезнь Рейно. Заболевание представляет собой ангиотрофоневроз с преимущественным поражением мелких концевых артерий и артериол. Заболевание характеризуется спазмом сосудов пальцев рук и ног. Процесс локализуется преимущественно на верхних конечностях; поражение обычно бывает двусторонним и симметричным.
Основными причинами развития болезни Рейно являются длительные переохлаждения, хроническая травматизация пальцев, нарушение функций эндокринных органов (щитовидная железа, половые железы), тяжелые эмоциональные стрессы. Пусковым механизмом в развитии заболевания служат нарушения сосудистой иннервации.
Различают три стадии болезни.
I стадия (ангиоспастическая) характеризуется выраженным повышением сосудистого тонуса. Возникают кратковременные спазмы сосудов концевых фаланг. Пальцы (чаще II и III пальцы кистей или I-II пальцы стоп) становятся мертвенно-бледными, холодными на ощупь и нечувствительными. Через несколько минут спазм сменяется расширением сосудов. Вследствие активной гиперемии наступает покраснение кожи и пальцы теплеют. Больные отмечают в них сильное жжение и резкие боли, появляется отечность в области межфаланговых суставов.
II стадия (ангиопаралитическая). Приступы побледнения ("мертвого" пальца) в этой стадии повторяются редко, кисть и пальцы приобретают синеватую окраску. При опускании рук книзу она усиливается и принимает лиловый оттенок. Отечность и пастозность пальцев становятся постоянными. Указанные стадии длятся в среднем 3-5 лет.
III стадия (трофопаралитическая). В этой стадии на пальцах появляются панариции и язвы. Происходит образование очагов некроза, захватывающих мягкие ткани 1-2 концевых фаланг, реже - всего пальца. С развитием демаркации наступает отторжение некротических участков, после чего остаются медленно заживающие язвы, рубцы от которых бледной окраски, болезненные, спаянные с костью.
Лечение: требуется комплекс консервативных лечебных мероприятий, применяемых при других облитерирующих заболеваниях сосудов. При неуспехе консервативного лечения показана грудная симпатэктомия, стеллэктомия, при некрозе фаланг пальцев – некрэктомия.
Нарушения венозного кровообращения. Острые венозные тромбозы и хроническая венозная недостаточность Общие принципы клинической и инструментальной диагностики. Профилактика осложнений. Принципы комплексного лечения.
Хроническая венозная недостаточность
В понятие «хронической венозной недостаточности (ХВН)» входят первичный варикоз, посттромбофлебитический синдром или болезнь (ПТБ), функциональная венозная недостаточность (ФВН), телеангиоэктазии, сетчатое расширение кожных вен.
I. Классификация хронической венозной недостаточности (международная – СЕАР)
Клиническая классификация
Стадия 0 отсутствие симптомов
Стадия 1 телеангиоэктазии или ретикулярные вены
Стадия 2 варикозно-расширенные вены
Стадия 3 отёк
Стадия 4 кожные изменения обусловленные заболеванием вен (пигментация, венозная экзема, липодермосклероз)
Стадия 5 кожные изменения указанные выше и зажившая язва
Стадия 6 кожные изменения указанные выше и активная язва
Унифицированная классификация варикозной болезни (В.С.Савельев,2000 г.)
Стадии:
– изолированные формы (телеангиоэктазии, сетки, изолированные флебэктазии)
– варикозное расширение поверхностных вен с клапанной недостаточностью
– клапанная недостаточность поверхностных и перфорантных вен
– клапанная недостаточность поверхностных, перфорантных и глубоких вен.
Особенности диагностики. Клинические признаки: наличие вариксов, телеангиоэктазии, инфекция, склероз кожи ,подкожной клетчатки, язвы. Пробы: кашлевого толчка (Гаккенбруха), Мейо-Прата, Пратта; пальцевое определение дефектов в фасции (выход несостоятельных перфорантных вен.
Патогенез ХВН. Предрасполагающие факторы при варикозе: дефект закладки мезенхимы, дисбаланс метаболических и рабочих миоцитов, повышение уровня фибронектина в стенках вен; производящие факторы: гравитация, гормоны, беременность, экстравазальная компрессия, повышение ЦВД, снижение онкотического давления плазмы.
При ХВН отмечается расслабление стенок вен, болезненные отёки в области лодыжек. Причина – гормональные нарушения (женщины 40 лет и выше)
При ТАЭ – клапанная недостаточность перфорантных вен, расположенных под венозными сеточками.
При ПТБ – реканализация и сморщивание клапанов глубоких и перфорантных вен, рефлюкс крови из глубокой в поверхностную венозную систему.
Патогенез трофических нарушений при ХВН – теории Хоманса (1917) – стаз крови, эритроцитов. Линтон (1940) – венозная гипертензия через перфоранты при ПТБ, теория фибринных муфт. Наиболее признанна в настоящее время теория «ловушки для лейкоцито», их миграция и активизация в поражённую конечность (лейкоцитарные тромбы – ишемия – активация лейкоцитов- образование свободных радикалов кислорода – выделение протеолитических ферментов – разрушение тканей).
Методы лечения ХВН:
Компрессионное лечение – механическое сдавливание вен, повышение протеолитической активности крови. Используются чулки, бинты, гольфы, колготки.
Медикаментозное лечение – флеботропные препараты (детралекс, гинкор-форт, вазобрал, троксевазин, доксиум; системная энзимотерапия (флобэнзим); дезагреганты (тиклид, трентал, танакан); антибиотикотерапия при инфекции; мази (троксевазиновая, лиотон гель 1000 и др.)
Склеротерапия – введение тромбовара, этоксисклерола, фибровейна при изолированных вариксах, телеангиоэктазиях, при операциях для склерооблитерации ствола подкожной вены.
Хирургическое лечение – кроссэктомия (операция Троянова –Тренделенбурга), интраоперационная склерооблитерация или венэктомия по Бэбкоку (при диаметре ствола более 10 мм), стриппинг вариксов.
II. Посттромбофлебитическая болезнь – это заболевание, связанное с затруднением венозного оттока из пораженной конечности, которое возникает после перенесенного тромбоза глубоких вен и проявляется симптомами хронической венозной недостаточности. Достаточно трудно определить момент, когда острый тромбофлебит переходит в посттромбофлебитическую болезнь. Посттромбофлебитическая болезнь – одна из самых тяжелых разновидностей венозной патологии: она составляет приблизительно 28 % от числа всех венозных заболеваний.
Классификация.
Широкое распространение в клинической практике нашла классификация, предложенная М.И.Кузиным и В.Я. Васютковым (1966). Авторы разделяют три формы посттромбофлебитической болезни:
а) отечно-болевая
б) варикозная
в) язвенная
Эта классификация не отражает уровень посттромботических изменений в магистральных венах, различные степени гемодинамических нарушений.
Те же недостатки присущи классификации Р.П. Аскерханву (1969):
а) сухая
б) отечная
в) псевдоварикозная
Более целесообразными с хирургической точки зрения представляются классификации, основанные на форме и топике поражения глубоких вен, легко выявляемых при ультразвуковом исследовании или флебографии. Таким образом, основываясь на современных взглядах флебологии классификация должна учитывать 3 основные характеристики:
I. Степень выраженности хронической венозной недостаточности:
0 - клинические проявления отсутствуют
1 - синдром «тяжелых ног», преходящий отек
2 - стойкий отек, гипер- или гипопогиентация, липодерматосклероз
3 - венозная трофическая язва (открытая или зажившая)
II. Локализацию и распространенность посттромботического поражения глубоких вен:
- берцовый сегмент
- подколенный сегмент
- бедренный сегмент
- подвздошный сегмент
- нижняя полая вена
III. Характер окончательной эволюции тромботических масс:
- окклюзия
- реканализация
- смешанная форма
По данным литературы реканализованные формы при посттромботической болезни составляют около 50%, а окклюзионные достигают 30%.
Диагностика
1. Инвазивные методы исследования.
1. Рентгенофлебография.
2. Радиофлебография.
2. Неинвазивные методы исследования.
1. Функциональные пробы. (Проба Мейо-Претта, маршевая проба Дельбе-Пертеса)
2. Ультразвуковая доплерография.
3. Ультразвуковая флебография (дуплексное ангиосканирование).
Лечение
1. Консервативное лечение.
Первым этапом лечения больного с посттромбофлебитическим синдромом является своевременное направление его ангиохирургу. Профессионально грамотная тактика терапевтического и хирургического лечения посттромботического синдрома должна основываться на данных о клинической норме заболевания, объективность которых может быть обеспечена применением доступных методов исследования с получением полных и достоверных сведений о венозной системе нижних конечностей. Это – первый принцип ведения и лечения больного, позволяющий избежать тактических ошибок.
Основой правильного режима является исключение всех факторов, усиливающих венозный застой в нижних конечностях. Чрезвычайно важным условием этого должно быть соответствующее трудоустройство больного. Работа не должна быть связана с длительным пребыванием в вертикальном положении и физической нагрузкой, ведущей к длительному повышению внутрибрюшного давления. Однако из этого не следует, что больной должен ограничить себя в ходьбе, т.к. сокращения мышц конечностей служит средством улучшающим венозный отток.
Основными способами помощи пациентам с посттромбофлебитической болезни является компрессия и медикаментозное лечение.
Положительная роль компрессии состоит не только в устранении порочного кровотока в варикозно расширенных венах, но и ликвидации застоя в них и нормализации лимфоотока в подкожной клетчатке. Устранение сброса крови в поверхностную систему приводит к повышению кровотока по глубоким венозным магистралям и мышечным венам. Исследования многих авторов показали, что скорость кровотока в глубоких венах при эластической компрессии значительно увеличивается. Производить эластическое бинтование следует утром после ночного отдыха. На ночь бинт снимают. При отеке голени конечность бинтуют до коленного сустава, при отеке всей нижней конечности – до паховой складки.
Одновременно с компрессионным лечением необходимо курсовое назначение современных высокоэффективных флеботропных препаратов. Применяемые при посттромбофлебитической болезни лекарственные препараты можно разбить на 4 группы: противовоспалительные, антиагреганты, фибринолитики, противоотечные, однако это деление весьма условное, т.к. большинство препаратов исходно состоит из нескольких действующих начал.
2. Хирургическое лечение.
Все современные хирургические методы лечения больных посттромбофлебитической болезнью нижних конечностей отвечают лишь одной общей цели – улучшить отток крови.
Г.Д. Константинова с соавторами выделяет 4 принципа хирургического вмешательства:
1. Все больные, независимо от клинической картины заболевания подлежат обследованию с помощью комбинированной рентгеноконтрастированной или ультразвуковой флебографии для уточнения состояния всей венозной системы нижних конечностей.
2. Обеспечение максимальной коррекции функции «мышечно-венозной помпы» голени.
3. Максимальной сохранение функции подкожных вен.
4. Операция должна сочетаться с консервативной терапией.
Операции у больных посттромбофлебитической болезнью.
I. Операции без реконструкции кровотока в глубоких венах:
1. Операции разобщения венозных систем.
2. Радикальные поверхностные венэктомии.
3. Локальные поверхностная венэктомия.
II. Операции с реконструкцией кровотока в глубоких венах:
1. Шунтирующие операции.
2. Операции устраняющие ретроградный кровоток.
3. Аллопластика вен.
Опухолевого процесса.
Современная клинико-морфологическая классификация предусматривает
деление больных со злокачественными новообразованиями, в зависимости от распространенности процесса на 4 стадии. В основу этой классификации положена система ТNМ, разработанная комитетом Международного противоракового союза.
Символ Т (тумор, опухоль) – описание (характеристика) первичной опухо-
ли, имеет семь вариантов.
Т0 – первичная опухоль не верифицируется, хотя имеются метастазы ее.
Т – преинвазивная карционома (carcinoma in situ) – опухоль локализуется в
пределах слоя, в котором она возникла.
Т1 – маленькая опухоль (не более 2 см в диаметре), ограниченная пределами
исходной ткани.
Т2 – небольшая опухоль (не более 4 см в диаметре), не выходящая за преде-
лы пораженного органа.
Т3 – опухоль значительных размеров (до 6 см в диаметре), прорастающая
серозные оболочки и капсулы.
Т4 – опухоль, прорастающая в окружающие ткани и органы.
ТХ – опухоль, величина и границы которой не могут быть точно определе-
ны.
Символ N (нодулюс, узел) – отражает степень поражения лимфатических
узлов, имеет пять вариантов.
NХ – недостаточно данных, чтобы определить характер поражения лимфа-
тических узлов.
N0 – признаков поражения лимфатических узлов нет.
N1 – поражение одного лимфатического узла, располагающегося от пер-
вичного очага на расстоянии до 3 см, диметр пораженного узла меньше 3 см.
N2 – поражение одного узла, диметр которого 3-6 см или нескольких лим-
фатических узлов, диметр которых меньше 3 см, но располагаются они на рас-
стоянии более 3 см от первичной опухоли.
N3 – поражение одного лимфатического узла, диметр которого 6 см или не-
скольких узлов, диметр которых 3-6 см, но располагаются они на расстоянии более 3 см от первичной опухоли.
Символ М (метастазы) – отражает наличие отдельных метастазов, вслед-
ствие гематогенной или лимфогенной диссиминации (метастазы в юкстарегио-
нарные лимфатические узлы расматриваются как отдаленные). Символ М имеет три варианта.
МХ – недостаточно данных для определения степени распространенности.
М0 – признаков отдаленного метастазирования нет.
М1 – имеются (единичные, множственные) отдаленные метастазы.
Принцип определения стадии заболевания при злокачественных новообра-
зованиях может быть сформулирован только в общей форме, поскольку для каждой локализации рака имеется индивидуальная особенность. Группировка по стадиям в зависимости от различных сочетаний указанных символов позволяет упростить и унифицировать количественное и качественное описание опухоли.
Развитие хирургии до Х I Х века.
Хирургия - раздел клинической медицины , изучающий болезни и повреждения при диагностике и лечении которых используется методы и приемы нарушающие целостность покровных тканей организма
Развитие хирургии идет по спирали.
4 периода:
Эмпирический с 6-7 тысячелетия д н э и до конца 16 века
Анатомический – конец 16-начало 19
Период великих открытий конца 19 – начала 20
Физиологический период – 20 век
Эмпирический:
Древние люди – опий конопля мох листья
Индийцы : ринопластика
Гиппократ : гной, вывих плеча, наложение шин
Цельс – признаки воспаления, лигатура на сосуд
Гален: операция при заячьей губе
Авиценна
Анатомический:
Везалий Андреас – книги по пат анатомии
Паре – зажим, поворот плода на ножке, огнестрельные – разновидность ушибленных
Мальпиги – красные кровяные тельца
2. Развитие хирургии в Х I Х -ХХ веках. Открытия хирургического обезболивания, антисептики и асептики. Становление научной хирургии на основе фундаментальных открытий естественных наук.
Достижения:
1. Асептика антисептика
2. Возникновение обезболивания .
3.группы крови и возможности переливания.
Физиологический 20 век
История асептики
Эмпирический период
-удаление инородных тел из раны
-запрет на касание раны руками
-чистота рук врача , короткие ногти , брить волосы
Долистеровская 19 века
Земмельвейс возможность развития эндометрита с септическими осложнениями вследствие занесения трупного яда при обследовании, обработка хлорной известью
Пирогов антисептики
Луи Пастер
Антисептика листера
1865 год карболовая кислота распылял в операционной Обрабатывал руки и инструментов операционного пола многослойная пропитанная повязка
Асептика
Бергман шиммельбуш
Кох высокая температура
Эсмархт текущий пар
Автоклав 1884
Анестезиология
1800 деви - веселящий газ
1818 эфир , фарадей
1844 год первая операция под наркозом , дантист удалял зуб
16 октября 1846 года дата рождения анестезиологии , удалили опухоль подчелюстной области
В 1947 хлороформный наркоз
1922 этилен ацетилен
1956 фторотан, в 1959 метоксифлюран
Внутривенным наркозом :
1902 - гедонал
1960 оксибутират натрия
Эндотрахеальный наркоз
Макинтош - управляемое дыхание
Дата: 2019-07-24, просмотров: 389.