В умовах гетерогенного масообміну при перемішуванні рідина обтікає частинки твердої фази по-різному.
Пряме обтікання відбувається, коли рідина переміщується між нерухомими частинками твердої фази. Швидкість обтікання тут залежить від швидкості руху рідини.
Гравітаційне обтікання виникає при падінні частинок твердої фази в рідині, що рухається.
Природна циркуляція відбувається за рахунок різниці густин рідини і твердої фази.
Інерційне обтікання виникає під дією сил інерції в тих випадках, коли потік або струмінь рідини змінює свій напрямок, а тверді частинки, що рухаються в цій рідині з певною швидкістю під дією інерції, не можуть змінити напрямок руху. Швидкість обтікання частинок у цьому разі буде найбільшою, а товщина дифузійного пограничного шару в частинках твердої фази — мінімальною.
У реальних умовах масообмін відбувається з кількома способами обтікання. Найбільш сприятливі умови створюються при гравітаційному та інерційному способах. Гідродинамічний режим процесу залежить не тільки від способу обтікання, але й від швидкості потоків рідини. При ламінарному русі рідини швидкість конвективної дифузії зростає тільки в напрямку руху потоків і залежить від молекулярної в'язкості. При турбулентному (вихревому) потоці масоперенесення може здійснюватися навіть у поперечному напрямку потоків, а його швидкість не залежатиме від молекулярної в'язкості. Крім того, вдаються до перемішування шару рідини в реакторі, завдяки цьому збільшується різниця концентрацій і молекулярна дифузія в рідкому середовищі замінюється на кон-вективне і турбулентне масоперенесення. Інтенсивне масоперенесення сприяє швидшому розчиненню.
ГЛАВА 2 ХАРАКТЕРИСТИКА РОЗЧИННИКІВ
ВИМОГИ ДО РОЗЧИННИКІВ
У процесі готування рідких лікарських форм завжди потрібен розчинник, який є відповідно дисперсійним середовищем. Розчинниками називають хімічні сполуки або суміші, здатні розчиняти різні речовини, тобто утворювати з ними однорідні системи — розчини, що складаються з двох або більше компонентів. Як розчинники для приготування розчинів у медичній практиці використовують: воду очищену, спирт етиловий, гліцерин, жирні олії та мінеральні масла, хлороформ, етер діетиловий. Тепер асортимент розчинників значно розширився за рахунок силіційорганічних сполук, етилен- і пропіленгліколів, поліетиленоксидів, диметилсульфоксидів та інших речовин.
До розчинників, які необхідні для приготування рідких лікарських форм, висуваються певні вимоги:
—вони мають бути стійкими при зберіганні, хімічно і фармакологічно індиферентними;
—повинні мати високу розчинювальну здатність;
—не повинні мати неприємного смаку та запаху;
—мають бути доступними за вартістю;
—не повинні бути середовищем для розвитку мікроорганізмів.
Виходячи з хімічної класифікації, усі рідкі дисперсні системи
розподіляють на неорганічні та органічні сполуки.
ВОДА ОЧИЩЕНА
Серед неорганічних сполук вона є найпоширенішим розчинником.
Вода фармакологічно індиферентна, доступна і добре розчиняє багато лікарських речовин, але водночас у ній дуже легко й швидко гідролізуються деякі речовини та розвиваються мікроорганізми.
Воду очищену можна одержати дистиляцією, іонним обміном, електролізом, зворотним осмосом. Вона має бути безбарвною, прозорою, без смаку і запаху, з рН = 5,0...7,0, не повинна містити відновлювальних речовин, нітратів, нітритів, хлоридів, сульфатів, слідів амоніаку та інших домішок.
СПИРТ ЕТИЛОВИЙ
Прозора, безбарвна, рухлива рідина з характерним запахом і пекучим смаком, кипить при температурі 78 °С. У фармацевтичному виробництві застосовують етиловий спирт С2Н5ОН, одержаний шляхом зброджування сировини, що містить крохмаль, — переважно картоплі й зерна. Зброджене сусло, яке містить 8—10 % спирту, зміцнюють простою перегонкою. Одержують спирт-сирець, що містить близько 88 % спирту. Спирт-сирець очищають від летких органічних кислот (переважно оцтової, молочної, масляної), сивушних масел (вищих спиртів одного гомологічного ряду з етиловим спиртом — пропілового, ізобутилового, ізоамілового та інших), естерів (оцтово-етилового, масляно-етилового та інших), альдегідів (оцтового альдегіду та інших) і одночасно зміцнюють до 95—96 % багатократною перегонкою — ректифікацією. Етанол іншого походження для виробництва лікарських препаратів непридатний через присутність неприпустимих домішок (спирту метилового та інших сполук).
Спирт етиловий можна віднести до неводних розчинників умовно, тому що використовується не абсолютний етанол, а водно-спиртові розчини різної концентрації.
Спирт змішується в будь-яких співвідношеннях із водою, гліцерином, ефіром, хлороформом. Він нейтральний, не окиснюється киснем повітря, має бактеріостатичну й бактерицидну дію.
До негативних властивостей спирту слід віднести його неіндиферентність, смертельна доза 96 % -вого спирту етилового — приблизно 200—300 мл. Він сприяє осадженню білків, ферментів, легкозаймистий, має високу гігроскопічність, несумісний з окисниками, а з деякими солями утворює кристалічні сполуки.
Етиловий спирт є одним із найбільш пріоритетних розчинників у виробництві фармацевтичних препаратів. На виробництво надходить 96,2—96,7 %-вий етанол, який розводять водою або слабким спиртом до необхідної концентрації.
Вміст етанолу в розчині (концентрація) виражається у відсотках за об’ємом, тобто як об’ємна частка, % (об. ч.); і у відсотках за масою, тобто як масова частка, % (мас. ч.). Якщо немає спеціального зазначення, мається на увазі об’ємна частка у відсотках (Су). Вміст етанолу в розчині у відсотках за об’ємом (Су) показує, яка кількість мілілітрів безводного етанолу міститься в 100 мл водно-спиртового розчину при 20 °С. Концентрація етанолу в розчині у відсотках за масою (Ст) показує, яка кількість грамів безводного етанолу міститься в 100 г водно-спиртового розчину. Співвідношення між відсотками за об’ємом і відсотками за масою наведені в таблиці 1 ДФ XI.
Вміст етанолу у водно-спиртових розчинах визначають скляним і металевим спиртомірами, а також за густиною — денсиметром (ареометром) або пікнометром (рис. 3). За допомогою значення густини при 20 °С визначають Су і Ст, користуючись таблицею 1 ДФ XI. За значеннями густини, які отримані при інших температурах, і показаннями скляного і металевого спиртомірів переведення в відсотки за об’ємом при 20 °С здійснюють за спеціальними таблицями видавництва стандартів.
Концентрацію етанолу визначають скляними спиртомірами класу 0,1 (ціна поділки — 0,1 %) або класу 0,5. Арбітражні визначення міцності спиртових розчинів проводять металевими або скляними спиртомірами класу 0,1. Для практичних цілей користуються спиртомірами класу 0,5 із вбудованим термометром. Комплект складається з двох або трьох спиртомірів (0—60, 60— 100 або 0—40, 40—70, 70—100 %). Скляний спиртомір при температурі 20 °С показує об’ємну частку етанолу у відсотках. Але в умовах великих фармацевтичних виробництв температура часто відхиляється від 20 °С. У цих випадках визначення проводять при фактичній температурі, а отримані значення скляного спиртоміра приводять до 20 °С за допомогою таблиці III видавництва стандартів.
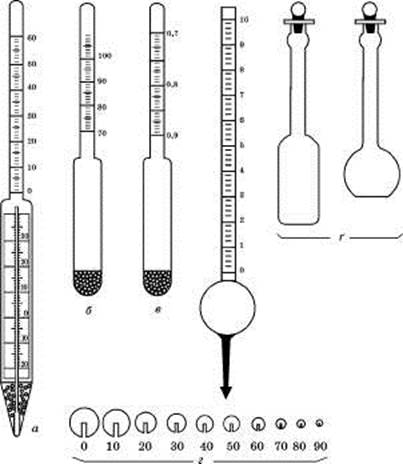
Рис. 3. Прилади для визначення концентрації етанолу
а — скляний спиртомір із вбудованим термометром; б — скляний спиртомір; в — денсиметр (ареометр); г — металевий спиртомір; Ґ — пікнометри
Точніше (із точністю 0,1 %) концентрацію спирту визначають металевим спиртоміром (рис. 3), що являє собою порожню кулю з припаяною шкалою зверху і конічним стержнем для навішення гирі знизу. На шкалі нанесені поділки від 0 до 10, кожна з яких розділена на п'ять частин. Під нульовою поділкою шкали нанесена поділка 100. До спиртоміра додаються 10 гирок у формі кульового сегмента з прорізом під номерами 0, 10, 20, 30, 40, 50, 60, 70, 80, 90. Найбільша гирка має нульовий номер, найлегша — номер 90. Показання металевого спиртоміра є умовними і складаються з показань гирки і шкали. При зануренні спиртоміра без гирки до показань шкали додають 100. Об’ємну частку етанолу Су в розчині за показаннями металевого спиртоміра визначають у відповідності з таблицею IV видавництва стандартів.
Денсиметр (ареометр) при температурі 20 °С показує густину водно-спиртового розчину, за якою знаходять концентрацію етанолу, користуючись алкоголеметричною таблицею 1 ДФ XI. Концентрацію етанолу за показниками денсиметра при температурі, що відрізняється від 20 °С, визначають за допомогою таблиці II видавництва стандартів (точність до 0,01).
Більш точні значення густини розчинів (0,001) можна одержати за допомогою пікнометра при 20 °С. За отриманими даними розраховують густину при 20 °С (з урахуванням густини повітря при нормальному барометричному тискові) і знаходять концентрацію етанолу в алкоголеметричній таблиці 1 ДФ XI.
Вміст спирту у водно-спиртовому розчині визначається також рефрактометрично і за величиною поверхневого натягу.
Розведення водно-спиртових розчинів необхідно проводити за об’ємом і за масою. При цьому зручно виходити з рівняння матеріального балансу абсолютного спирту.
Існують формули прийнятні для розрахунків розведення як у масових, так і в об’ємних відсотках. Але слід пам'ятати, що у випадках розведення об'ємів може бути використана тільки концентрація за об'ємом, при розведенні масових кількостей — тільки концентрація за масою.
При розведенні за об’ємом розраховують необхідний об’єм міцного етанолу. Визначення кількості води утруднене через явище контракції, тобто зменшення об’єму суміші води і етанолу проти їхньої арифметичної суми. Тому простіше не розраховувати необхідну кількість води, а до розрахованої кількості міцного етанолу додати воду до необхідного об’єму при температурі 20 °С. Можна також скористатися алкоголеметричними таблицями 3 і 4 ДФ XI.
Облік етанолу. На хіміко-фармацевтичних підприємствах облік здійснюють за об’ємом безводного етанолу при 20 °С, адже склади одержують етанол-ректифікат в об’ємі. У документації вказують температуру в мірнику, показання металевого спиртоміра, концентрацію етанолу (при 20 °С), множника об'ємного вмісту безводного етанолу, об’єму безводного етанолу при 20 °С.
У виробничих умовах етанол розводять переважно за масою (температура при цьому не має значення). Концентрацію етанолу за об’ємом переводять у відсотки за масою і виконують розрахунки у відповідності з формулами або правилом змішування.
Переведення об’єму одержаного етанолу-ректифікату в масу здійснюється зважуванням, а також розрахунково — через абсолютний етанол за таблицею VI, складеною з урахуванням зважування в повітрі (наказ МОЗ СРСР № 580 від 14.12.62 р.).
Зберігається спирт у спиртосховищі фармацевтичного підприємства, що має стандартні мірники, які підлягають перевірці спеціальною службою стандартизації раз на рік. На виробництво етанол відпускається в міру необхідності мірниками. При цьому облік ведуть за масою 96 % -вого (або 95 % -вого) етанолу, за об’ємом етанолу безводного або об’ємом при фактичній концентрації. У зв'язку з цим кількість отриманого і витраченого етанолу перераховують на 96 % -вий етанол або ж об’єм безводного етанолу при 20 °С.
ХЛОРОФОРМ
Безбарвна, прозора, рухлива рідина з характерним запахом і солодким смаком. Змішується у всіх співвідношеннях зі спиртом етиловим, ефіром. У хлороформі добре розчиняються лікарські речовини, нерозчинні або малорозчинні у воді. Він справляє, як і всі галагенопохідні, наркотичну й дезінфікувальну дію, належить до сильнодіючих речовин.
Хлороформ використовують здебільшого у лікарських формах для зовнішнього застосування, як правило, у комбінації з іншими розчинниками — спиртом етиловим, ефіром, жирними оліями.
ЕФІР МЕДИЧНИЙ
Хімічна назва — діетиловий етер. Безбарвна, прозора, легкозаймиста із своєрідним запахом, пекуча на смак рідина. Ефір медичний частіше називають просто ефіром. Він розчиняє багато лікарських речовин. Розчиняється в 12 частинах води, змішується в різних співвідношеннях зі спиртом етиловим, хлороформом, петролейним етером, жирними оліями та ефірними маслами. За здатністю розчиняти аналогічний хлороформові — у ньому розчиняються ті ж самі лікарські речовини і приблизно в такій же концентрації, що й у хлороформі.
Пари ефіру отруйні, вони здатні осідати, дуже рухливі і можуть накопичуватися на далекій відстані від джерела випаровування. Температура займання ефіру — 40 °С. Він, як і хлороформ, має наркотичну дію, у неводних розчинах використовується рідко, тільки в комбінації з іншими розчинниками.
ГЛІЦЕРИН
Безбарвна, схожа на сироп, прозора, гігроскопічна рідина, солодка на смак, нейтральної реакції. Розчиняється у воді, спирті та в суміші спирту й ефіру, але не розчиняється в ефірі, хлороформі та жирних оліях. Гліцеринові розчини легко змиваються водою і мають меншу адсорбцію розчинених речовин.
У фармацевтичній практиці використовують не абсолютний гліцерин, як і спирт етиловий, а розведений водою, із вмістом гліцерину 86—90 % і густиною 1,225—1,235, тобто із вмістом води 12—15 %. Це пов'язано з тим, що безводний гліцерин дуже гігроскопічний і має подразливі властивості.
ЖИРНІ ОЛІЇ
Являють собою суміші естерів гліцерину і вищих жирних кислот. Зовні це — прозорі або ледь забарвлені маслянисті рідини без запаху або зі слабким характерним запахом. У медичній практиці використовують олії, отримані тільки методом холодного пресування.
Як і всі жири, рослинні олії не змішуються з водою, малорозчинні в спирті етиловому, але легко — в ефірі та хлороформі.
Для приготування лікарських препаратів найчастіше використовують мигдалеву, персикову, маслинову, соняшникову та інші олії. Якість їх регламентована відповідними фармакопейними статтями за певними показниками: в'язкістю, числом омилення, йодним, кислотним, ефірним числами тощо.
Розчинення лікарських речовин у них, як і в гліцерині, доцільно проводити при нагріванні.
Як біологічно нешкідливі та фармакологічно індиферентні, рослинні олії мають невисоку хімічну стабільність. Наявність в їх складі ненасичених жирних кислот є причиною згіркнення. При цьому в результаті окиснення й гідролізу жирів утворюються пероксидні сполуки, альдегіди та інші продукти. Олії набувають неприємного смаку і запаху.
Світло, кисень повітря, волога та різні мікроорганізми підсилюють ці процеси.
МАСЛО ВАЗЕЛІНОВЕ
Це, власне, фракція нафти. Безбарвна, прозора, масляниста рідина без смаку і запаху, є сумішшю насичених вуглеводнів С10Н22—С15Н32. Змішується у будь-яких співвідношеннях з ефіром, хлороформом, бензином, оліями, крім рицинової, не розчиняється у воді й спирті. За розчинювальною активністю його можна порівняти з рослинними оліями.
Масло вазелінове не всмоктується шкірою і слизовими оболонками, зменшує резорбцію лікарських речовин. Вадою слід вважати те, що при нанесенні на шкіру воно значною мірою перешкоджає її газо- і теплообміну. 3 цієї причини, а також через обмежену розчинювальну здатність використовується рідше, ніж рослинні олії. Більше застосування знаходить у технології м'яких лікарських форм.
Дата: 2019-07-24, просмотров: 448.