При попадании сточных вод в природный ландшафт для них изменяются кислотно-щелочные и кислотно-восстановительные условия. В результате этого, у некоторых загрязняющих веществ, происходит резкое снижение миграционных способностей за счёт их осаждения. Процессы осаждения трудно растворимых веществ CaCO3, CaF2 , CaHPO4 описываются уравнениями:
Сa2++2F-« CaF2¯
Ca2++HPO42-«CaHPO4¯;
Ca2++CO32-« CaCO3¯;
Возможность прохождения процесса определяется насыщенностью (r) вод соединением .
При r < 1 – раствор недонасыщен соединением.
r = 1 – наблюдается равновесие между жидкой и твёрдой фазой.
r > 1 – раствор перенасыщен соединением и происходит осаждение его из раствора.
Расчет насыщенности грунтовых вод трудно растворимыми соединениями производился в следующей последовательности.
1. Определение молярных концентраций основных компонентов, содержащихся в водах:
ci = (Ci / Mi)´10-3, (4.1);
где Ci – заданная концентрация i-го компонента в мг/л; Mi – молекулярная масса i-го компонента.
2. Расчёт ионной силы раствора (I):
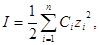 (4.2);
(4.2);
где zi – заряд i-го компонента.
3. Определение коэффициента активности (j) по закону Дебая-Гюккеля, который в упрощенном виде может быть рассчитан как:
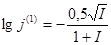 , – для одновалентных ионов (4.3);
, – для одновалентных ионов (4.3);
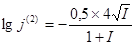 , – для двухвалентных ионов (4.4);
, – для двухвалентных ионов (4.4);
4. Определение активности (a):
ai = jici , (4.5); 5. Расчёт насыщенности (r):
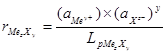 , (4.6); где
, (4.6); где 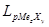 – растворимость соединения MezXy в воде.
– растворимость соединения MezXy в воде.
Для CaCO3 L=10-8.3 , CaF2 L=4*10-11 , CaHPO4 L=2.7*10-7.
Таким методом можно рассчитать насыщенность вод CaHPO4 , CaF2 и CaCO3.
Так как при значениях рН менее 8 в составе вод преобладают ионы первой стадии диссоциации угольной кислоты – HCO3-, требуется предварительный условный перерасчет активностей ионов HCO3- в активности ионов СО32-.
Диссоциация угольной кислоты происходит следующим образом:
Н2СО3 « Н+ + НСО3- « Н+ + СО32- ,
Для второй стадии диссоциации справедливо выражение:
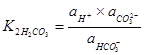 , (4.7);
, (4.7);
где 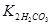 – константа второй стадии диссоциации угольной кислоты (10-10,3), а
– константа второй стадии диссоциации угольной кислоты (10-10,3), а 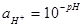 .
.
Тогда активность ионов CO3 будет определяться как:
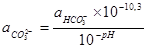 (4.8);
(4.8);
Все расчёты сведены в таблицу 8.
Таблица 8
Расчет насыщенности сточных вод трудно растворимыми соединениями
| Хвостохранилище флотации | Хвостохранилище рудопромывки | |||||||
| pH=7.5 | PH=7 | |||||||
| C , мг/л | C ,моль/л | а, моль/л | C , мг/л | C ,моль/л | а, моль/л | |||
| HCO3- | 437,4 | 7,17*10-3 | 5,6*10-3 | HCO3- | 976,5 | 15,5*10-3 | 11,93*10-3 | |
| Cl- | 575 | 16,2*10-3 | 12,6*10-3 | Cl- | 360 | 10,2*10-3 | 7,85*10-3 | |
| SO42- | 970 | 10,1*10-3 | 3,75*10-3 | SO42- | 1060 | 11,04*10-3 | 3,93*10-3 | |
| Ca 2+ | 410 | 10,3*10-3 | 3,83*10-3 | Ca 2+ | 510 | 12,75*10-3 | 4,54*10-3 | |
| Mg2+ | 250 | 10,29*10-3 | 3,83*10-3 | Mg2+ | 240 | 10*10-3 | 3,56*10-3 | |
| Na+ | 60 | 2,6*10-3 | 2,02*10-3 | Na+ | 60 | 2,61*10-3 | 2,00*10-3 | |
| F- | 8,2 | 0,43*10-3 | 0,34*10-3 | F- | 9,2 | 0,47*10-3 | 0,362*10-3 | |
| HPO42- | 10 | 0,1*10-3 | 0,037*10-3 | HPO42- | 1,5 | 0,16*10-3 | 0,057*10-3 | |
| I=0.0748 | I=0.0823 | |||||||
| J(1)=0.78 | J(2)=0.372 | J(1)=0.77 | J(2)=0.356 | |||||
| r(CaF2)=11.01 | r(CaF2)=14,87 | |||||||
| r(CaCO3)=8,82 | r(CaCO3)=7,74 | |||||||
| r(CaHPO4)=0,52 | r(CaHPO4)=0,94 | |||||||
По результатам таблицы можно сделать вывод , что СaF2 и CaCO3 осаждается в хвостохранилеще рудопромывки и флотации ( т.к. их растворы перенасыщены (r>1)) , а CaHPO4 находится в растворе в состояние недонасыщенности т.к. (r<1).
Библиографический список .
1. Комисарчик М.А. Формирование техногенных ореолов и потоков загрязнения природных вод района Егорьевского месторождения фосфоритов: Автореф. дисс. … канд. геол.-мин. наук – СПб, 1993 –22с.
2. Лукашев К.И., Лукашев В.К. Геохимия зоны гипергенезиса. – Минск: Наука и техника, 1975.
3. Мирзаев Г.Г., Иванов Б.А., Щербаков В.М. Картографический метод исследований в инженерной экологии / ЛГИ, Л., 1998.
4. Пашкевич М.А. Геохимия окружающей среды / СПГГИ., СПб., 1997.
5. Перельман А.И. Геохимия природных вод. – М.: Наука, 1982.
Дата: 2019-07-24, просмотров: 286.