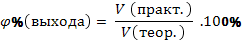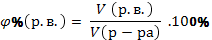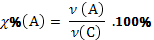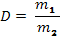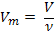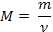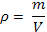Содержание
I. Общая химия
1. Основные законы химии………………………………………...……………………...3
2. Соотношения между единицами…………………..…………………………………...3
3. Основные понятия химии……………………………….……………………………...4
4. Строение атома…………………..……………………………………………………....5
5. Степень окисления элемента…….……………………………………………………...5
6. Окислители и восстановители…………………….…………………………………...6
7. Метод электронного баланса (алгоритм)………………………………………………6
8. Определение ионов………………………………...…………………………………....7
9. Изменения окраски индикаторов в зависимости от среды…………………………....8
10. Химические свойства классов неорганических веществ………………………….....9
11. Химические свойства металлов……………………………………………………….10
12. Тривиальные названия некоторых неорганических веществ……………………….11
13. Номенклатура некоторых неорганических кислот и солей………………………….12
14. Основные способы получения металлов……………………….……………………..13
15. Гидролиз веществ……………………………………………..………………………..14
II. Органическая химия
1. Общие формулы органических соединений основных классов…….......................…15
2. Алгоритм составления формул изомеров алканов……………..……………………...15
3. Алгоритм составления формул углеводородов по их названию……………………..16
4. Названия некоторых органических веществ…………………………………………...16
5. Качественные реакции органических веществ…………………..…………………..…17
6. Именные реакции в органической химии……………………………………….……..18
7. Важнейшие свойства органических веществ……………………………………….….21
Литература …………………………………………………..………………………………....22
I . Общая химия
Основные законы химии
| Закон | Формулировка |
| Закон сохранения массы | Масса веществ, вступивших в реакцию, равна массе всех продуктов реакции |
| Периодический закон | Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от заряда ядра элемента |
| Закон постоянства состава | Каждое вещество, каким бы способом оно ни было получено, всегда имеет один и тот же качественный и количественный состав |
| Закон сохранения заряда | Число электронов, отданных восстановителю, равно числу электронов, принятых окислителем. |
| Закон Авогадро | В равных объемах различных газов при одинаковых условиях (температура, и давление) содержится одинаковое число молекул |
| Следствие из закона Авогадро | 1. При одинаковых условиях равные количества различных газов занимают равные объемы. 2. При нормальных условиях (Т = 273,15 К, Р = 1,01 . 105Па или t = 00C; P = 1атм) 1 моль любого газа занимает объем, примерно равный 22,4л. |
| Объединенный газовый закон |
 ,
где Р0, V0, Т0 – значения давления, объема, температуры при н.у. ,
где Р0, V0, Т0 – значения давления, объема, температуры при н.у.
|
Соотношения между единицами
Меры массы
1 т = 103 кг 1 ц = 100 кг 1 кг = 103 г 1 г = 103 мг
Меры объема
1 м3 = 103 дм3 1 м3 = 106 см3 1 дм3 = 103 см3
1 л = 1 дм3 1 м3 = 103 л 1 л = 10-3 м3 1 л = 103см3
Меры длины
1 км = 103 м 1 м = 10 дм 1 м = 100 см
1 дм = 10 см 1 см = 10 мм
Основные понятия химии
| Понятия | Определения | |
| Массовая доля компонента А в системе С | 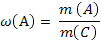 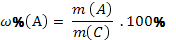
| |
| Массовая доля элемента(А) в химическом соединении (АхBy) |
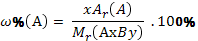
| |
| Массовая доля растворенного вещества в растворе |
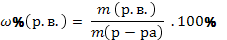
| |
| Массовая доля продукта реакции от теоретически возможного |
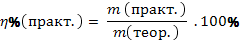
| |
| Объемная доля выхода газообразного продукта |
| |
| Объемная доля растворенного вещества в растворе |
| |
| Молярная (мольная) доля компонента |
ν (А) число молей компонента А в системе ν (С) – общее число молей всех компонентов системы | |
| Относительная плотность | Отношение массы данного объема газа к массе такого же объема другого газа | |
| Молярный объем |
| |
| Молярная масса |
| |
| Плотность |
| |
| Число структурных единиц | N = ν . NA ; NA= 6, 02. 1023 | |
Строение атома
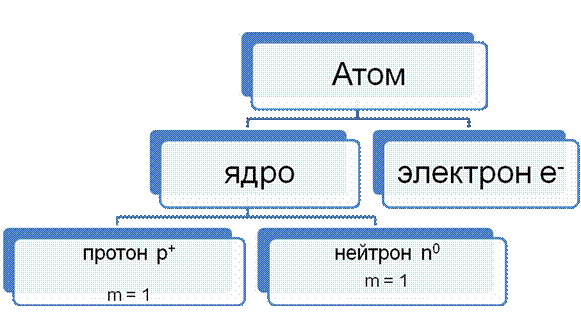
|
|
|
| ||||||||
= = =
A = N + Z A – относительная атомная масса
N – число нейтронов
Z – порядковый номер элемента (число протонов)
Изотопы – разновидности атомов одного и того же химического элемента, имеющие одинаковый заряд ядра, но разную относительную атомную массу. (3618 Ar, 3818 Ar, 4018 Ar)
Изобары – разновидности атомов, имеющие одинаковую относительную атомную массу, но разные физические и химические свойства. ( 4018 Ar, , 4020Ca).
N= 2n2 N – максимальное число электронов на энергетическом уровне.
n- номер энергетического уровня или главное квантовое число.
Степени окисления элемента
Атом0 – е- = катион+ (р+ >e-) (окисляется, восстановитель, окисление)
Атом0 + е- = анион – (p+<e-)(восстанавливается, окислитель, восстановление)
Степень окисления кислорода -2, кроме O+2F2-1, в пероксидах -1 Н2О2-1, Na2O2-1.
Металлы – положительная степень окисления.
Алгоритм определения степени окисления в соединениях
1. Определить степень окисления у наиболее электроотрицательного атома.K2SO42-
2. Определить степень окисления у наименее электроотрицательного атома. K21+SO42-
3. Определить степень окисления у остальных атомов, так чтобы сумма всех степеней окисления была равна нулю. K21+S6+O42 - ; (+1). 2 + х.1 + (-2).4 = 0; х = +6.
Окислители и восстановители
| Соединения металлов Мn+7, Mn+4, Cr+6, Pb+4 | ||
| Галогены, О2, О3 | Основные окислители | Катионы благородных металлов Au, Pt |
| Соединения неметаллов Сl+1, Cl+3, Cl+5, S+6, N+5 |
| Металлы | Соединения металлов | |
| Основные восстановители | ||
| Неметаллы | Соединения неметаллов |
1. Элемент с минимальной степенью окисления проявляет только восстановительные свойства.
2. Элемент с максимальной степенью окисления проявляет только окислительные свойства.
3. Элемент с промежуточной степенью окисления проявляет восстановительные свойства с более сильным окислителем; окислительные – с более сильным восстановителем.
7. Метод электронного баланса (Алгоритм составления ОРВ)
1. Составить схему химической реакции.
2. Определить и расставить степени окисления всех элементов в левой и правой частях составленной схемы.
3. Выделить элементы, у которых изменилась степень окисления в процессе реакции.
4. Составить схему электронного баланса, определить процессы окисления и восстановления. Найти наименьшее общее кратное для числа принятых и отданных электронов и коэффициенты при окислителе и восстановителе.
5. Расставить коэффициенты перед формулами веществ в уравнении реакции.
6. Проверить правильность составления уравнения, сверяя число атомов каждого элемента в левой и правой частях уравнения.
Определение ионов
| Определяемый ион | Ион, используемый для определения | Результаты качественной реакции |
| Ag+ | Cl- | Белый осадок |
| Cu2+ | OH- | Голубой осадок |
| Cu2+ | S2- | Черный осадок |
| Fe2+ | OH- | Зеленоватый осадок, который с течением времени буреет |
| Fe3+ | OH- | Бурый осадок |
| Zn2+ | OH- | Белый осадок, при избытке щелочи растворяется |
| Al3+ | OH- | Белый желеобразный осадок, при избытке щелочи растворяется |
| NH4+ | OH- | Запах аммиака |
| Ba2+ | SO42- | Белый осадок |
| - | Окрашивание пламени в желто-зеленый цвет | |
| Ca2+ | CO32- | Белый осадок |
| PO43- | Белый осадок | |
| - | Окрашивание пламени в кирпично-красный цвет | |
| Na+ | - | Окрашивание пламени в желтый цвет |
| K+ | - | Окрашивание пламени в фиолетовый цвет (через кобальтовое стекло) |
| Br- | Ag+ | Желтоватый осадок |
| I- | Ag+ | Желтый осадок |
| SO32- | H+ | Выделение сернистого газа с резким запахом |
| CO32- | H+ | Выделение газа без запаха, вызывающего помутнение известковой воды |
| NО3- | H2SO4(конц) + Cu | Выделение бурого газа |
| PO43- | Ag+ | Желтый осадок |
| Mg2+ | OH- | Белый осадок |
| Ni2+ | OH- | Зеленый осадок |
| Cr3+ | OH- | Изумрудно-зеленый осадок |
| Co2+ | OH- | Розово-фиолетовый осадок |
| Mn2+ | OH- | Коричневый осадок |
| Pb2+ | S2- | Черный осадок |
Гидролиз веществ
Гидролиз – реакция обменного (гидролитического) разложения веществ водой.
Гидролизу подвергаются многие вещества:
карбиды: СаС2 + 2Н2О = Са(ОН)2 + С2Н2 
нитриды: Mg3N2 + 6Н2О = 3Mg(ОН)2 + 2NH3 
фосфиды: Ca3P2 + 6Н2О = 3Ca(ОН)2 + 2PH3 
галогениды: SiCl4 + 3Н2О = H2SiO3  + 4HCl
+ 4HCl 
углеводы: сахароза + вода = глюкоза + фруктоза
сложные эфиры, в т.ч. жиры:
сложный эфир + вода  карбоновая кислота + спирт
карбоновая кислота + спирт
Гидролиз соли – процесс обменного взаимодействия ионов соли с молекулами воды
Случаи гидролиза солей
| Кислота | Основание | |
| Сильный электролит | Слабый электролит | |
| Сильная | Гидролиз не идет. Среда нейтральная. Цвет индикаторов не изменяется | Гидролиз по катиону. Среда кислая. Красная окраска лакмуса |
| Слабая | Гидролиз по аниону. Среда щелочная. Малиновая окраска фенолфталеина | Гидролиз и по катиону, и по аниону. Среда может быть различной. Окраска индикаторов в соответствии с характером среды |
Сильные кислоты: HCl, Н2SО4, HNO3, HI, HClO4, HMnO4,HBr
Слабые кислоты: HF, H3PO4, H2SiO3, H2CO3, CH3COOH, H2S, HNO2, Н2SО3, органические кислоты
II . Органическая химия
Литература
1. Горбунцова С.В. Тесты и ЕГЭ по основным разделам школьного курса химии: 10-11 классы. М., ВАКО, 2006.
2. Гузей Л.С. Новый справочник по химии. М., Большая Медведица, 2002.
3. Косова О.Ю. ЕГЭ. Химия. Челябинск, Взгляд, 2004.
4. Насонова А.Е. Химия в таблицах. М., Дрофа, 2006.
5. Сорокин В.В. Сборник задач с решениями и ответами. М., Астрель, 2001.
6. Суровцева Р.П. Химия 10-11 классы. Методическое пособие. М., Дрофа, 2001.
7. Тесты. Химия. М., Центр тестирования МО РФ, 2004.
8. Хомченко Г.П. Сборник задач по химии для поступающих в вузы. М., Новая волна, 2003.
Содержание
I. Общая химия
1. Основные законы химии………………………………………...……………………...3
2. Соотношения между единицами…………………..…………………………………...3
3. Основные понятия химии……………………………….……………………………...4
4. Строение атома…………………..……………………………………………………....5
5. Степень окисления элемента…….……………………………………………………...5
6. Окислители и восстановители…………………….…………………………………...6
7. Метод электронного баланса (алгоритм)………………………………………………6
8. Определение ионов………………………………...…………………………………....7
9. Изменения окраски индикаторов в зависимости от среды…………………………....8
10. Химические свойства классов неорганических веществ………………………….....9
11. Химические свойства металлов……………………………………………………….10
12. Тривиальные названия некоторых неорганических веществ……………………….11
13. Номенклатура некоторых неорганических кислот и солей………………………….12
14. Основные способы получения металлов……………………….……………………..13
15. Гидролиз веществ……………………………………………..………………………..14
II. Органическая химия
1. Общие формулы органических соединений основных классов…….......................…15
2. Алгоритм составления формул изомеров алканов……………..……………………...15
3. Алгоритм составления формул углеводородов по их названию……………………..16
4. Названия некоторых органических веществ…………………………………………...16
5. Качественные реакции органических веществ…………………..…………………..…17
6. Именные реакции в органической химии……………………………………….……..18
7. Важнейшие свойства органических веществ……………………………………….….21
Литература …………………………………………………..………………………………....22
I . Общая химия
Основные законы химии
| Закон | Формулировка |
| Закон сохранения массы | Масса веществ, вступивших в реакцию, равна массе всех продуктов реакции |
| Периодический закон | Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от заряда ядра элемента |
| Закон постоянства состава | Каждое вещество, каким бы способом оно ни было получено, всегда имеет один и тот же качественный и количественный состав |
| Закон сохранения заряда | Число электронов, отданных восстановителю, равно числу электронов, принятых окислителем. |
| Закон Авогадро | В равных объемах различных газов при одинаковых условиях (температура, и давление) содержится одинаковое число молекул |
| Следствие из закона Авогадро | 1. При одинаковых условиях равные количества различных газов занимают равные объемы. 2. При нормальных условиях (Т = 273,15 К, Р = 1,01 . 105Па или t = 00C; P = 1атм) 1 моль любого газа занимает объем, примерно равный 22,4л. |
| Объединенный газовый закон |
 ,
где Р0, V0, Т0 – значения давления, объема, температуры при н.у. ,
где Р0, V0, Т0 – значения давления, объема, температуры при н.у.
|
Соотношения между единицами
Меры массы
1 т = 103 кг 1 ц = 100 кг 1 кг = 103 г 1 г = 103 мг
Меры объема
1 м3 = 103 дм3 1 м3 = 106 см3 1 дм3 = 103 см3
1 л = 1 дм3 1 м3 = 103 л 1 л = 10-3 м3 1 л = 103см3
Меры длины
1 км = 103 м 1 м = 10 дм 1 м = 100 см
1 дм = 10 см 1 см = 10 мм
Основные понятия химии
| Понятия | Определения | |
| Массовая доля компонента А в системе С | 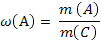 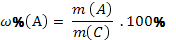
| |
| Массовая доля элемента(А) в химическом соединении (АхBy) |
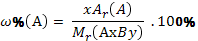
| |
| Массовая доля растворенного вещества в растворе |
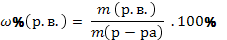
| |
| Массовая доля продукта реакции от теоретически возможного |
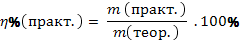
| |
| Объемная доля выхода газообразного продукта |
| |
| Объемная доля растворенного вещества в растворе |
| |
| Молярная (мольная) доля компонента |
ν (А) число молей компонента А в системе ν (С) – общее число молей всех компонентов системы | |
| Относительная плотность | Отношение массы данного объема газа к массе такого же объема другого газа | |
| Молярный объем |
| |
| Молярная масса |
| |
| Плотность |
| |
| Число структурных единиц | N = ν . NA ; NA= 6, 02. 1023 | |
Строение атома

|
|
|
| ||||||||
= = =
A = N + Z A – относительная атомная масса
N – число нейтронов
Z – порядковый номер элемента (число протонов)
Изотопы – разновидности атомов одного и того же химического элемента, имеющие одинаковый заряд ядра, но разную относительную атомную массу. (3618 Ar, 3818 Ar, 4018 Ar)
Изобары – разновидности атомов, имеющие одинаковую относительную атомную массу, но разные физические и химические свойства. ( 4018 Ar, , 4020Ca).
N= 2n2 N – максимальное число электронов на энергетическом уровне.
n- номер энергетического уровня или главное квантовое число.
Степени окисления элемента
Атом0 – е- = катион+ (р+ >e-) (окисляется, восстановитель, окисление)
Атом0 + е- = анион – (p+<e-)(восстанавливается, окислитель, восстановление)
Степень окисления кислорода -2, кроме O+2F2-1, в пероксидах -1 Н2О2-1, Na2O2-1.
Металлы – положительная степень окисления.
Алгоритм определения степени окисления в соединениях
1. Определить степень окисления у наиболее электроотрицательного атома.K2SO42-
2. Определить степень окисления у наименее электроотрицательного атома. K21+SO42-
3. Определить степень окисления у остальных атомов, так чтобы сумма всех степеней окисления была равна нулю. K21+S6+O42 - ; (+1). 2 + х.1 + (-2).4 = 0; х = +6.
Окислители и восстановители
| Соединения металлов Мn+7, Mn+4, Cr+6, Pb+4 | ||
| Галогены, О2, О3 | Основные окислители | Катионы благородных металлов Au, Pt |
| Соединения неметаллов Сl+1, Cl+3, Cl+5, S+6, N+5 |
| Металлы | Соединения металлов | |
| Основные восстановители | ||
| Неметаллы | Соединения неметаллов |
1. Элемент с минимальной степенью окисления проявляет только восстановительные свойства.
2. Элемент с максимальной степенью окисления проявляет только окислительные свойства.
3. Элемент с промежуточной степенью окисления проявляет восстановительные свойства с более сильным окислителем; окислительные – с более сильным восстановителем.
7. Метод электронного баланса (Алгоритм составления ОРВ)
1. Составить схему химической реакции.
2. Определить и расставить степени окисления всех элементов в левой и правой частях составленной схемы.
3. Выделить элементы, у которых изменилась степень окисления в процессе реакции.
4. Составить схему электронного баланса, определить процессы окисления и восстановления. Найти наименьшее общее кратное для числа принятых и отданных электронов и коэффициенты при окислителе и восстановителе.
5. Расставить коэффициенты перед формулами веществ в уравнении реакции.
6. Проверить правильность составления уравнения, сверяя число атомов каждого элемента в левой и правой частях уравнения.
Определение ионов
| Определяемый ион | Ион, используемый для определения | Результаты качественной реакции |
| Ag+ | Cl- | Белый осадок |
| Cu2+ | OH- | Голубой осадок |
| Cu2+ | S2- | Черный осадок |
| Fe2+ | OH- | Зеленоватый осадок, который с течением времени буреет |
| Fe3+ | OH- | Бурый осадок |
| Zn2+ | OH- | Белый осадок, при избытке щелочи растворяется |
| Al3+ | OH- | Белый желеобразный осадок, при избытке щелочи растворяется |
| NH4+ | OH- | Запах аммиака |
| Ba2+ | SO42- | Белый осадок |
| - | Окрашивание пламени в желто-зеленый цвет | |
| Ca2+ | CO32- | Белый осадок |
| PO43- | Белый осадок | |
| - | Окрашивание пламени в кирпично-красный цвет | |
| Na+ | - | Окрашивание пламени в желтый цвет |
| K+ | - | Окрашивание пламени в фиолетовый цвет (через кобальтовое стекло) |
| Br- | Ag+ | Желтоватый осадок |
| I- | Ag+ | Желтый осадок |
| SO32- | H+ | Выделение сернистого газа с резким запахом |
| CO32- | H+ | Выделение газа без запаха, вызывающего помутнение известковой воды |
| NО3- | H2SO4(конц) + Cu | Выделение бурого газа |
| PO43- | Ag+ | Желтый осадок |
| Mg2+ | OH- | Белый осадок |
| Ni2+ | OH- | Зеленый осадок |
| Cr3+ | OH- | Изумрудно-зеленый осадок |
| Co2+ | OH- | Розово-фиолетовый осадок |
| Mn2+ | OH- | Коричневый осадок |
| Pb2+ | S2- | Черный осадок |
Изменение окраски индикаторов в зависимости от среды
| Название индикатора | Окраска индикатора в нейтральной среде | Окраска индикатора в щелочной среде (ОН-) | Окраска индикатора в кислотной среде (Н+) |
| Лакмус | Фиолетовая | Синяя | Красная |
| Метиловый оранжевый | Оранжевая | Желтая | Красно-розовая |
| Фенолфталеин | Бесцветная | Малиновая | Бесцветная |
Дата: 2019-07-24, просмотров: 433.