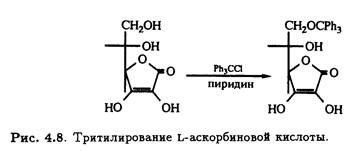
Как и у многих углеводов, первичный гидроксил при С-6 L-аскорбиновой кислоты легко подвергается трифенилметилированию (тритилированию) под действием трифенилхлорметана в пиридине (рис. 4.8).
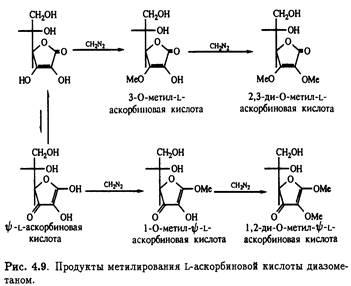
Метилирование L-аскорбиновой кислоты диазометаном проливает свет на таутомерную природу витамина. Повышенная кислотность гидроксила при С-3 позволяет оттитровать его диазометаном в эфире; при этом образуется
3-О-метиласкорбиновая кислота. Реакция сопровождается образованием небольших количеств 1-метил-ψ-L-аскорбиновой кислоты вследствие присутствия минорных количеств таутомера. Оба соединения подвергаются дальнейшему етилированию диазометаном,давая 2,3-ди-О-метил-L-аскорбиновую и 1,2-ди-O-метил- ψ-L-аскорбиновую кислоту соответственно (рис. 4.9)
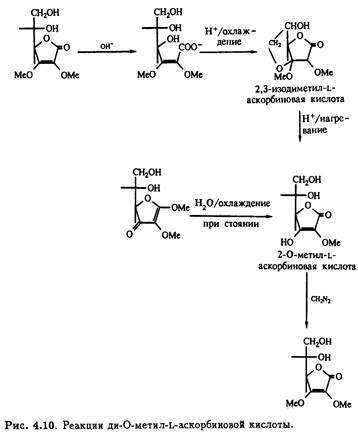
Под действием щелочи с последующим подкислением 2,3-ди-О-метильное производное претерпевает интересную цепь превращений. Образуется не простой моноциклический лактон, а бициклическое производное с единственным свободным гидроксилом — 2,3-изодиметил-L-аскорбиновая кислота. Кислотный гидролиз этого продукта приводит к 3-О-метил-L-аскорбиновой кислоте, которая также получается при стоянии на холоду водного раствора 1,2-ди- O-метил- ψ-L- аскорбиновой кислоты, что сопровождается потерей лабильного метильного остатка при С-1. Как и следовало ожидать, 3-O-метил-L-аскорбиновая кислота легко метилируется под действием диазометана в эфире, образуя 2,3-ди-О-метилированное производное. Описанные превращения суммированы на рис. .10.
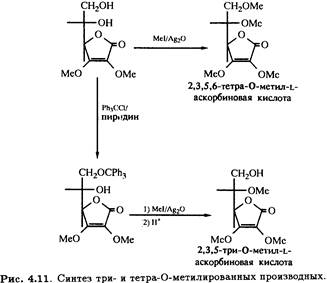
2,3-Ди-О-метил-L-аскорбиновая кислота может быть подвергнута дальнейшему метилированию иодметаном в присутствии оксида серебра с образованием 2,3,5,6-тетра-О-метилированного продукта, а также тритилированию первичной спиртовой группы при С-6. Метилирование с последующим снятием тритильной защитной группировки в кислой среде приводит к 2,3,5-три-О-метильному производному (рис. 4.11), которое, как было показано, участвует в цепи превращений, идентичных приведенным на рис. 4.10, и превращается в бициклическое 2,3,5-изотриметильное производное.
Катализируемая кислотами этерификация аскорбиновой кислоты, например ацетилирование, первоначально приводит к образованию О-6-ацильного производного, а в более жестких условиях — к 5,6-диэфиру. Кристаллический 5,6-диацетат хорошо известен; получение 2,3,4,6-тетраацетата требует еще более жестких условий.
В щелочных условиях электрофильная атака алкилирующих и ацилирующих агентов зависит от кислотности и стерической доступности гидроксильных групп при С-2, С-3, С-5 и С-6. Наиболее кислым является атом водорода гидроксила при С-3 (рКа = 4,25), но делокализация отрицательного заряда в соответствующем анионе снижает его реакционную способность и приводит к возникновению двойственной природы, которая выражается в том, что алкилироваться может не только положение О-3, но и положение С-2. В результате селективная модификация положения О-3 затруднена, и добиться ее можно только с помощью таких сильных алкилирующих и ацилирующих агентов, как диазометан и хлорангидриды.
Потеря второго протона гидроксилом при С-2 (рКа = 11,79) приводит к образованию дианиона, который селективно алкилируется и ацилируется по тому положению (рис. 4.12).
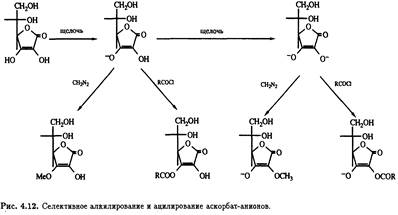
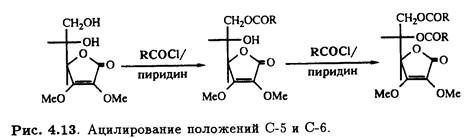
Подобный подход можно использовать при синтезе 2-О-неорганических эфиров, например 2-О-сульфата. Если защищены оба гидроксила при С-2 и С-3, то в присутствии основания модифицируется более доступная стерически первичная спиртовая группа при С-6 и последнюю очередь — при С-5 (рис. 4.13).
Образование ацеталей и кеталей
Катализируемое кислотами образование ацеталей и кеталей аскорбиновой кислоты применяется для специфической защиты одновременно двух гидроксильных групп в процессе структурной модификации. Такие 5,6-О-производные, как изопропилиденкеталь и бензилиденацеталь, хорошо известны, а недавно появилась возможность селективно защищать гидроксильные группы при
С-2 и С-3 с помощью реакционноспособных альдегидов (рис. 4.14).
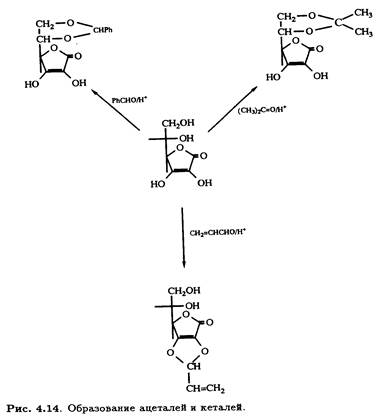
Эти новые реакции открыли путь к селективному модифицированию как первичных, так и вторичных спиртовых групп молекулы аскорбиновой кислоты.
Окисление
L-Аскорбиновая кислота является сильным восстановителем в водном растворе, однако в безводной среде это не так очевидно. Первая стадия окисления легко обратима и приводит к образованию дегидроаскорбиновой кислоты, структура и свойства которой будут рассмотрены в следующем разделе. Дегидроаскорбиновая кислота также способна быть восстановителем особенно в щелочных условиях и при окислении гипоиодит-ионом или молекулярным
кислородом распадается на L-треонин и щавелевую кислоту. Эта реакция фрагментации оказалась очень полезной при установлении структуры витамина С. Аналогичная фрагментация происходит также при обработке пероксидом водорода в щелочной среде или перманганатом калия в кислой или щелочной среде, причем кроме вышеназванных продуктов детектируется еще и ряд других.
Скорость аэробного окисления аскорбиновой кислоты зависит от рН раствора, достигал максимума при рН 5 и 11,5. Однако наиболее быстро и полно фрагментация протекает в щелочной среде. Окислительное расщепление происходит и в анаэробных условиях, хотя и медленнее.
Ультрафиолетовое, рентгеновское и гамма-излучение инициируют фотохимическое окисление аскорбиновой кислоты в водных растворах по свободнорадикальному механизму как в аэробных, так и в анаэробных условиях.
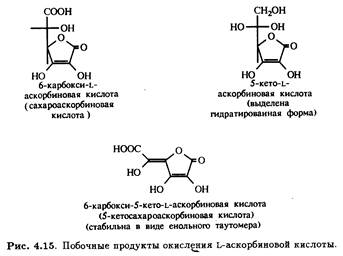
Окисление первичной и вторичной спиртовых групп аскорбиновой кислоты при С-5 и С-6 может теоретически приводить к образованию ряда побочных продуктов. Получение таких производных непосредственно из L-аскорбиновой кислоты требует селективной защиты гидроксилов при С-2 и С-3. На рис. 4.15 приведены примеры соединений такого типа, которые удалось выделить.
Дезоксисоединения
Производные L-аскорбиновой кислоты, у которых один или более гидроксилов при С-2, С-3, С-5 или С-6 замещены на атом водорода, известны как дезоксисоединения. Нестабильность витамина С подогревает интерес к его более стабильным аналогам при условии сохранения ими антискорбутного действия.
Известно, что 6-дезокси-L-аскорбиновая и L-рамноаскорбиновая кислоты (рис. 4.16) сохраняют соответственно 30 и 20% антискорбутной активности витамина С. В последние годы были синтезированы еще некоторые соединения такого типа (рис. 4.17). Обнадеживает, что 6-хлор-6-дезоксипроизводное обладает повышенной термической стабильностью по сравнению с витамином С и в то же время обладает заметной антицинготной активностью.

Биохимия витамина с
Эффективность витамина в заживлении ран и способность ускорять рост связаны с его участием в синтезе волокнистых соединительных тканей, особенно в ускорении посттрансляционного гидроксилирования остатков пролина и лизина коллагена — наиболее распространенного белка животного мира. Этот процесс, все еще далекий от того, чтобы быть полностью понятным, в ходе которого, как это ни парадоксально, восстановительные свойства аскорбиновой кислоты необходимы для окисления пролина и лизина, будет главной темой настоящего раздела. Хотя, конечно, этим роль аскорбиновой кислоты отнюдь не ограничивается. Начиная с первых лет становления биохимии витамина С, ознаменовавшихся спорами вокруг его открытия, а также вокруг роли в метаболизме аминокислот, сфера влияния этого соединения все более расширялась, охватывая различные аспекты иммунологии, онкологии, процессов пищеварения и всасывания, эндокринологии, нейрологии, детоксикации и профилактики катаракты.
Среди высших организмов лишь очень немногие не способны к биосинтезу витамина С. К ним относится и Homo sapiens, поэтому неудивительно, что большая часть из того, что известно о биохимии L-аскорбиновой кислоты, имеет отношение к млекопитающим.
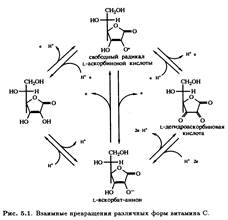
Биосинтез
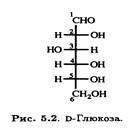
Большинство живых организмов могут превращать D-глюкозу в L-аскорбиновую кислоту. Важно ясно понимать, что это превращение происходит не через эпимеризацию, а через формальный поворот в плоскости на 180° соединения D-ряда, в результате чего образуется соединение, относящееся к L-ряду. Следует помнить, что представленное на рис. 5.2 изображение ациклической формы D-глюкозы, относится к D-ряду, так как гидроксильная группа у предпоследнего атома углерода (в данном случае С-5) расположена справа от него.
Защитив предварительно реакционноспособную альдегидную группу по С-1, можно окислить D-глюкозу поположениюС-6, получив D-глюкуроновую кислоту (рис. 5.3).
Если теперь С-1 альдегидную группу восстановить до первичного гидроксила, мы получим соединение, структура которого приведена на рис. 5.4.

Наиболее важная функциональная группировка (в данном случае карбоксильная при С-6) обычно располагается в верхней части изображения, а соответствующему атому углерода присваивается номер С-1. Следовательно, если повернуть лист бумаги на 180° или перевернуть изображение в плоскости, мы по-
получим соединение L-ряда — производное альдогексозы L-гулозы, называемое L-гулоновой кислотой (рис. 5.5). Последующие циклизация и окисление приводят к образованию L-аскорбиновой кислоты.
Считается, что все хлорофиллсодержащие растения и прорастающие семена могут синтезировать аскорбиновую кислоту согласно схеме, приведенной на рис. 5.8.
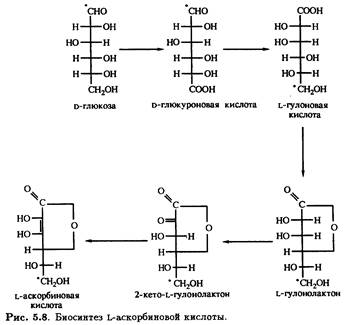
Согласно некоторым источникам, у растений более важна цепь превращений с участием D-галактуроновой кислоты, в результате которой после восстановления и замыкания лактонного кольца вместо L-гулонолактона образуется L-галактуронолактон, также превращающийся в L-аскорбиновую кислоту. Предшественником D-галактуроновой кислоты является, очевидно, D-галактоза — углевод, обнаруженный у млекопитающих и не найденный по крайней мере в значительных количествах у растений. Поэтому трудно предполагать, что этот процесс может быть важным. Тем не менее независимо от того, является ли исходным соединением D-глюкоза или D-галактоза, биосинтез L-аскорбиновой кислоты происходит через инверсию. Однако этому противоречат экспериментальные данные, свидетельствующие о том, что у некоторых растений, например у созревающей клубники, превращение D-глюкозы в L-аскорбиновую кислоту осуществляется не через инверсию. Если использовать D-глюкозу, меченную тритием (3Н) по положению С-6, в образующейся L-аскорбиновой кислоте меченым оказывается также положение С-6. Результаты генноинженерной работы, в которой была получена экспрессия гена фермента редуктазы Corynebacterium в бактериях Erwinia herbicola, демонстрируют наличие в цепи превращений еще двух промежуточных соединений — D-глюконовой и 2,5-дикетоглюконовой кислот. В этом случае нет необходимости в инверсии, чтобы объяснить, каким образом D-глюкоза трансформируется в L-аскорбиновую кислоту. Очевидно, следует предположить, что одни растения продуцируют L-гулоновую кислоту через D-глюкуроновую или D-гaлактуроновую кислоты, тогда как у других процесс протекает через образование d-глюконовой и 2,5-дикетоглюконовой кислот и не требует инверсии.
Большая часть исследований по синтезу аскорбиновой кислоты
у животных была выполнена на лабораторных крысах, и результаты подтвердили идею о полной С-1/С-6 инверсии между D-глюкуронатом и L-гулонатом. Большинство представителей земной фауны способны биосинтезировать L-аскорбиновую кислоту из d-глюкозы через промежуточные соединения — D-глюкуроновую кислоту, L-гулоновую кислоту, L-гулонолактон и 2-кето-L-гулонолактон. Исключение составляют приматы (включая и Homo sapiens) и некоторые другие млекопитающие, а также рыбы, насекомые и некоторые виды птиц. Остается лишь гадать, почему эти представители животного мира утратили способность к биосинтезу аскорбиновой кислоты. По-видимому, их далекие предки лишились генетического материала, необходимого для синтеза фермента L-гулонолактоноксидазы, что и заблокировало завершающую стадию в цепи превращений. Полагают, что эта досадная ошибка произошла 25 миллионов лет назад и именно она привела к тому, что человек делит несомненные трудности
своего положения с другими приматами, морскими свинками, индийскими крыланами, некоторыми видами птиц, включая дрозда с экзотическим голосом; рыбами и некоторыми видами насекомых, включая обитающую в пустыне саранчу, тутового шелкопряда и жуков Anthonomus. Возможно, что у всех травоядных насекомых (поедающих зеленые растения) существует потребность в поступлении витамина С с пищей. Выведение его из рациона, например, саранчи приводит к абортивной линьке и смерти. У тех представителей животного мира, которые способны самообеспечивать себя аскорбиновой кислотой, ее биосинтез осуществляется в печени (млекопитающие) или почках (птицы, рептилии, амфибии).
Дата: 2019-05-29, просмотров: 332.