
Построение математической модели ХТС
Химическая модель процесса каталитического крекинга имеет очень сложный вид. Рассмотрим наиболее простую из реакций протекающих вс процессе крекинга:
СnН2n+2 → CmH2m+2 + CpH2p,
Скорость прямой реакции выражается уравнением
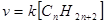
где ν – скорость прямой реакции, k - коэффициент пропорциональности (константа скорости реакции)
Принимаем, что x1 = 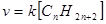 можно записать, что
можно записать, что
ν = k×x1
Принимая, что температурный коэффициент скорости данной химической реакции равен 2.7, можно записать, что
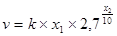
где x2 – изменение температуры химической реакции ΔТ.
Поскольку процесс синтеза происходит в газовой фазе, можно количественно оценить влияние давления в системе на скорость химического процесса. Так, при увеличении давления в системе, эквивалентного уменьшению объема системы в 2 раза (при этом во столько же раз происходит повышение концентраций реагирующих веществ), скорость прямой реакции возрастает в 2 раза. Таким образом, правомерно записать
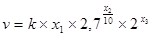
где x3 – изменение давления, соответствующее уменьшению объема системы в 2 раза.
Анализируя полученную математическую зависимость можно сделать вывод о характере влияния основных технологических параметров на скорость прямой химической реакции. При возрастании температуру и давления в реакторе скорость реакции возрастает согласно уравнению.
Изучение свойств и эффективности функционирования ХТС
На основе расходных коэффициентов и соотношения фракций готового продукта, полученных из литературных данных [1] рассчитаем материальный баланс установки каталитического крекинга.
Расходные коэффициенты для установки крекинга «КС» (на 1 т сырья):
катализатор 1,9 кг,
водяной пар (потребляемый) 270 кг,
водяной пар (вырабатываемый) 685 кг.
кокс 4–8 % .
Состав готового продукта, %:
Крекинг-газ – 10–20, примем 15
Крекинг-бензин – 30–55 примем 50
Дизельное топливо – 25–30 примем 25
Широкая фракция – 5–20 примем 20
| Приход | кг | Расход | кг |
| нефтепродукт | 1000 | Крекинг-газ | 82,5 |
| катализатор | 1,9 | Крекинг-бензин | 292,5 |
| водяной пар | 270 | Дизельное топливо | 146,5 |
| Широкая фракция | 117 | ||
| водяной пар | 685 | ||
| Итого | 1271,9 | Итого | 1324 |
Невязка баланса = │1271,9 – 1324│ / 1271,9 × 100 = 4,0 %
Невязка баланса в пределах нормы.
Заключение
В разработанном курсовом проекте приведён критический анализ различных промышленных способов производства бензина. Рассмотрены основные достоинства и недостатки существующих технологических схем производства. Из реализуемых в современном производстве вариантов выбрана наиболее оптимальная технологическая схема. Производство бензина по рассматриваемой схеме характеризуется одним из наиболее высоких выходов и при этом технология более простая по сравнению с платформингом. В выбранной схеме применяется подогрев исходного сырья теплом продуктов реакции, что повышает экономичность производства. Реализован принцип многократного прохода сырья через основной реактор синтеза, что повышает степень превращения.
В результате проведённой работы, разработана экономически эффективная, экологически безопасная и технологически приемлемая модель производства бензина при каталитическом крекинге нефтепродуктов.
Дата: 2019-05-29, просмотров: 358.