РЕФЕРАТ
На тему:
“Особенности проведения анестезиологического пособия в нейрохирургии ”
Кировоград - 2008
Введение
Для анестезиологического обеспечения нейрохирургических операций необходимо знание физиологии ЦНС. Многие анестетики оказывают значительное воздействие (как нежелательное, так и благоприятное) на метаболизм мозга, мозговой кровоток, образование и всасывание цереброспинальной жидкости, объем внутричерепного содержимого и внутричерепное давление. В настоящей главе обсуждаются важные для анестезиологической практики нейрофизиологические концепции, а также влияние анестетиков и различных вспомогательных средств на ЦНС. И хотя речь пойдет в основном о головном мозге, почти все изложенное можно отнести и к спинному мозгу.
ФИЗИОЛОГИЯ ЦНС
Метаболизм мозга
В покое мозг потребляет до 20 % получаемого организмом человека кислорода. Главный потребитель энергии в мозге — это фермент АТФ-аза, поддерживающий электрическую активность нейронов. Метаболизм в мозге обычно оценивают по потреблению кислорода мозгом, или CMRO2 (CMR — cerebral metabolic rate), которое у взрослых составляет в среднем 3-3,5 мл/100 г/мин (50 мл/мин). CMRO2 максимально в сером веществе коры больших полушарий и прямо пропорционально биоэлектрической активности коры. Потребность мозга в кислороде по сравнению с таковой у других органов чрезвычайно велика, а запасов кислорода в нем нет. Если кровь не поступает в мозг в течение 10 с, напряжение кислорода падает ниже 30 мм рт. ст. и человек теряет сознание. Если мозговой кровоток не восстанавливается в течение 3-8 мин, то запасы АТФ истощаются и возникает необратимое повреждение нейронов. Наиболее чувствительны к гипоксии нейроны гиппокампа pi мозжечка.
Нейроны обеспечиваются энергией преимущественно за счет утилизации глюкозы. В среднем по- требление глюкозы мозгом равно 5 мг/100 г/мин. В ЕЩС почти вся глюкоза (> 90 % ) подвергается аэробному распаду, поэтому потребление кислорода и потребление глюкозы изменяются параллельно. При голодании главным источником энергии для мозга становятся кетоновые тела — ацетоаце-тат и |3-гидроксибутират. Хотя мозг способен поглощать из крови молочную кислоту, ее метаболизм не играет значительной роли в энергетическом обеспечении. Не меньше чем гипоксия, опасна для мозга острая устойчивая гипогликемия. Исследования выявили парадоксальное явление: при тотальной ишемии мозга гипергликемия способствует внутриклеточному ацидозу и усугубляет повреждение нейронов. Влияние гипергликемии на очаговую ишемию не исследовано.
МОЗГОВОЙ КРОВОТОК
Мозговой кровоток (MK) зависит от интенсивности метаболизма. Мозговой кровоток чаще всего изучают с помощью изотопных методов исследований (обычно измеряют у~излучение изотопа ксенона [153Xe]). После в/в инъекции изотопа датчики, установленные по окружности головы, регистрируют темп изменения радиоактивности, который пропорционален величине MK. Новейшей методикой исследования MK является позитронная эмиссионная томография (ПЭТ); в сочетании с применением короткоживущих изотопов 11C и 15O ПЭТ позволяет измерить потребление мозгом глюкозы и кислорода соответственно. ПЭТ подтвердила полученные другими методами данные, что регионарный мозговой кровоток (рМК) изменяется прямо пропорционально интенсивности метаболизма и варьируется от 10 до 300 мл/100 г/ мин. Например, при движениях в конечности быстро возрастает рМК в соответствующем участке двигательной коры. Аналогичным образом активизация зрения приводит к увеличению рМК в зрительной коре затылочных долей мозга.
Хотя MK равен в среднем 50 мл/100 г/мин, в сером веществе головного мозга он достигает 80мл/100 г/мин, в белом веществе — 20 мл/100 г/мин. MK у взрослых в среднем составляет 750 мл/мин, что соответствует 15-20 % от сердечного выброса. При MK ниже 20-25 мл/100 г/мин возникает повреждение мозга, что на ЭЭГ проявляется замедлением ритма. MK в пределах 15-20 мл/100 г/мин сответствует изоэлектрической линии на ЭЭГ, а при уменьшении MK до 10 мл/100 г/мин наступает необратимое повреждение мозга.
Церебральное перфузионное давление (ЦПД) —
это разница между средним артериальным давлением (АДср) и ВЧД (или церебральным венозным давлением). Если церебральное венозное давление значительно превышает ВЧД, то ЦПД равно разнице между АДср и церебральным венозным давлением. В физиологических условиях ВЧД незначительно отличается от церебрального венозного давления, поэтому принято считать, что ЦПД = = АДср - ВЧД. В норме церебральное перфузионное давление составляет 100 мм рт. ст. и зависит главным образом от АДср, потому что ВЧД у здорового человека не превышает 10 мм рт. ст.
При выраженной внутричерепной гипертензии (ВЧД > 30 мм рт. ст.) ЦПД и MK могут значительно снижаться даже при нормальном АДср. ЦПД < 50 мм рт. ст. проявляется замедлением ритма на ЭЭГ, ЦПД в пределах от 25 до 40 мм рт. ст. — изолинией на ЭЭГ, а при устойчивом снижении ЦПД менее 25 мм рт. ст. возникает необратимое повреждение мозга.
Внешние факторы
Парциальное давление CO2 и O2 в крови
Парциальное давление CO2 в артериальной крови (PaCO2) — наиболее важный внешний фактор, влияющий на MK. MK прямо пропорционален PaCO2 в пределах от 20 до ЗОммрт. ст. (рис. 25-2). Увеличение PaCO2 на 1 мм рт. ст. влечет за собой мгновен ное повышение MK на 1-2 мл/100 г/мин, уменьшение PaCO2 приводит к эквивалентному снижению MK. Этот эффект опосредуется через рН цереброспинальной жидкости и вещества мозга. Поскольку CO2, в отличие от ионов, легко проникает, через гематоэнцефалический барьер, то на MK влияет именно острое изменение PaCO2, а не концентрации HCO3'. Через 24-48 ч после начала гипо- или гиперкапнии развивается компенсаторное изменение концентрации HCO3" в спинномозговой жидкости. При выраженной гипервентиляции (PaCO2 < 20 мм рт. ст.) даже у здоровых людей на ЭЭГ появляется картина, аналогичная таковой при повреждении головного мозга. Острый метаболический ацидоз не оказывает значительного влияния на MK, потому что ион водорода (H+) плохо проникает через гематоэнцефалический барьер. Что касается PaO2, то на MK оказывают воздействие только его значительные изменения. В то время как гипероксия снижает MK не более чем на 10 %, при тяжелой гипоксии (PaO2 < 50 мм рт. ст.) MK увеличивается в гораздо большей степени (рис. 25-2).
Температура тела
Изменение MK составляет 5-7 % на 1 0C. Гипотермия снижает CMRO2 и MK, в то время как гипер-термия оказывает обратный эффект. Уже при 20 0C на ЭЭГ регистрируют изолинию, но дальнейшее уменьшение температуры позволяет еще сильнее снизить потребление кислорода мозгом. При температуре выше 42 0C потребление кислорода мозгом также снижается, что, по-видимому, обусловлено повреждением нейронов.
Вязкость крови
У здоровых людей вязкость крови не оказываетзначительного влияния на MK.
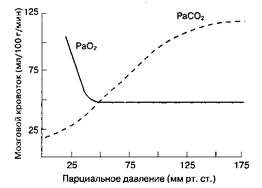
Рис. 25-2. Влияние PaO2 и PaCO2Ha мозговой кровоток
Вязкость кровив наибольшей степени зависит от гематокрита, поэтому снижение гематокрита уменьшает вязкость и увеличивает MK. К сожалению, помимо этого благоприятного эффекта, снижение гематокрита имеет и отрицательную сторону: оно уменьшает кислородную емкость крови и, соответственно, доставку кислорода. Высокий гематокрит, например при тяжелой полицитемии, увеличивает вязкость крови и снижает MK. Исследования показали, что для лучшей доставки кислорода к мозгу гематокрит должен составлять 30-34 %.
Гематоэнцефалический барьер
Между эндотелиальными клетками мозговых сосудов практически отсутствуют поры. Малочисленность пор — основная морфологическая особенность гематоэнцефалического барьера. Липидный барьер проницаем для жирорастворимых веществ, но значительно ограничивает проникновение ионизированных частиц и крупных молекул. Таким образом, проницаемость гематоэнцефалического барьера для молекулы какого-либо вещества зависит от ее размера, заряда, липо-фильности и степени связывания с белками крови. Углекислый газ, кислород и липофильные вещества (к которым относят большинство анестетиков) легко проходят через гематоэнцефалический барьер, в то время как для большинства ионов, белков и крупных молекул (например, маннитола) он практически непроницаем.
Вода свободно проникает через гематоэнцефалический барьер по механизму объемного тока, а перемещение даже небольших ионов затруднено (время полу выравнивания для натрия составляет 2-4 ч). В результате быстрые изменения концентрации электролитов плазмы (а значит, и осмолярности) вызывают преходящий осмотический градиент между плазмой и мозгом. Остро возникшая гипер-тоничность плазмы приводит к перемещению воды из вещества мозга в кровь. При острой гипотонич-ности плазмы, наоборот, происходит перемещение воды из крови в вещество мозга. Чаще всего равновесие восстанавливается без особых последствий, но в ряде случаев существует опасность быстро развивающихся массивных перемещений жидкости, чреватых повреждением мозга. Следовательно, значительные нарушения концентрации натрия или глюкозы в плазме нужно устранять медленно (см. гл. 28). Маннитол, осмотически активное вещество, которое в физиологических условиях не пересекает гематоэнцефалический барьер, вызывает устойчивое уменьшение содержания воды в мозге и часто используется для уменьшения объема мозга.
Целостность гематоэнцефалического барьера нарушают тяжелая артериальная гипертензия, опухоли мозга, ЧМТ, инсульт, инфекции, выраженная гиперкапния, гипоксия, устойчивая судорожная активность. При этих состояниях перемещение жидкости через гематоэнцефалический барьер определяется не осмотическим градиентом, а гидростатическими силами.
Цереброспинальная жидкость
Цереброспинальная жидкость находится в желудочках и цистернах головного мозга, а также в суб-арахноидальном пространстве ЦНС. Главная функция цереброспинальной жидкости — защита мозга от травмы.
Большая часть цереброспинальной жидкости вырабатывается в сосудистых сплетениях желудочков мозга (преимущественно в боковых). Некоторое количество образуется непосредственно в клетках эпендимы желудочков, а совсем небольшая часть — из жидкости, просачивающейся через периваскулярное пространство сосудов мозга (утечка через гематоэнцефалический барьер). У взрослых образуется 500 мл цереброспинальной жидкости в сутки (21 мл/ч), в то время как объем цереброспинальной жидкости составляет только 150 мл. Из боковых желудочков цереброспинальная жидкость через межжелудочковые отверстия (отверстия Монро) проникает в третий желудочек, откуда через водопровод мозга (сильвиев водопровод) попадает в четвертый желудочек. Из четвертого желудочка через срединную апертуру (отверстие Мажанди) и боковые апертуры (отверстия Люшка) цереброспинальная жидкость поступает в мозжечково-мозговую (большую) цистерну (рис. 25-3), а оттуда — в субарахноидальное пространство головного и спинного мозга, где и цир кулирует до тех пор, пока не всасывается в грануляциях паутинной оболочки больших полушарий. Для образования цереброспинальной жидкости необходима активная секреция натрия в сосудистых сплетениях. Цереброспинальная жидкость изото-нична плазме, несмотря на более низкую концентрацию калия, бикарбоната и глюкозы. Белок поступает в цереброспинальную жидкость только из перивас-кулярных пространств, поэтому его концентрация очень невелика. Ингибиторы карбоангидразы (аце-тазоламид), кортикостероиды, спиронолактон, фу-росемид, изофлюран и вазоконстрикторы уменьшают выработку цереброспинальной жидкости.
Цереброспинальная жидкость всасывается в грануляциях паутинной оболочки, откуда попадает в венозные синусы. Небольшое количество всасывается через лимфатические сосуды мозговых оболочек и периневральные муфты. Обнаружено, что всасывание прямо пропорционально ВЧД и обратно пропорционально церебральному венозному давлению; механизм этого явления неясен. Поскольку в головном и спинном мозге нет лимфатических сосудов, всасывание цереброспинальной жидкости — основной путь возвращения белка из интерстициальных и периваскулярных пространств мозга обратно в кровь.
Внутричерепное давление
Череп представляет собой жесткий футляр с нерастягивающимися стенками. Объем полости черепа неизменен, его занимает вещество мозга (80 %), кровь (12 %) и цереброспинальная жидкость (8 %). Увеличение объема одного компонента влечет за собой равное по величине уменьшение остальных, так что ВЧД не повышается. ВЧД измеряют с помощью датчиков, установленных в боковом желудочке или на поверхности полушарий головного мозга; в норме его величина не превышает 10 мм рт. ст. Давление цереброспинальной жидкости, измеренное при люмбальной пункции в положении больного лежа на боку, достаточно точно соответствует величине ВЧД, полученной с помощью внутричерепных датчиков.
Растяжимость внутричерепной системы определяют, измеряя прирост ВЧД при увеличении внутричерепного объема. Вначале увеличение внутричерепного объема хорошо компенсируется (рис. 25-4), но после достижения определенной точки ВЧД резко возрастает. Основные компенсаторные механизмы включают: (1) смещение цереброспинальной жидкости из полости черепа в субарахноидальное пространство спинного мозга; (2) увеличение всасывания цереброспинальной жидкости; (3) уменьшение образования цереброспинальной жидкости; (4) уменьшение внутричерепного объема крови (главным образом за счет венозной).
Податливость внутричерепной системы неодинакова в разных участках мозга, на нее влияют АД и PaCO2. При повышении АД механизмы ауторе-гуляции вызывают вазоконстрикцию сосудов мозга и снижение внутричерепного объема крови. Артериальная гипотония, наоборот, приводит к ва-зодилатации сосудов мозга и увеличению внутричерепного объема крови. Таким образом, благодаря ауторегуляции просвета сосудов MK не изменяется при колебаниях АД. При повышении PaCO2 на 1 мм рт. ст. внутричерепной объем крови увеличивается на 0,04 мл/100 г.
Концепцию растяжимости внутричерепной системы широко используют в клинической практике. Растяжимость измеряют при введении стерильного физиологического раствора во внутрижелудоч-ковый катетер. Если после инъекций 1 мл раствора ВЧД увеличивается более чем на 4 мм рт. ст., то растяжимость считают значительно сниженной. Снижение растяжимости свидельствует об истощении механизмов компенсации и служит прогностическим фактором уменьшения MK при дальнейшем прогрессировании внутричерепной гипертензии. Устойчивое повышение ВЧД может вызвать катастрофическую дислокацию и вклинение различных участков мозга. Выделяют следующие виды повреждений (рис. 25-5): (1) ущемление поясной извилины серпом мозга; (2) ущемление крючка наметом мозжечка; (3) сдавленна продолговатого мозга при вклинении миндалин мозжечка в большое затылочное отверстие; (4) выпячивание вещества мозга через дефект черепа.
Ингаляционные анестетики
Внутричерепное давление
Суммарный эффект ингаляционных анестетиков на ВЧД складывается из быстрого изменения внутричерепного объема крови, отсроченного влияния на образование и всасывание цереброспинальной жидкости и изменения PaCO2. Исходя из этого, изо-флюран — наиболее подходящий ингаляционный анестетик при сниженной растяжимости внутричерепной системы. Исследования на животных показали, что десфлюран увеличивает ВЧД сильнее всех остальных ингаляционных анестетиков.
Судорожная активность
В дозах 1,5-2 МАК энфлюран может вызывать эпилептоидную активность на ЭЭГ (комплексы спайк-волна), особенно на фоне гипокапнии. Слуховые стимулы провоцируют возникновение эпи-лептоидной активности. Хотя при ингаляции изо-флюрана непосредственно перед возникновением изоэлектрической линии на ЭЭГ появляются спайки, это никогда не трансформируется в развернутую эпилептоидную активность (судороги).
Закись азота
Закись азота влияет на ЦНС умеренно, ее эффекты легко устраняются с помощью других средств или гипервентиляции. Так, при сочетании с неингаляционными анестетиками закись азота практически не влияет на MK, метаболизм мозга и ВЧД. Сочетание закиси азота с ингаляционными анестетиками приводит к увеличению MK. При изолированном применении закись азота вызывает незначительную вазодилатацию мозговых сосудов и увеличение ВЧД.
Неингаляционные анестетики
Для индукции анестезии
Все неингаляционные анестетики, кроме кетамина, снижают метаболизм мозга и MK или не влияют на эти параметры. За некоторым исключением, сохраняется сопряжение между метаболизмом мозга и MK. Неингаляционные анестетики не нарушают ауторегуляцию мозгового кровообращения и реакцию сосудов мозга на PaCO2.
Барбитураты
Барбитураты вызывают утрату сознания, снижают метаболизм мозга, уменьшают MK (вследствие повышения сопротивления сосудов мозга) и оказывают противосудорожное действие. Благодаря этим свойствам барбитураты, особенно тиопентал, стали препаратами выбора для индукции анестезии в нейрохирургии.
Барбитураты вызывают дозозависимое угнетение метаболизма мозга и MK вплоть до появления изолинии на ЭЭГ. Этот уровень соответствует снижению метаболических потребностей мозга на 50 %, и дальнейшее увеличение дозы барбитуратов не сопровождается дополнительным угнетением метаболизма. В отличие от изофлюрана барбитураты снижают метаболизм равномерно во всех участках мозга. Метаболизм мозга снижается в большей степени, чем MK, так что доставка кислорода и глюкозы превышает потребность в них (при условии, что ЦПД достаточно высоко). Барбитураты вызывают вазоконстрикцию только в хорошо снабжаемых кровью участках мозга, поскольку в очагах ишемии сосуды максимально расширены и находятся в состоянии вазомоторного паралича (т. е. не реагируют на вазоконстрик-торные стимулы). Этим эффектом обусловлено увеличение регионарного MK в участках ишемии (феномен Робин Гуда, или обратного обкрадывания).
Барбитураты стимулируют всасывание цереброспинальной жидкости, что в сочетании с уменьшением MK и внутричерепного объема крови вызывает значительное снижение ВЧД. Противосудорожное действие барбитуратов благоприятно у нейрохирургических больных с высоким риском припадков. При судорожных припадках возрастают метаболические потребности мозга, что приводит к вторичному повреждению в очагах ишемии. Малые дозы метогекситала провоцируют судорожную активность у больных с эпилепсией, но высокие дозы оказывают такое же противосудорожное воздействие, как другие барбитураты.
Барбитураты также блокируют натриевые каналы, устраняют или снижают образование свободных радикалов, уменьшают поступление кальция в клетку и препятствует возникновению отека мозга после ишемического повреждения. Эти эффекты представляют собой теоретическое обоснование для использования барбитуратов с целью защиты мозга. Исследования показали, что барбитураты предотвращают повреждение нейронов при очаговой, но не при тотальной ишемии головного мозга.
Опиоиды
Опиоиды, как правило, весьма умеренно влияют на метаболические потребности мозга, MK и ВЧД, за исключением ситуаций при депрессии дыхания. В ряде случаев при опухолях мозга после применения суфентанила (и в меньшей степени — аль-фентанила) увеличивалось ВЧД. Эти анестетики снижают АД, возникает компенсаторная вазодила-тация мозговых сосудов, увеличивается внутричерепной объем крови и, следовательно, ВЧД. Хотя фентанил реже приводит к выраженной артериальной гипотонии, он тоже способен нарушить мозговое кровообращение. Морфин из-за низкой липофильности медленно проникает в ЦНС и значительно удлиняет пробуждение, поэтому его не рекомендуется использовать в нейроанестезиоло-гии. Меперидин вызывает депрессию кровообращения, а его метаболит нормеперидин оказывает неблагоприятное влияние на ЦНС, что ограничивает использование препарата.
Этомидат
Этомидат снижает метаболические потребности мозга, MK и ВЧД практически в такой же степени, что и тиопентал. Метаболизм в коре мозга снижается в большей степени. Слабое влияние этомидата на ствол мозга обусловливает более высокую гемо-динамическую стабильность (особенно у больных с нарушениями кровообращения), чем при использовании барбитуратов. Этомидат снижает образование и увеличивает всасывание цереброспинальной жидкости. К сожалению, этомидат угнетает деятельность надпочечников, что ограничивает его использование (гл. 8).
При индукции анестезии этомидатом часто возникает миоклонус, который у больных без эпилепсии в анамнезе не сопровождается эпилептоидной активностью на ЭЭГ. Хотя этомидат назначают для устранения припадков, низкие дозы препарата у больных с эпилепсией могут провоцировать судорожную активность. По этому при сопутствующей эпилепсии этомидат противопоказан.
Пропофол
Пропофол, аналогично барбитуратам и этомидату, снижает MK, метаболические потребности мозга и ВЧД, однако снижение MK может быть выражено в гораздо большей степени, нежели уменьшение метаболических потребностей мозга (нарушение сопряжения). Хотя использование пропофола иногда сопровождается миоклоническими и хореепо-добными движениями, анестетик обладает сильными противосудорожными свойствами. Короткий период полусуществования в фазе элиминации (гл. 8) делает пропофол особенно полезным в ней-роанестезиологии. Пропофол может вызвать выраженную депрессию кровообращения и артериальную гипотонию, особенно у пожилых и тяжелобольных пациентов, что сопряжено с риском значительного снижения ЦПД.
Бензодиазепины
Бензодиазепины также снижают MK и метаболические потребности мозга, но в меньшей степени, чем барбитураты, этомидат и пропофол. Бензодиа зепины обладают противосудорожным эффектом. Мидазолам — это бензодиазепин выбора в анестезиологии, поскольку его действие наиболее кратковременно. Индукция анестезии мидазоламом может значительно снизить ЦПД у пожилых и тяжелобольных; в ряде случаев мидазолам заметно замедляет пробуждение.
Кетамин
Кетамин — единственный неингаляционный анестетик, который вызывает вазодилатацию сосудов мозга и увеличивает MK (на 50-60 %). Избирательная активация ряда систем мозга (лимбичес-кой pi ретикулярной) частично компенсирует угнетение других (соматосенсорной и слуховой), так что в целом метаболические потребности мозга не изменяются. Кетамин может вызвать эпилептоид-ную активность в таламической и лимбической областях. Кетамин замедляет всасывание цереброспинальной жидкости, не влияя на ее образование. Повышение MK, внутричерепного объема крови, объема цереброспинальной жидкости может значительно увеличить ВЧД при сниженной растяжимости внутричерепной системы.
Вспомогательные средства
При в/в введении лидокаин уменьшает метаболические потребности мозга, MK и ВЧД, но в меньшей степени, чем неингаляционные анестетики. Главное преимущество лидокаина — снижение MK (в результате вазоконстрикции сосудов мозга) без влияния на системное кровообращение. Токсичность и риск возникновения судорог ограничивают введение повторных доз лидокаина (при в/в введении лидокаин действует кратковременно).
Дроперидол практически не влияет на метаболические потребности мозга и умеренно снижает MK. В сочетании с опиоидами (методика нейролептанальгезии) дроперидол может значительно замедлить пробуждение и восстановление сознания. Налоксон и флумазенил, устраняя действие опиоидов и бензодиазепинов соответственно, ликвидируют также их благоприятное влияние на метаболические потребности мозга и MK. При введении налоксона (но не флумазени-ла) может развиться тяжелая артериальная гипертония.
З. Вазопрессоры
При ненарушенном гематоэнцефалическом барьере и сохраненной ауторегуляции мозгового кровообращения вазопрессоры способны увеличить MK, только если АДср выше 150- 160ммрт. ст. или ниже
50-60 мм pm. cm. Если механизмы ауторегуляции повреждены, то вазопрессоры увеличивают ЦПД и MK. Метаболические потребности мозга возрастают параллельно MK. (3-Адреномиметики стимулируют центральные |3гадренорецепторы, что увеличивает метаболические потребности мозга и MK; повышение проницаемости гематоэнцефалическо-го барьера усиливает эффект р-адреномиметиков. (3-Адреномиметики не оказывают прямого влияния на метаболизм мозга и MK. Ct2-Адреномиметики вызывают вазоконстрикцию сосудов мозга. Чрезмерное увеличение АД при использовании любого вазопрессора нарушает целостность гематоэнцефа-лического барьера.
Вазодилататоры
В отсутствие артериальной гипотонии большинство вазодилататоров вызывает дозозависимое расширение сосудов головного мозга и увеличение MK. Когда вазодилататоры снижают АД, то MK не уменьшается или даже немного повышается, что приводит к увеличению внутричерепного объема крови. При сниженной растяжимости внутричерепной системы вазодилататоры могут значительно увеличить ВЧД. Триметафан — единственный из этой группы препаратов, практически не влияющий на MK и внутричерепной объем крови.
Миорелаксанты
Миорелаксанты действуют на ЦНС опосредованно. Они вызывают расширение сосудов мозга (вследствие высвобождения гистамина) и повышают АД, что приводит к увеличению ВЧД. С другой стороны, миорелаксанты могут вызвать артериальную гипотонию (вследствие высвобождения гистамина и блокады вегетативных ганглиев), что уменьшает ЦПД. Сукцинилхолин, активируя мышечные веретена, возбуждает ЦНС, что приводит к увеличению ВЧД. Адекватная доза тиопентала, гипервентиляция и дефасциркулирующая доза деполяризующего миорелаксанта (особенно метоку-рина) существенно уменьшают выраженность подъема ВЧД при применении сукцинилхолина. Тубокурарин, атракурий, метокурин и мивакурий высвобождают гистамин. При введении больших доз панкурония развивается артериальная гипертония, при использовании тубокурарина может наступить блокада вегетативных ганглиев.
В большинстве случаев повышение ВЧД при введении миорелаксантов обусловлено недостаточной глубиной анестезии во время ларингоскопии и интубации трахеи. При длительном апноэ возникают гиперкапния и гипоксия, которые также приводят к значительному подъему ВЧД.
ЗАЩИТА МОЗГА ОТ ИШЕМИИ
Патофизиология ишемии мозга
Из-за высокой потребности в кислороде и глюкозе мозг чрезвычайно чувствителен к ишемии. Нарушение перфузии мозга, гипогликемия и гипоксия быстро вызывают повреждение нейронов; снижение перфузии, помимо того, приводит к накоплению токсических продуктов обмена. Если PaO2, MK и уровень глюкозы в крови не нормализуются в течение 3-8 мин, то запасы АТФ истощаются и наступает необратимое повреждение мозга. Внутриклеточная концентрация K+ снижается, Na+-повышается (см. также гл. 19). Особенно важно увеличение внутриклеточной концентрации Ca2+, которое осуществляется в результате следующих процессов: (1) АТФ-зависимая помпа из-за недостатка кислорода и глюкозы не способна перемещать ионы кальция из цитозоля наружу или во внутриклеточные цистерны; (2) внутриклеточная концентрация Na+увеличивается (гл. 19); (3) происходит выброс возбуждающего нейротрансмитте-ра глутамата (гл. 18).
Устойчивое увеличение внутриклеточной концентрации Ca2+ активирует липазы и протеазы, что влечет за собой структурное повреждение нейронов. Повышение концентрации свободных жирных кислот наряду с высокой активностью цикло-оксигеназы и липоксигеназы приводит к образованию простагландинов и лейкотриенов — мощных медиаторов клеточного повреждения. Накопление токсичных продуктов обмена, таких как молочная кислота, вызывает дальнейшее повреждение нейронов и затрудняет регенерацию. Наконец, при ре-перфузии в участках ишемии происходит дополнительное повреждение тканей за счет образования свободных радикалов.
Стратегии защиты мозга
Выделяют очаговую (неполную) и тотальную (полную) ишемию мозга. Правда, такое разделение несколько искусственно, потому что главное значение имеет тяжесть ишемии, а не механизм ее развития, однако эта классификация полезна с клинической точки зрения. Тотальная ишемия мозга возникает при остановке кровообращения (из-за болезни сердечно-сосудистой системы или во время кардиохирургических операций с искусственным кровообращением, гл. 21) и при тяжелой гипоксии (при дыхательной недостаточности, утоплении, асфиксии, анестезиологических осложнениях). К очаговой ишемии мозга приводят инсульт (ишемический и геморрагический) и травма мозга (закрытая ЧМТ, проникающая ЧМТ и хирургическая травма).
В некоторых случаях удается нормализовать функцию системы кровообращения, внешнее дыхание и кислородную емкость крови, восстановить просвет сосуда при окклюзии; эти мероприятия помогают возобновить перфузию и окигенацию мозга. Вокруг очага ишемии с необратимыми структурными нарушениями, в зоне пограничного кровотока (< 15 мл/ 100 г/мин), существует жизнеспособная область функционального повреждения. При быстрой нормализации перфузии функция нейронов в этой зоне может быстро восстановиться, поэтому ее называют "ишемическая пенум-бра" ("пенумбра" в переводе с греч. означает "полутень" — Прим. перев.).
С практической точки зрения меры по профилактике и лечению тотальной и очаговой ишемии мозга фактически не различаются. В обоих случаях необходимо увеличить ЦПД, снизить метаболические потребности мозга, блокировать действие медиаторов повреждения нейронов. Стратегией выбора является профилактика, потому что при состоявшейся ишемии защита мозга менее эффективна.
Гипотермия
Гипотермия — наиболее эффективный метод зашиты мозга от тотальной или очаговой ишемии. Глубокая гипотермия при полной остановке кровообращения в течение 1 ч во время кардиохирур-гических операций позволяет избежать повреждения ЦНС (гл. 21). В отличие от анестетиков гипотермия не только подавляет биоэлектрическую активность мозга, но и уменьшает базальные метаболические потребности мозга; иными словами, даже после появления изолинии на ЭЭГ метаболические потребности мозга продолжают снижаться. Умеренная гипотермия (до 33-35 0C) также защищает мозг от ишемии и, в отличие от глубокой, сопровождается меньшим числом побочных эффектов (гл. 6).
Анестетики
Барбитураты, этомидат, пропофол и изофлюран угнетают биоэлектрическую активность мозга вплоть до появления изолинии на ЭЭГ, но, к сожалению, не влияют на базальные метаболические потребности мозга. Все вышеперечисленные анестетики, за исключением барбитуратов, подавляют метаболизм в различных отделах мозга неравномерно. Барбитураты, кроме того, увеличивают регионарный MK в участках ишемии, блокируют натриевые каналы, уменьшают отек мозга и поступление кальция в нейроны, устраняют puipi снижают образование свободных радикалов.
Исследования на животных и людях показали, что барбитураты защищают мозг при очаговой, но не при тотальной ишемии. Хотя в ряде опытов на животных продемонстрировано, что этомрадат, пропофол и, возможно, изофлюран позволяют предупредрпъ ишемию, результаты исследований носят противоречивый характер, а клинический опыт использования этих препаратов ограничен. Кетамин, теоретически, может предотвратить неблагоприятное воздействие на мозг глутамата, блокируя его связыванр!е с NMDA-рецепторами (NMDA — это N-метил-В-аспартат; гл. 18), однако данные, полученные после применения этого препарата на животных, также весьма спорны.
Ни один анестетик не способен защитить мозг от тотальной ишемии.
Антиишемические средства
Антагонисты кальция нимодипин и никардипин уменьшают неврологическое повреждение при геморрагическом и ишемическом инсультах. Оба препарата расширяют сосуды головного мозга; к сожалению, в некоторых исследованиях зарегистрировано увеличение MK, но не улучшение неврологического исхода. Назначение метилпреднизо-лона не позднее чем через 8 ч после травмы спинного мозга уменьшает неврологический дефр!-цит. Новый неглюкокортргкоидный стероид тири-лазад улучшает неврологаческий исход после субарахонорщального кровоизлияния. Акадезин, модулятор аденозина, снижает риск развития ршсульта после коронарного шунтированрш. Благоприятное влияние могут оказывать и другие препараты: магнрш, дексмедетомидин (а2-адреноб-локатор, параллельно воздействующий HaNMDA-рецепторы), декстрометорфан (неконкурентный блокатор NMDA-рецепторов), NBQX (блокатор АМРА-рецепторов; AMPA — а-амино-3-гидрокси-5-метил-4-изоксазолепропионовая кислота) и витамин E (антиоксидант).
Общие мероприятия
Наибольшее значение имеет поддержание достаточно высокого ЦПД. АД должно быть нормальным или немного увеличенным; нельзя допускать затруднения венозного оттока от мозга и повыше ния ВЧД. Оптимальная кислородная емкость крови достигается при гематокрите 30-34 % и нормальном PaO2. Гипергликемия усиливает повреждение нейронов при очаговой и тотальной ишемии мозга; и хотя эта зависимость может быть вторичным феноменом, следует тем не менее избегать чрезмерной гипергликемии (> 250 мг/100 мл, или > 13,75 ммоль/л). Необходимо поддерживать нормальное PaCO2, потому что при ишемии головного мозга и гипо-, и гиперкапния чреваты осложнениями: при гипокапнии возникает вазоконстрикция мозговых сосудов, усугубляющая ишемию, а гиперкапния вызывает феномен обкрадывания мозгового кровообращения (в случае очаговой ишемии) и способствует внутриклеточному ацидозу.
Анестезия при операциях по поводу обьемных образований головного мозга.
Вне зависимости от причины клиническая картина обусловлена темпом роста и локализацией объемного образования, а также величиной ВЧД. При медленном росте симптомы могут долго отсутствовать, при быстром — характерно острое начало заболевания. Симптомы включают головную боль, судорожные припадки, нарушение высших мозговых функций (например, когнитивной), очаговую неврологическую симптоматику. Образования супратенториальной локализации проявляются судорожными припадками, гемиплегией или афазией, а расположенные инфратенториально — поражением мозжечка (атаксия, нистагм, дизартрия) или сдавлением ствола мозга (парезы черепных нервов, нарушения сознания, расстройства дыхания). При повышении ВЧД к данной клинической картине присоединяются явные признаки внутричерепной гипертензии.
Предоперационный период
В ходе предоперационной подготовки необходимо верифицировать или исключить внутричерепную гипертензию. Для этого используют компьютерную томографию и магнитно-резонансную томо
РЕФЕРАТ
На тему:
“Особенности проведения анестезиологического пособия в нейрохирургии ”
Кировоград - 2008
Введение
Для анестезиологического обеспечения нейрохирургических операций необходимо знание физиологии ЦНС. Многие анестетики оказывают значительное воздействие (как нежелательное, так и благоприятное) на метаболизм мозга, мозговой кровоток, образование и всасывание цереброспинальной жидкости, объем внутричерепного содержимого и внутричерепное давление. В настоящей главе обсуждаются важные для анестезиологической практики нейрофизиологические концепции, а также влияние анестетиков и различных вспомогательных средств на ЦНС. И хотя речь пойдет в основном о головном мозге, почти все изложенное можно отнести и к спинному мозгу.
ФИЗИОЛОГИЯ ЦНС
Метаболизм мозга
В покое мозг потребляет до 20 % получаемого организмом человека кислорода. Главный потребитель энергии в мозге — это фермент АТФ-аза, поддерживающий электрическую активность нейронов. Метаболизм в мозге обычно оценивают по потреблению кислорода мозгом, или CMRO2 (CMR — cerebral metabolic rate), которое у взрослых составляет в среднем 3-3,5 мл/100 г/мин (50 мл/мин). CMRO2 максимально в сером веществе коры больших полушарий и прямо пропорционально биоэлектрической активности коры. Потребность мозга в кислороде по сравнению с таковой у других органов чрезвычайно велика, а запасов кислорода в нем нет. Если кровь не поступает в мозг в течение 10 с, напряжение кислорода падает ниже 30 мм рт. ст. и человек теряет сознание. Если мозговой кровоток не восстанавливается в течение 3-8 мин, то запасы АТФ истощаются и возникает необратимое повреждение нейронов. Наиболее чувствительны к гипоксии нейроны гиппокампа pi мозжечка.
Нейроны обеспечиваются энергией преимущественно за счет утилизации глюкозы. В среднем по- требление глюкозы мозгом равно 5 мг/100 г/мин. В ЕЩС почти вся глюкоза (> 90 % ) подвергается аэробному распаду, поэтому потребление кислорода и потребление глюкозы изменяются параллельно. При голодании главным источником энергии для мозга становятся кетоновые тела — ацетоаце-тат и |3-гидроксибутират. Хотя мозг способен поглощать из крови молочную кислоту, ее метаболизм не играет значительной роли в энергетическом обеспечении. Не меньше чем гипоксия, опасна для мозга острая устойчивая гипогликемия. Исследования выявили парадоксальное явление: при тотальной ишемии мозга гипергликемия способствует внутриклеточному ацидозу и усугубляет повреждение нейронов. Влияние гипергликемии на очаговую ишемию не исследовано.
МОЗГОВОЙ КРОВОТОК
Мозговой кровоток (MK) зависит от интенсивности метаболизма. Мозговой кровоток чаще всего изучают с помощью изотопных методов исследований (обычно измеряют у~излучение изотопа ксенона [153Xe]). После в/в инъекции изотопа датчики, установленные по окружности головы, регистрируют темп изменения радиоактивности, который пропорционален величине MK. Новейшей методикой исследования MK является позитронная эмиссионная томография (ПЭТ); в сочетании с применением короткоживущих изотопов 11C и 15O ПЭТ позволяет измерить потребление мозгом глюкозы и кислорода соответственно. ПЭТ подтвердила полученные другими методами данные, что регионарный мозговой кровоток (рМК) изменяется прямо пропорционально интенсивности метаболизма и варьируется от 10 до 300 мл/100 г/ мин. Например, при движениях в конечности быстро возрастает рМК в соответствующем участке двигательной коры. Аналогичным образом активизация зрения приводит к увеличению рМК в зрительной коре затылочных долей мозга.
Хотя MK равен в среднем 50 мл/100 г/мин, в сером веществе головного мозга он достигает 80мл/100 г/мин, в белом веществе — 20 мл/100 г/мин. MK у взрослых в среднем составляет 750 мл/мин, что соответствует 15-20 % от сердечного выброса. При MK ниже 20-25 мл/100 г/мин возникает повреждение мозга, что на ЭЭГ проявляется замедлением ритма. MK в пределах 15-20 мл/100 г/мин сответствует изоэлектрической линии на ЭЭГ, а при уменьшении MK до 10 мл/100 г/мин наступает необратимое повреждение мозга.
РЕГУЛЯЦИЯ МОЗГОВОГО КРОВООБРАЩЕНИЯ
Дата: 2019-05-29, просмотров: 277.