 Поведение реального газа отличается от поведения идеального газа. Так, радиус молекул большинства газов порядка 10-10м (1Ǻ), следовательно, объем молекул порядка 4×10-30 м3. В 1 м3 газа при нормальных условиях содержится 2,7×1025молекул. Таким образом, собственный объем молекул в 1 м3при нормальных условиях будет порядка 1,2×10-4 м3, т.е. около 0,0001 от объема, занятого газом.
Поведение реального газа отличается от поведения идеального газа. Так, радиус молекул большинства газов порядка 10-10м (1Ǻ), следовательно, объем молекул порядка 4×10-30 м3. В 1 м3 газа при нормальных условиях содержится 2,7×1025молекул. Таким образом, собственный объем молекул в 1 м3при нормальных условиях будет порядка 1,2×10-4 м3, т.е. около 0,0001 от объема, занятого газом.
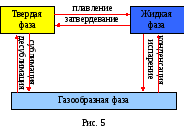
Любое вещество в зависимости от параметров состояния может находиться в различных агрегатных состояниях:твердом, жидком, газообразном, плазменном.
Нидерландский физик Ван-дер-Ваальс ввел две поправки в уравнение Менделеева-Клапейрона:
 1. Учет собственного объема молекулы
1. Учет собственного объема молекулы 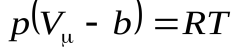
Объем одной молекулы: 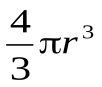 ;
;
Недоступный объем пары молекул (в расчете на одну молекулу):
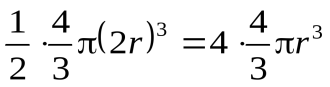 -учетверенный объем молекулы.
-учетверенный объем молекулы.
Недоступный объем на все NAмолекул одного киломоля:
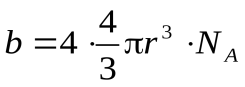
2. Учет силы межмолекулярного взаимодействия 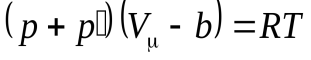
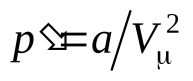 -внутреннее давление; а– постоянная Ван-дер-Ваальса, характеризующая силы межмолекулярного притяжения.
-внутреннее давление; а– постоянная Ван-дер-Ваальса, характеризующая силы межмолекулярного притяжения.
Уравнение Ван-дер-Ваальса для одного моля газа (уравнение состояния реальных газов):
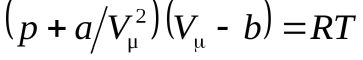 . (16)
. (16)
Уравнение Ван-дер-Ваальса для произвольной массы газа
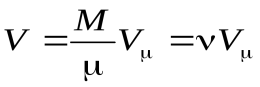
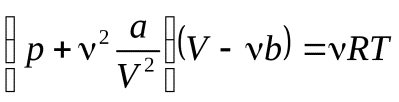 . (17)
. (17)
При фиксированных значениях давления и температуры уравнение (16) имеет три корня относительно V(V1, V2, V3)
Третий
На основании обобщения экспериментальных исследований свойств различных веществ при сверхнизких температурах был установлен закон, устранивший указанную трудность и получивший название принципа Нернста или третьего закона термодинамики. В формулировке Нернста он гласит: в любом изотермическом процессе, проведенном при абсолютном нуле температуры, изменение энтропии системы равно нулю, т. е.
DS (T=0) = 0, S = S0 = const, независимо от изменения любых других параметров состояния (например, объема, давления, напряженности внешнего силового поля и т. д.).
Основными положения тепловой теоремы Нернста:
1. При абсолютном нуле температуры свободная энергия равна теплоте процесса.
2. При температурах, близких к абсолютному нулю, теплоемкость системы равна нулю.
Одной из формулировок третьего начала термодинамики является также постулат Планка:
Энтропия идеального кристалла при абсолютном нуле температуры равна нулю.
Закон Гесса
Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути ее протекания:
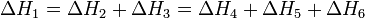
Следствия из закона Гесса:
1. Энтальпия реакции равна разности сумм энтальпий образования конечных и начальных участников реакций с учетом их стехиометрических коэффициентов.

2. Энтальпия реакции равна разности сумм энтальпий сгорания начальных и конечных реагентов с учетом их стехиометрических коэффициентов.
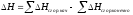
3. Энтальпия реакции равна разности сумм энергий связей Eсв исходных и конечных реагентов с учетом их стехиометрических коэффициентов.
В ходе химической реакции энергия затрачивается на разрушение связей в исходных веществах (ΣEисх) и выделяется при образовании продуктов реакции (–ΣEпрод). Отсюда
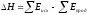
Следовательно, экзотермический эффект реакции свидетельствует о том, что образуются соединения с более прочными связями, чем исходные. В случае эндотермической реакции, наоборот, прочнее исходные вещества.
При определении энтальпии реакции по энергиям связей уравнение реакции пишут с помощью структурных формул для удобства определения числа и характера связей.
4. Энтальпия реакции образования вещества равна энтальпии реакции разложения его до исходных веществ с обратным знаком.
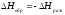
5. Энтальпия гидратации равна разности энтальпий растворения безводной соли 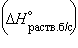 и кристаллогидрата
и кристаллогидрата 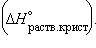
Из вышесказанного видно, что закон Гесса позволяет обращаться с термохимическими уравнениями как с алгебраическими, т. е. складывать и вычитать их, если термодинамические функции относятся к одинаковым условиям.
Закон Кирхгофа
Закон Кирхгофа гласит, что температурный коэффициент теплового эффекта химической реакции равен изменению теплоёмкости системы в ходе реакции. Уравнение Кирхгофа, являющееся следствием этого закона используется для расчёта тепловых эффектов при разных температурах.
Дифференциальная форма закона:
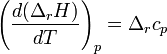
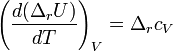
Интегральная форма закона:
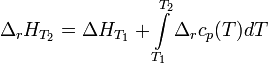
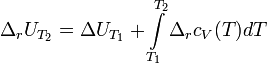
где 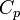 и
и 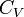 — изобарная и изохорная теплоёмкости,
— изобарная и изохорная теплоёмкости, 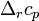 — разность изобарных
— разность изобарных
теплоёмкостей продуктов реакции и исходных веществ, 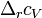 — разность изохорных
— разность изохорных
теплоёмкостей продуктов реакции и исходных веществ, а 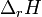 и
и 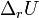 — соответствующие тепловые эффекты.
— соответствующие тепловые эффекты.
Теплоемкость-количество теплоты, необходимое для повышения температуры вещества на 1 градус.
Истинная теплоемкость- количество теплоты(бесконечно малое), которое необходимо для бесконечно малого изменения температуры.
Если разница 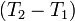 невелика, то можно принять
невелика, то можно принять 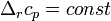 и
и 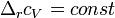 , соответственно интегральная форма уравнений примет следующий вид:
, соответственно интегральная форма уравнений примет следующий вид:
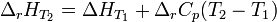
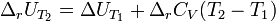
При большой разнице температур необходимо учитывать температурные зависимости теплоёмкостей: 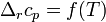 и
и 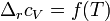
Для практических расчетов теплоемкость выражают в виде зависимости степенного ряда от температуры:
∆Cp=∆a+∆bT+∆cT2+∆c’T-2
Определение
Температура (от лат. temperatura — надлежащее смешение, нормальное состояние) — скалярная физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы. Температура всех частей системы, находящейся в равновесии, одинакова. Если система не находится в равновесии, то между её частями, имеющими различную температуру, происходит теплопередача (переход энергии от более нагретых частей системы к менее нагретым), приводящая к выравниванию температур в системе.
Температура относится к интенсивным величинам, не зависящим от массы системы.
3.Термодинамика биологических систем. ''Жизнь с точки зрения физики" (Э.ШРЕДИНГЕР). Теорема Пригожина. Функция диссипации.
Любая живая система потребляет энергию и расходует её в виде работы и теплоты. С точки зрения термодинамики организму можно приписать свойства тепловой машины, подчиняющейся началам термодинамики. Первое начало термодинамики – закон сохранения энергии. Его применимость к живым системам надёжно доказана, но не выявляет никакого отличия их от неживых систем.
Второе начало термодинамики – закон энтропии– указывает, в каком направлении должны протекать естественные самопроизвольные процессы.В системемерой необратимости превращений энергии и одновременно мерой структурной неупорядоченности является энтропия. Согласно второму началу термодинамики энтропия изолированных систем не может уменьшаться, она либо возрастает, достигая максимума в состоянии термодинамического равновесия системы, либо, в крайнем случае, не изменяется. Эрвин Шредингер в книге “Что такое жизнь? С точки зрения физика” писал: “Если неживую систему изолировать или поместить в однородные условия, то всякое движение обычно очень скоро прекращается в результате различного рода трения, разность электрических или химических потенциалов выравнивается, вещества, которые имеют тенденцию образовывать химические соединения образуют их, температура выравнивается вследствие теплопроводности. Затем система в целом угасает, превращается в мёртвую инертную массу материи. Достигается состояние, при котором не происходит никаких заметных событий. Физик называет это стояние термодинамическим равновесием, или состоянием максимальной энтропии” [5]. Практически это состояние достигается быстро, но теоретически окончательное установление равновесия может происходить годами и столетиями. Очевидно, что всякий приток тепла извне увеличивает интенсивность теплового движения и повышает энтропию. Если мы будем расплавлять кристалл, то нарушим устойчивое расположение атомов или молекул, кристаллическая решётка превращается в непрерывно меняющееся случайное распределение атомов. Таким образом, согласно законам физики, материя стремится приблизиться к хаотическому состоянию.
Если рассматривать биологические процессы, то “… живая материя избегает перехода к равновесию”, структурная упорядоченность возрастает, а неупорядоченность, энтропия уменьшается. Например, при самосборке субклеточных структур или при эмбриональном развитии организма. Такие явления, как возникновение жизни, образование биосферы, прогрессивная эволюция, долгое время не вписывались в общую физическую картину мира, считались термодинамически маловероятными. Шредингер считал, что “деятельность живой материи, хотя и основана на законах физики, установленных к настоящему времени, но, по-видимому, подчиняется до сих пор неизвестным другим законам физики, которые, однако, как только они будут открыты, должны составить такую же неотъемлемую часть этой науки, как и первые”. В своих лекциях, прочитанных в 1943 г., он указывал, что организм избегает перехода к равновесию благодаря тому, что он питается и дышит, т.е. благодаря метаболизму. В процессе жизнедеятельности организм непрерывно увеличивает свою энтропию, приближаясь к опасному состоянию равновесия (максимальной энтропии), представляющему собой смерть. Избежать этого состояния организм может, только постоянно извлекая из окружающей среды “отрицательную энтропию” – то чем организм питается. Иными словами, живой организм постоянно привлекает на себя поток “отрицательной энтропии”, чтобы компенсировать этим увеличение энтропии, производимое в процессе жизни, и тем самым поддерживать себя постоянно на достаточно низком уровне энтропии. В метаболизме человек освобождается от всей той энтропии, которую он вынужден производить пока жив. “Отрицательная энтропия” или энтропия, взятая с отрицательным знаком – мера упорядоченности. Таким образом, с точки зрения Шредингера, живой организм непрерывно извлекает упорядоченность из окружающей среды. Например, высшие животные питаются крайне хорошо упорядоченным состоянием материи в более или менее сложных органических соединениях, после чего животные возвращают эти вещества в очень деградированной форме в окружающую среду. Для растений источником “отрицательной энтропии” является свет.
Книга Шредингера привлекла внимание физиков и химиков к проблемам биологии. Многие впервые высказанные им теоретические представления были подтверждены последующими исследованиями.
Реальные биологические системы в природе существенно открыты, гетерогенны, нелинейны, нестационарны и далеки от термодинамического равновесия. Совокупность этих свойств находится за пределами применимости второго начала термодинамики, даже с его новейшими расширениями. Сложно применять понятия энтропии и информации для описания общих свойств биологических систем.
Несмотря на это, современная термодинамика позволила дать новую трактовку фундаментальным биологическим процессам. Противоречие закону энтропии исчезает, если рассматривать организм в качестве единой системы вместе с окружающей средой, поскольку сам живой организм не является системой изолированной. Благодаря развитию термодинамики необратимых процессов к настоящему времени сформировалось представление, согласно которому по законам физики в открытых системах с потоком энергии вынужденно возникают динамические структуры в виде циклов, переносящих энергию, – упорядоченные круговороты вещества. При этом наиболее устойчивыми оказываются и поэтому «отбираются» функциональные структуры, состоящие из нескольких взаимодействующих циклов, т.е. более сложные динамические структуры, которые лучше вписываются в круговорот и эффективнее преобразуют проходящую через них энергию. Источником образования динамических структур на Земле служит поток солнечной энергии, который вызывает и организует круговороты в массах вещества – от простых физических (воды и воздуха) до сложных биологических.
Во многих случаях кажется, что они возникают сами по себе, и поэтому явление называют самоорганизацией структур. Появилось даже целое направление исследования таких процессов – синергетика(особенно важны в этом плане работы школы Ильи Пригожина, посвящённые проблеме возникновения организации из хаоса). Однако приложения синергетики к проблемам биологии дают лишь поверхностные аналогии, поскольку биологическая организация не исчерпывается структурной упорядоченностью.
Теорема Пригожина
Стационарным состоянием системы называют состояние, в котором процессы в системе так сбалансированы, что основные величины, характеризующие систему, остаются постоянными.
Живые организмы большую часть времени проводят именно в стационарном состоянии (точнее – переходя время от времени из одного стационарного состояния в другое, например – из состояния сна в состояние бодрствования и наоборот). Это свойство живых существ называют гомеостазом. Поддержание стационарного состояния (гомеостаз) имеет большое значение для нормальной жизнедеятельности. В организме всё время идут длинные цепи сопряжённых физических процессов и химических реакций. Эти процессы очень по разному зависят от температуры, рН и многих других параметров. Поэтому, если эти параметры меняются, нарушается согласование важных жизненных процессов. Чтобы такое не происходило, в организме существуют сложные системы регулирования, достаточно точно поддерживающие стационарное состояние. Наоборот, болезни в большинстве случаев сопровождаются нарушением гомеостаза.
Пригожин доказал положение, которое называется теоремой Пригожина: в стационарном состоянии продукция энтропии минимальна 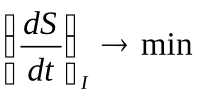 (в стационарном состоянии) (27).
(в стационарном состоянии) (27).
Нетрудно понять, что минимальная продукция энтропии соответствует минимальной диссипации свободной энергии (минимальным потерям энергии), то есть максимальному КПД. Поэтому можно сказать, что в стационарном состоянии КПД системы наибольший. Это тоже важное свойство стационарных состояний.
Выводы и заключение
Из материала лекции Вы усвоили, что законы термодинамики имеют большое значение для понимания самых разных сторон жизнедеятельности организма. Методы термодинамики успешно используются при исследовании самых разнообразных процессов, связанных с превращениями энергии в организме (питание, мышечное сокращение, обмен веществ, возникновение и проведение нервных импульсов, работа органов чувств и многое другое). Поэтому знание основных положений биологической термодинамики будет необходимо Вам при изучении большинства дисциплин.
Диссипативная функция
Изменение энтропии системы можно выразить через обобщенные силы и обобщенные координаты, характеризующие эту систему:
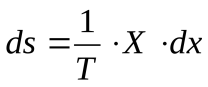
Отсюда можно найти скорость изменения энтропии (ds/dt). Эту величину называют диссипативной функцией:
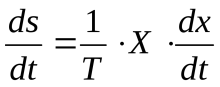
Например, при действии силы трения диссипативная функция выражается так:
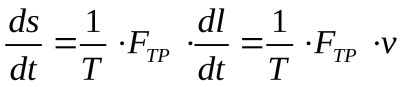
Если в системе идет химическая реакция, то обобщенной силой является химический потенциал (μx ), а обобщенной координатой— число молей вещества, вступающих в реакцию (v). Диссипативная функция имеет вид:
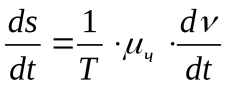
где dν/dt скорость реакции.
Если в системе происходит несколько процессов, то ее диссипативная функция определяется по формуле:
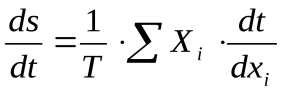
Диссипативную функцию, рассчитанную на единицу объема (V), называют удельной продукцией энтропии:
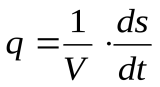
Ее можно считать количественной мерой необратимости процесса: чем больше q3, тем процесс дальше от обратимого.
Важным примером диссипации энергии является демпфирование. Этим термином обозначают уменьшение величины действующей силы (и, соответственно, ускорения) за счет перехода механической энергии в тепловую. В организме человека иживотных демпфирующими свойствами обладают скелетные мышцы, связочный аппарат, система кровообращения и др.Демпфирование играет важную роль в ослаблении нагрузок, действующих на организм. Это активный процесс, регулируемый центральной нервной системой. Выработка навыков демпфирования необходима летчикам, космонавтам, парашютистам,горнолыжникам — всем, кому приходится испытывать перегрузки. Следовательно, диссипация энергии не всегда должна рассматриваться как отрицательное явление. Примером использования диссипации энергии в лечебных целях служит высокочастотная электротерапия (например, УВЧ терапия), когда электромагнитная энергия в тканях организма диссипирует в тепло.
Диссипация энергии происходит во всех самопроизвольных процессах, идущих в изолированных системах. Так, при расширении газа его энтропия возрастает, поскольку с увеличением объема увеличивается число вариантов распределения молекул(растет термодинамическая вероятность). Возрастание энтропии свидетельствует об уменьшении свободной энергии.
Более сложным примером является смешение двух разных веществ. При образовании смеси работа не совершается, и может показаться, будто свободная энергия не изменяется. Однако в смеси веществ число вариантов распределения молекул больше, чем в сумме объемов, занимаемых ими до смешения. Следовательно, для смеси характерны более высокие величинытермодинамической вероятности и энтропии. Поэтому вещества довольно легко смешиваются, тогда как обратный процесс(самопроизвольное разделение смеси на компоненты) практически невероятен. Однако за счет подведения энергии извне можно добиться разделения смеси на составляющие ее вещества. Свободная энергия такой системы повышается.
В природе происходит немало процессов, вследствие которых свободная энергия той или иной системы возрастает, но они протекают только при наличии другой системы, «питающей» первую свободной энергией. Естественно, что при сопряжении процессов в двух системах свободная энергия одной из них обязательно понижается, причем общее изменение свободной энергии в полной системе, состоящей из нескольких взаимодействующих частей, всегда отрицательно, то есть ее энергия непременно претерпевает диссипацию.
Важную роль в процессах жизнедеятельности играет сопряжение электронных переходов в биологически важных молекулах с изменением их конформации (электронно-конформацион-ное взаимодействие — ЭКВ). Во многих процессах молекулы биополимеров (в первую очередь белков) так меняют свою третичную структуру, что их свободная энергия заметно возрастает. Этот запас свободной энергии может затем использоваться для совершения работы. Грубо говоря, молекула «работает» наподобие пружины: сжимается и разжимается. Подобное явление лежит в основе мышечного сокращения; так действуют многие ферменты. ЭКВ может происходить потому, что оно сопряжено с перестройкой электронной оболочки молекулы, то есть с переходом электронов на другие энергетические уровни, что приводит к освобождению заключенной в них энергии. Часть последней обеспечивает возрастание свободной энергии молекулы, испытавшей конформационную перестройку, а часть — диссипирует. Общее же изменение свободной энергии оказывается отрицательным в соответствии со вторым началом термодинамики, Сопряжение термодинамических процессов широко распространено в биологических системах.
Дата: 2019-04-22, просмотров: 367.