При оценке органолептических показателей определяли цвет, запах, вкус и консистенцию напитка. Цвет напитка определяли в стеклянной колбе при отражающем дневном свете. Запах определяли при переливании из одного сосуда в другой. Органолептические исследования образцов сравнивали с нормами установленными ТУ 9222-217-00419785-00.
Определение активной кислотности.
Определение активной кислотности исследуемых образцов проводили согласно ГОСТ 26781-85 с помощью ручного pH- метра, марка которого pH ер 2. pH- метр погружали в исследуемый образец и считывали установившееся значение активной кислотности. Для этого каждый анализ проводили 3 раза.
Определение титруемой кислотности.
Титруемую кислотность молока определяли методом титрования молока в присутствие индикатора фенолфталеина. Брали 10 мл исследуемого напитка, добавляли 20 мл дистиллированной воды, 3 капли фенолфталеина и титровали 0,1 раствором NaOH.
Количество щелочи, пошедшего на титрование, умножали на 10 и получали кислотность в градусах Тернера.
Определение общего количества молочнокислых микроорганизмов.
Сущность метода заключается в посеве определенного количества исследуемого субстрата или его разведения в чашки Петри с плотной питательной средой и после термостатирования (в зависимости от видов организмов) подсчитывают выросшие колонии. Исходя, из предлагаемой обсемененности исследуемого продукта готовят разведение для посевов. Если микрофлора исследуемого материала обильная, то рассчитывают такое разведение, в результате посева которого 1 мл этого разведения на чашки Петри находилось десятки колоний. Разведения готовили в пробирках на физиологическом растворе. Стерильной пипеткой 1 мл исследуемого образца вносили в первую пробирку с 9 мл. физиологического раствора. Получаем разведение 1:10. Новой стерильной пипеткой перемешивали разведение 1:10 и 1 мл, его переносили во вторую пробирку с 9 мл. физиологического раствора. Получается разведение 1: 100 и т.д. Делали 8 разведений. Из последних трех разведений делали посев на чашки Петри с плотной средой по 1 мл.
После окончания посевов, подписанные чашки Петри помещали в термостат при температуре 42±2˚С. Через 72 часа подсчитывали выросшие колонии микроорганизмов.
Для подтверждения наличия роста болгарской палочки из выросших колоний делали мазки, которые окрашивали простым способом (метиленовой синью). Для этого на фиксированный мазок пипеткой наливали несколько капель краски. Через 2-3- минуты краску смывали водой, мазок высушивали и рассматривали под масляной иммерсионной системой микроскопа. В поле зрения микроскопа наблюдали формы бактерий, характерные для болгарской палочки, одинарные палочки (рис. 5).
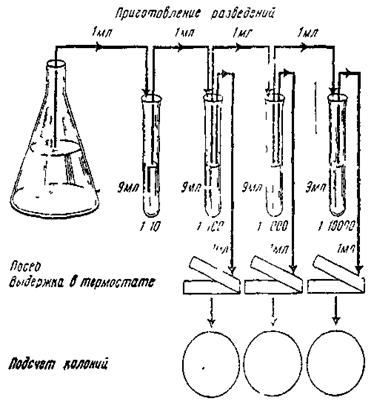
Рисунок 5 - Схема проведения посева на чашки Петри
Для подсчета берут те чашки Петри, на которых колонии хорошо отделены одна от другой. Каждую отсчитанную колонию помечают точкой с нижней стороны чашки Петри. При большом количестве колоний дно чашки делят на сектора, подсчитывают количество колоний в каждом секторе и результаты суммируют. Следует, иметь в виду, что точность метода зависит от числа подсчитанных колоний: лучшим разведением считают то, при высеве из которого на плотной питательной среде вырастает от 50 до 150 колоний. Если число выросших колоний меньше 10, то эти результаты отбрасывают. Желательно, чтобы общее количество подсчитанных колоний при высеве данного разведения было не менее 300.
Зная количество выросших колоний и степень разбавления, легко определить количество микроорганизмов в 1 мл исследуемого материала, пользуясь формулой:
N= (a±2) K/V
Где, N - количество микроорганизмов в 1 мл суспензии;
K - разведение, из которого проведен посев;
A - среднее количество колоний на чашке Петри при разведении K;
V - объем суспензии.
Дата: 2019-05-28, просмотров: 295.