В практике очистки природных и сточных вод наибольшее распространение получили угольные сорбенты. Процессы сорбции на углях отличаются большой сложностью. Наряду с ионным обменом наблюдается молекулярная сорбция, а также поглощение коллоидов.
Одними из самых эффективных способов удаления из сточных вод отдельных компонентов (тяжелые металлы, нефтепродукты, хлорорганика, СПАВ, фенолы) являются адсорбция и ультрафильтрация.
Углеродные сорбенты (активные угли) являются гидрофобными сорбентами с высокой степенью карбонизации (90-95 %). Марка активного угля позволяет судить о его назначении или происхождении. Например БАУ - березовый активный уголь, АГ - активный гранулированный, АР - активный рекуперационный, КАД - каменноугольный активный дробленый, ОУ - осветляющий уголь, СКТ - уголь сернистокалиевого активирования торфяной и т.д..
Сорбенты характеризуются пористостью, структурой пор и химическим составом. Пористость активных углей 57...75 %, туфов - 30...55 %, диатомитов - до 75'%. Для активных углей суммарный объем пор составляет обычно 0,76-0,88 см3/г.
Пористость и суммарный объем пор лишь приближенно характеризуют сорбционную способность, так как не учитывают структуру пор, обусловливающую величины доступной поверхности и адсорбционного потенциала. По размерам поры делятся на микропоры, переходные поры (или мезопоры) и макропоры. Микропоры активных углей занимают поверх- ность до 1000 м2/г, переходные - до 100 м2/г, макропоры - до 1...2 м2/г. Объемы микро-, мезо- и макропор активных углей АГ-3 соответственно равны 0,27; 0,128 и 0,386 см3/г.
Выбор марки адсорбционного материала заключается в подборе параметров его пористой структуры в зависимости от размеров молекул адсорбируемых веществ.
Если в воде присутствует одно вещество с низкой молекулярной массой, например, фенол, азот аммонийный, азот нитритный, то данные вещества, имеющие относительно низкую молекулярную массу и размер молекул τ = 0,63 нм, лучше всего сорбируются в микропорах (τ < 0,63–0,7 нм) и супермикропорах (0,6–0,7 < τ < 1,5–1,6 нм). Для этого случая пригодны активированные угли, имеющие требуемую структуру пор, типа АГ-3 и МАУ-100.
Если в воде находятся нефтепродукты, ПАВ, гуминовые кислоты (по отдельности или смесь), то данные вещества, имеющие более крупные размеры молекул (τ ≥ 1,8 нм), лучше всего сорбируются в мезопорах (1,5–1,6 < τ < 100–200 нм). В этом случае пригодны активированные угли и сорбенты, имеющие требуемую структуру пор, например, мезопористый сорбент СГН-30.
Если в воде присутствует смесь низко- и высокомолекулярных соединений (нефтепродукты, ПАВ, азот аммонийный, азот нитритный), то данные вещества, имеющие различные размеры молекул наиболее полно будут сорбироваться на адсорбентах, имеющих хорошо развитую структуру микропор и мезопор (таких как АГ-3, МАУ-100).
Способность органических веществ к сорбции возрастает в ряду: гликоли < спирты < кетоны < сложные эфиры < альдегиды < недиссоциированные кислоты < ароматические соединения. Способность сорбции возрастает с ростом молекулярной массы органических веществ и мицеллярной массы коллоидов.
Возрастание энергии взаимодействия сорбируемой молекулы с атомами сорбента, ограничивающими полость сорбента, проявляется тем сильнее, чем меньше радиус поры, и в наибольшей степени выражена в узких микропорах. Чем больше доля узких, но доступных для молекул сорбируемого вещества микропор в единице общего объема пор сорбента, тем выше избирательность сорбции вещества из водного раствора этим сорбентом и тем более эффективнее применение такого сорбента для очистки воды.
Общие рекомендации по применению различных марок углей представлены в табл. 2.1, позволяющей подобрать технологические параметры сорбционного слоя адсорбера в зависимости от вида и концентрации присутствующих в воде антропогенных загрязнений [5].
Таблица 2.1
Рекомендуемые параметры сорбционного стационарного слоя в зависимости от вида и концентрации присутствующих в воде антропогенных загрязнений
| Виды антропогенных загрязнений | Размеры их молекул, нм | Предпочтение типов пор в углях | Рекомендуемый тип сорбента | Крупность гранул, мм | Время контакта, мин |
| Азот аммонийный | 0,63 | микропоры, супермикропоры | АГ-3, МАУ-100 | 0,5–1,5 0,5–1,0 | 10–11 11–12 |
| Фенолы | 0,71 | микропоры, супермикропоры | АГ-3, МАУ-100 | 0,5–1,5 0,5–1,0 | 10–11 11–12 |
| Нефтепродукты | 1,8 | мезопоры | СГН-30 | 0,5–1,5 0,5–1,0 | 15–16 16–17 |
| ПАВ | 2,4 | мезопоры | СГН-30 | 0,5–1,5 0,5–1,0 | 15–16 16–17 |
| Азот аммонийный, фенол | 0,63–0,71 | микропоры, супермикропоры | АГ-3, МАУ-100 | 0,5–1,5 0,5–1,0 | 10–11 11–12 |
| Нефтепродукты, ПАВ | 1,8–2,4 | мезопоры | СГН-30 | 0,5–1,5 0,5–1,0 | 15–16 16–17 |
| Азот аммонийный, фенол, нефтепродукты, ПАВ | 0,63–2,4 | микропоры, супермикропоры, мезопоры | АГ-3, МАУ-100 | 0,5–1,5 0,5–1,0 0,5–1,0 | 15–16 16–17 16–17 |
Силу взаимодействия между сорбатом и сорбентом при извлечении вещества из бесконечно разбавленных растворов оценивают величиной уменьшения свободной энергии Гиббса (-ΔG0, кДж/моль). Как показали теоретические расчеты и экспериментальные данные при значении -ΔG0 меньше 16–18 кДж/моль извлекаемое вещество сорбируется неэффективно и применять сорбционный метод для очистки воды нецелесообразно. Напротив, если величина -ΔG0 больше 20 кДж/моль, то сорбционная технология очистки будет достаточно эффективна.
Величина -ΔG0 для любого вещества может быть приблизительно вычислена как сумма инкрементов δ(-ΔG0), отнесенная к энергии взаимодействия с сорбентом отдельных структурных звеньев и функциональных групп молекул:
-ΔG0 = Σ δ (-ΔG0). (2.5)
Для сорбента КАД инкременты стандартного уменьшения энергии сорбции сорбата из водных растворов приведены в табл. 2.2.
Величина уменьшения свободной энергии сорбции -ΔG0 отражает влияние химического строения молекулы на энергию сорбционного взаимодействия.
Таблица 2.2
Инкременты стандартного уменьшения свободной энергии сорбции
из водных растворов (сорбент КАД)
| Структурный элемент или функциональная группа | δ(-ΔG0), кДж/моль |
| В алифатических соединениях: –СН2; –СН3 | 2,3 |
| –ОН | 1,47–1,59 |
| –NH2 | 13,4 |
| –СООН | 1,89 |
| В ароматических соединениях: –С6Н5 | 21,2 |
| –ОН | 0,04–0,08 |
| – NH2 | 1,05 |
| –СООН | 1,63 |
| –Cl | 1,38 |
| –CH3 | 0,48 |
| –SO3H | -1,09 |
При группировке производственных сточных вод в потоки, направляемые на сорбционные установки, в одном потоке целесообразно объединять вещества с близкими значениями -ΔG0 (2 кДж/моль). Двухступенчатую схему очистки применяют для сточной воды, содержащей смесь веществ, сильно различающихся по величине -ΔG0. Изменение свободной энергии в процессе сорбции может быть определено экспериментальным путем по уравнению
-ΔG0 = RT lnK, (2.6)
где K – константа сорбционного равновесия.
Значение K определяют как произведение параметра В, вычисленного по уравнению (4.14), и активности растворителя в растворе ( 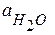 )
)
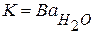 . (2.7)
. (2.7)
Для достаточно разбавленных растворов можно принять, что мольная доля растворителя (воды) равна единице. Тогда коэффициент активности растворителя также будет равен единице, а значение 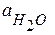 в уравнении (2.7) можно заменить на концентрацию воды, равную 55,5 моль/л.
в уравнении (2.7) можно заменить на концентрацию воды, равную 55,5 моль/л.
Сорбция растворенных веществ существенно зависит от их растворимости, что нашло отражение в известном правиле Траубе, согласно которому в гомологическом ряду алифатических карбоновых кислот произведение коэффициента распределения вещества между раствором и твердым сорбентом ( 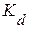 ) на растворимость этого вещества (
) на растворимость этого вещества ( 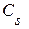 ) является величиной постоянной, то есть
) является величиной постоянной, то есть 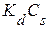 = сonst. Правило Траубе справедливо и для сорбции веществ некоторых других гомологических рядов. Таким образом, между степенью сорбции вещества и его растворимостью существует соотношение: чем менее растворимо вещество, тем более оно склонно к сорбции.
= сonst. Правило Траубе справедливо и для сорбции веществ некоторых других гомологических рядов. Таким образом, между степенью сорбции вещества и его растворимостью существует соотношение: чем менее растворимо вещество, тем более оно склонно к сорбции.
Большое влияние на процесс сорбции оказывает структура растворенного вещества. Наиболее сильное сорбционное взаимодействие наблюдается, если в структуре молекул сорбата имеются двойные связи, особенно сопряженные, и ароматические структуры. Ароматические соединения сорбируются из растворов со значительно большей энергией, чем алифатические (особенно насыщенные соединения_ и вытесняют их с поверхности сорбента в раствор. Соединения, имеющие ароматические структуры, проявляют тенденцию к преимущественной сорбции на алифатических группах, например на поверхности углерода. В случае массивных ароматических молекул эта тенденция ослабляется, возможно вследствие увеличения расстояния между ароматической группой и поверхностью сорбента. Такие высокомолекулярные вещества как сахар, красители и полимеры больше склонны к сорбции, чем их более легкие аналоги.
Сорбция – экзотермический процесс, поэтому повышение температуры должно вызывать уменьшение поглощения растворенного вещества. Такой эффект всегда наблюдается при сорбции газов. Однако температура влияет на растворимость вещества и, следовательно, на величину его химического потенциала в равновесном растворе.
Если растворимость вещества с повышением температуры увеличивается, то сорбция уменьшается. При падении растворимости с нагреванием раствора сорбция увеличивается. Наложение этих двух факторов (экзотермичностью сорбции и изменением химического потенциала сорбирующегося компонента) определяется суммарное влияние температуры на равновесие при сорбции веществ из растворов.
При сорбции органических веществ из водных растворов неорганических солей наблюдается изменение величины сорбции. Почти во всех случаях сорбция органических веществ из водно-солевых растворов выше, чем сорбция из воды. Изучение влияния минеральных солей на сорбцию органических веществ показало, что усиление сорбции обусловлено связыванием части растворителя за счет гидратации ионов минеральных солей. Вследствие связывания воды повышается эффективная концентрация сорбата в растворе, что приводит к изменению распределения растворенного вещества между двумя фазами.
Реакция среды значительно влияет на характер распределения растворенного вещества между объемом раствора и поверхностью твердого сорбента, так как изменение рН раствора ведет к изменению степени гидратации растворенного вещества. Так, в кислой среде благодаря повышению концентрации Н+-ионов происходит интенсивное связывание растворителя (воды) за счет образования Н3О+-ионов, что приводит к дегидратации растворенных веществ.
Слабые органические электролиты (фенолы и кислоты, амины и др. органические основания) при изменении величины рН раствора изменяют степень своей ионизации. Чем меньше степень ионизации слабого электролита, тем больше степень сорбционного извлечения его из раствора.
Оптимальная величина рН для сорбции органических электролитов может быть вычислена по формуле:
рН = рКа ± 3,0, (2.8)
где знак (-) относится к фенолам и кислотам, в знак (+) – к основаниям; рКа – отрицательный логарифм константы кислотной ионизации (с отщеплением протона).
Наличие химически связанного кислорода в структуре АУ, образующего поверхностные химические соединения основного или кислотного характера, определяет возможность сорбции неорганических электролитов данными материалами.
Дата: 2019-04-23, просмотров: 396.