Камфора входит в состав эфирных масел многих растений, но практически источником ее получения служит только вечнозеленое камфорное дерево, произрастающее в Юго-Восточной Азии, на острове Тайвань и в Японии. Эфирное масло содержится во всех частях дерева: в листьях, ветвях, стволе, но наиболее богаты им корни и нижние части стволов, выход масла из которых достигает 4,5%. При низкой температуре из камфорного масла выделяются бесцветные кристаллики - это и есть сырая, неочищенная камфора. Именно из-за нее красивая и душистая древесина камфорного дерева вместо того, чтобы превращаться под резцом мастера в статуэтки, шкатулки или иные поделки, безжалостно измельчается в щепу, из которой затем отгоняют эфирное масло.
Первыми научились добывать и использовать камфору для медицинских целей древние жители Индии. На это указывает само название камфоры, производимое от санскритского слова "капура", что значит "белая". Древние индийцы были хорошо знакомы с целебными свойствами камфоры. С тех пор камфора остается ценнейшим лекарственным средством: она возбуждает центральную нервную систему, особенно дыхательный и сосудодвигательный центры, расширяет венечные сосуды сердца, улучшает питание сердечной мышцы.
Большим почетом пользовалась камфора и в арабской медицине. Сведения о ней можно найти в арабских рукописях, относящихся к VI веку. В Европе камфора стала известна значительно позднее - только в эпоху средневековья. В древнем мире и в средние века камфора ценилась, чуть ли не на вес золота. Это было настолько редкое лекарство, что средневековые врачи в своих рецептах против слова "камфора" добавляли: "если можно ее достать".
Богатейшими лесами камфорного дерева издавна славился китайский остров Тайвань. Вечнозеленые гиганты служили главным источником существования жителей острова, которые добывали из них столь высоко ценимую в странах Европы и Азии камфору. Добыча камфоры долгое время была подчинена вся хозяйственная жизнь острова.
Многочисленные попытки создать промышленные плантации камфорного дерева в Африке, Австралии, Южной Америке не дали результатов. Деревья приживались и росли, но камфоры в их древесине содержалось очень мало.
Добыча камфоры на Тайване носила хищнический характер. Ежегодно уничтожались сотни тысяч деревьев. Древесина их перерабатывалась в кустарных печах, которых на острове было более 14000. Чтобы не допустить полного уничтожения ценнейшей древесной породы, пришлось пойти на временное уменьшение добычи камфоры и уничтожить 2500 печей. И все же торговля камфорой приносила огромный доход.
До начала XX века единственным поставщиком камфоры на мировой рынок была Япония, во владение которой Тайвань перешел в 1895 г., после японо-китайской войны. Все аптеки Европы и Азии снабжались японской камфорой. Спрос на камфору значительно возрос с появлением первого пластического материала - целлулоида, в состав которого входила камфора.
Правда, на первых порах целлулоид не находил широкого применения, и японская камфора покрывала всю мировую потребность, хотя и подскочила в цене раз в десять.
Но с зарождением и развитием кинопромышленности, требовавшей все больших и больших количеств целлулоида, спрос на камфору стал опережать ее производство. Пытаясь, во что бы то ни стало сохранить свою монополию, Япония заложила новые плантации камфорного дерева. Однако события опрокинули расчеты владельцев этих плантаций. И, пожалуй, самое замечательное из них произошло еще в 1893 г., когда ученым впервые удалось выяснить химический состав и структуру молекулы камфоры.
Стало известно, что камфора представляет собой бициклический кетон и близка к некоторым не столь уж дефицитным природным соединениям, в частности к пинену соснового скипидара. Пинен и послужил исходным материалом для промышленного производства синтетической камфоры.
Полученная из пинена камфора по внешнему виду ничем не отличалась от натуральной. Но все-таки между ними было одно различие: природная камфора обладает свойством вращать плоскость поляризации света вправо, а синтетическая была почти лишена оптической активности. Впрочем, для производства кинопленки это обстоятельство значения не имело, и синтетическая камфора стала конкурентом природной. В начале XX века предприятия по ее производству возникают в США, Германии, Франции, Англии, России.
Японские капиталисты повели жестокую борьбу с новорожденной отраслью промышленности. Они стали систематически снижать цены на камфору на мировом рынке, одновременно скупая скипидар, служивший сырьем для получения искусственной камфоры. Японцы действовали столь энергично, что добились, было своего. Предприятия по выработке синтетической камфоры стали одно за другим закрываться из-за нерентабельности. Однако вспыхнувшая мировая война спутала все расчеты. Камфора оказалась незаменимым материалом для производства бездымного пороха и некоторых других взрывчатых веществ, потребность в которых колоссально возросла. Цены на камфору резко подскочили вверх, и заводы синтетической камфоры заработали вновь.
Со Временем технология получения синтетической камфоры была настолько усовершенствована, что ее себестоимость стала гораздо ниже себестоимости природной камфоры.
У камфоры, получаемой из пинена, был один недостаток: она была примерно в 13 раз токсичнее природной. В процессе ее синтеза образуется много токсичных примесей, от которых почти невозможно освободиться. Поэтому природная камфора, вытесненная синтетической из сферы технического применения, казалось бы, сохранила свои позиции в медицине. Но скоро и здесь ее господству был нанесен чувствительный удар.
Оказывается, если вместо пинена в качестве исходного продукта взять бициклический спирт борнеол, очень близкий по своей химической структуре к камфоре, или его эфир с уксусной кислотой - борнил-ацетат, получается оптически активная камфора, которая, правда, вращает плоскость поляризации света не вправо, а влево. Впервые синтез левовращающей камфоры из борнеола, выделенного из эфирного масла пихты, был проведен русским ученым П. Г. Голубевым. Попытки создать промышленное производство синтетической камфоры из пихтового масла в дореволюционной России кончились безрезультатно, и только в советское время был налажен выпуск синтетической левовращающей камфоры.
Более совершенная технология позволила получить продукт высокого качества, и левовращающая камфора сейчас же заинтересовала медиков. Томский профессор М. В. Вершинин со своими сотрудниками провел всестороннее исследование терапевтических свойств левовращающей синтетической камфоры и установил, что сибирская камфора не только ни в чем не уступает японской, но даже превосходит ее по силе и надежности действия. В Государственную фармакопею СССР оба оптических изомера камфоры - левовращающая и правовращающая - вошли на равных правах.
А оптически неактивная камфора, оказавшаяся смесью (рацематом) обоих изомеров, допускается в отечественной медицинской практике только для наружного применения, поскольку она обладает противовоспалительным и обеззараживающим действием.
Производство синтетической камфоры из пихтового масла в Советском Союзе достигло таких масштабов, что уже в 1936 г. в России полностью освободились от импорта этого ценного продукта.
Химический состав камфоры
Камфора (камфара, 2-борнанон, 1,7,7 триметилбициклогептан-2-он), ф-ла I (черточками обозначены группы Н3), мол. м. 152,23; бесцветные кристаллы с характерным запахом; т. пл. ( + )- и ( — )-изомеров 178,2-178,6°С, (b)-изомера 178-178,5°С, т. кип. 207,4-209,1 °С (возг.); d420 0,992; [a]D20 для ( + )-К. + 44,3°, для (-)-К. -44,22° (абс. спирт, 50%); С°р 1,733 кДж/(кг.К); DH0cгор -5906,6 кДж/моль, DH0пл 34,45 кДж/кг,DH0исп 50,75 кДж/моль; давление пара, в кПа (°С): 0,048 (20), 51,87 (180,3), 99,60 (206,7); тройная точка 180,1 °С (51,3 кПа). Легко возгоняется и перегоняется с водяным паром; флуоресцирует в УФ свете.
Камфора обладает свойствами кетонов: образует оксим (т. пл. 118°С; т. кип. 249-254 °С, с разл.), семикарбазон (т. пл. 247,8 °С), фенилгидразон (т. кип. 210°С/17 мм рт. ст.); в отличие от большинства кетонов не взаимодействует с NaHSO3. При действии на ( +)- или ( — )-К. Вr2 или Сl2 образуются соотв. 3-бромкамфора (т. пл. 78 °С) или 3-хлоркамфора (т. пл. 94 °С). При нагр. с КОН превращается в основном в 1,2,2,3-тетраметилциклопентанкарбоновую (камфолевую) к-ту. При нагревании с РСl5 превращается в 2,2-дихлоркамфан (т. пл. 155-156 °С), который перегруппировывается в 2,4-дихлоркамфан; длительное нагревание К. с РСl5 приводит к n-цимолу. При комнатной т-ре К. не взаимодействует с концентрацией H2SO4, но в присутствии (СН3СО)2О превращается в камфан-2-сульфокислоту (т. пл. 194 °С, с разл.); нагревание с концентрацией H2SO4 при 105-110 °С приводит к карвенону (3-n-ментен-2-он) и 3,4-диметилацетoфенону. Под действием HNO3 К. окисляется в камфорную концентрату (ф-ла II), которая далее может быть окислена до камфановой (III), камфароновой (IV) и, наконец, триметилянтарной [НООСС(СН3)2СН(СООН)СН3] концентрат.
Камфора содержится в эфирных маслах камфорного лавра, сибирской пихты, базилика, полыни, камфорного шалфея, а также в т. наз. осмольном скипидаре, получаемом экстракцией смолистой древесины. ( + )-К. выделяют из камфорного лавра; ( — )-К. получают из хвойного масла сибирской пихты, содержащего до 40% борнеола и борнилацетата, 20% камфена и 10-30% a-пинена. При этом смесь борнеола и борнилацетата выделяют из масла ректификацией, борнилацетат омыляют до борнеола, который затем дегидрируют в камфору. В пром-сти (b)-К. синтезируют из скипидара или его основного компонента a-пинена (ф-ла V) по схеме:
a-Пинен на кислотном кат. (чаще всего ТiO2) изомеризуют в камфен (VI), который очищают от побочных продуктов (лимонена, терпинолена, фенхенов) и обработкой уксусной или муравьиной которой переводят в изоборнилацетат (VII) или изоборнилформиат. Последние при омылении р-ром NaOH превращают в изоборнеол (VIII), который затем дегидрируют в камфору.
Очищенные природные (+)-К. и синтетические (-)- или (b)-К. с содержанием основного вещества 97% и т-рой кристаллизации 174°С усиливают сердечную деятельность, возбуждают центр. нервную систему, стимулируют дыхание и кровообращение.
1.3 Синтез камфоры
Синтез иминопроизводных камфоры
Для создания библиотеки иминопроизводных камфоры были разработаны способы синтеза различных иминов. Показано, что взаимодействие камфоры с аминами имеющими не высокую температуру кипения (пропиламин,бутиламин, циклопропиламин) гладко проходит в микроволновой печи СEM (Discover® SP System) в присутствии Ti(iOPr)4 в качестве дегидратирующего агента и приводит к соответствующим иминам 2-4. При переходе к более тяжелым гомологам (n ≥4) оптимальным условием синтеза иминов 5-10 является нагревание до кипения исходных реагентов без растворителя с использованием в качестве катализатора ZnCl2 (Рисунок-1). В случае октадекан-1-амина реакция протекает при кипячении исходных реагентов в толуоле в присутствии каталитического количества BF3 ·Et2O с использованием насадки Дина-Старка.
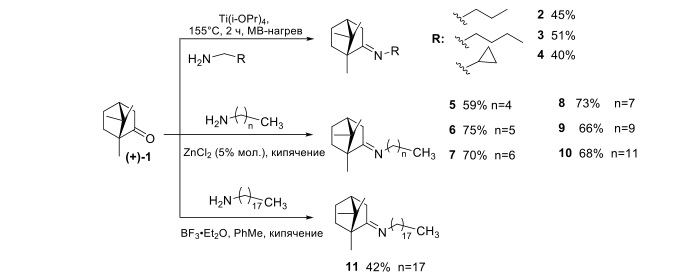
Рисунок-1
Введение гидроксильной группы может увеличивать как биоактивность так и растворимость соединения, поэтому нами осуществлено взаимодействие камфоры с рядом аминоспиртов: 2-аминоэтанол, 3-аминопропанол-1 и 5-аминопентанол-1 в результате были получены иминопроизводные 12-14 (Рисунок 2).
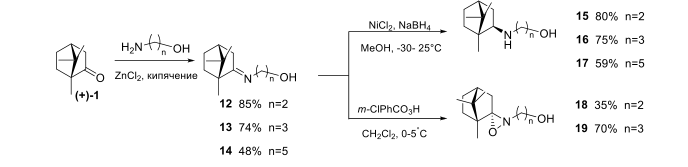
Рисунок-2
Иминогруппа в соединениях 12-14 была восстановлена с помощью системы NaBH4 /NiCl2 в результате были выделены экзо амины 15-17. Действием м-хлорнадбензойной кислотой при 0 °С на основания Шиффа 12-14 были получены транс-оксазиридины (Рисунок-2).Для расширенного изучения зависимости структура-активность, нами были получены иминопроизводные 20-36, содержащие различные функциональные группы, ароматические и гетероароматические фрагменты. Так, получено соединение 20, содержащее иминную и сложноэфирную группу; синтезированы производные, включающие дополнительную первичную либо третичную аминогруппу, фрагменты морфолина, циклогексана, а именно, продукты 21-26; получен набор ароматических и гетероароматических иминов на основе камфоры 27-35; синтезировано соединение, содержащее два фрагмента природного остова – 36 (Рисунок 3).
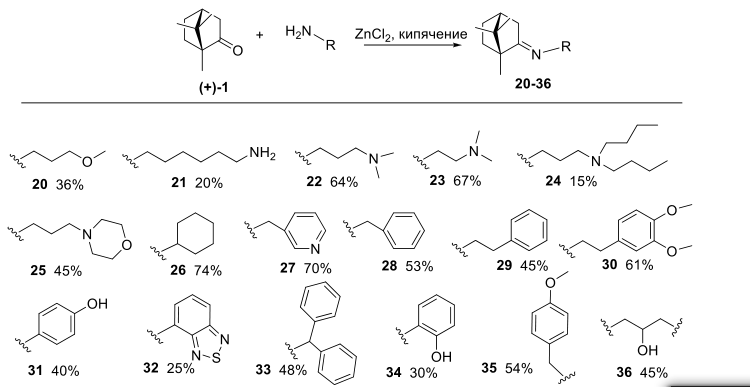
Рисунок-3
Строение всех соединений подтверждено данными масс-спектров высокого разрешения и данными ЯМР-спектров. Строение соединений 12 и 31 дополнительно подтверждено методом РСА. Таким образом, взаимодействием камфоры с простыми алифатическими аминами, а также аминами, содержащими в своей структуре ароматические, гетероароматические фрагменты, дополнительные амино- и гидроксигруппы, получен большой набор соответствующих иминов. Показана возможность окисления и восстановления иминогруппы в некоторых синтезированных иминоспиртах.
Синтез аналогов 1,7,7-триметилбициклогептан-2-илиден-аминоэтанола Исследования биологической активности синтезированных соединений 2-36,проведённые сотрудниками НИИ Гриппа г. Санкт-Петербурга в отношении вируса гриппа (штамм A/California/07/09 (H1N1)pdm09), показали их высокую эффективность как ингибиторов репродукции этого вируса. Нами было выбрано соединение-лидер, основываясь на следующих критериях: высокая противовирусная активность, низкая токсичность и достаточно хорошая растворимость. По совокупности данных критериев таким соединением оказалось иминопроизводное 12, полученное на основе камфоры и аминоэтанола.
Далее, нами проведено более детальное исследование зависимости структура-активность. При создании новых лекарственных веществ, имеющих хиральные центры, следует иметь в виду, что различные энантиомеры могут обладать различным, и даже противоположным биодействием. Поэтому необходимо было синтезировать энантиомер соединения – лидера 12 – соответствующий имин на основе камфоры 36. Также провели варьирование природного остова, где в качестве исходных монотерпеноидов были выбраны монотерпеноиды, представленные на Рисунке-4.
Кроме того, для изучения влияния природного остова на биологическую активность в качестве модельного кетона был выбран циклогексанон 41.
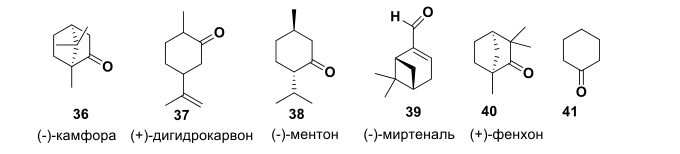
Рисунок-4
Имин 42 на основе камфоры был синтезирован альтернативным путем при взаимодействии исходных реагентов в среде Si(OEt)4 . Миртеналь вступает в реакцию с аминоэтанолом при комнатной температуре в присутствии безводного Na2SO4 в результате получен имин 43. Попытки ввести -дигидрокарвон, -ментон, -фенхон во взаимодействие с аминоэтанолом оказались безуспешными. При 9 исследовании реакции аминоэтанола с циклогексаноном обнаружено, что превращение протекает с образованием спирооксазилидина 44 (Рисунок-5).
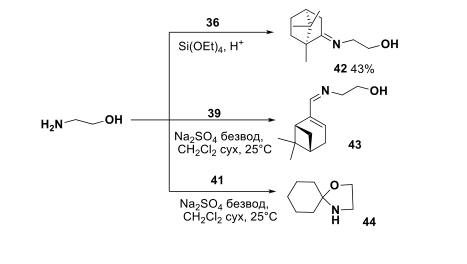
Рисунок-5
Следующим шагом при изучении соотношения структура-активность была модификация гидроксильной группы соединения лидера 12. Так, был получен метиловый эфир 45 и сложные эфиры 46 и 47. Метилирование проводили диазометаном, который генерировали действием щёлочи на нитрозометилмочевину. Превращение иминоспирта 12 в метиловый эфир 45 сопровождается побочными реакциями, чем объясняется умеренный выход продукта реакции.
Ацетат 46 получен взаимодействием уксусного ангидрида с иминоспиртом 12. Сложный эфир 47 синтезирован из хлорангидрида коричной кислоты и иминоспирта 12 в присутствии Et3N и ДМФА (Рисунок- 6).
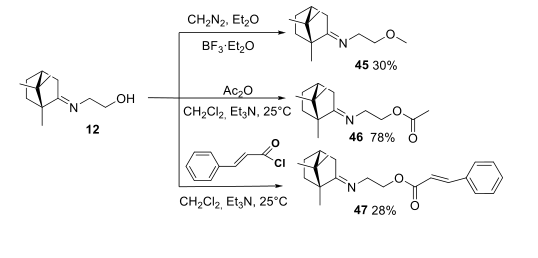
Рисунок-6
В результате исследования ингибирования репродукции вируса гриппа синтезированных производных 42, 43 и 45-47 выявлено, что модификация остова и гидроксильной группы приводит к снижению противовирусной активности.
2. ПРИМЕНЕНИЕ КАМФОРЫ
2.1. Применение камфоры в различных странах
В начале XX века камфора широко применялась в производстве некоторых пластмасс, особенно целлулоида — как пластификатор нитрата и ацетата целлюлозы, а также как флегматизатор бездымного пороха.
С давних пор камфора и камфорное эфирное масло применяется для борьбы с молью, но в настоящее время, из-за достаточно высокой токсичности, такое её использование заметно снизилось.
В Китае и по всей юго-восточной Азии, камфору использовали в качестве благовонного курения, для чего кристаллы камфоры помещали на раскаленные угли в курильнице.
В некоторых районах Индии, в основном Бенгалии и Ориссе, натуральную камфору используют в кулинарии, как специю при приготовлении сладостей и молочных пудингов.
Вследствие высокой криоскопической константы камфора используется для определения молекулярной массы методом криоскопии.
Дата: 2019-05-28, просмотров: 358.