Растворимость некоторых сульфатов редких металлов в воде
(индекс внизу — температура, °С)
| сульфат | Растворимость, г/100 г воды | |
| холодной | горячей | |
| Li2SO4 | 33,720 | 31100 |
| Li2SO4.H2O | 41,520 | 38100 |
| BeSO4 | 35,30 | 85,9100 |
| BeSO4.4H2O | 86,315 | 323100 |
| La2(SO4)3 | 2,14225 | 0,69100 |
| Nd2(SO4)3.8H2O | 9,920 | 1,5100 |
| Pr2(SO4)3.8H2O | 16,320 | 4,480 |
| Gd2(SO4)3 | 2,8920 | 2,1840 |
| Gd2(SO4)3.8H2O | 3,2820 | 2,5440 |
| Eu2(SO4)3.8H2O | 2,56320 | 1,9340 |
| Er2(SO4)3 | 430 | 6,5340 |
| Er2(SO4)3.8H2O | 1620 | 6,5340 |
| Dy2(SO4)3.8H2O | 5,07220 | 1,9340 |
| Ho2(SO4)3.8H2O | 8,18120 | 4,5240 |
| Yb2(SO4)3 | 3515 | 4,7100 |
| Yb2(SO4)3.8H2O | 60,30 | 5,8100 |
| Y2(SO4)3 | 9,6725 | 1,6100 |
| Y2(SO4)3.8H2O | 1020 | 6,6100 |
| Th(SO4)2 | 0,750 | 1,6360 |
| Th(SO4)2.4H2O | 4,740 | 0,82100 |
| Zr(SO4)2.4H2O | 110,618 | 146,539,5 |
СПЕКАНИЕ С СОЛЯМИ СЕРНОЙ КИСЛОТЫ
Спекание и сплавление с сульфатами щелочных и щелочноземельных металлов используют для вскрытия силикатных литиевых минералов. Широкое применение получило спекание концентратов литиевых руд с сульфатом калия. Этот метод одинаково хорошо применим к вскрытию как силикатных, так и фосфатных минералов. Для сподумена реакцию сульфатизации лития можно выразить уравнением
Li2O . Al2O3 . 4SiO2 + К2SO4 = Li2SO4 + К2O . Al2O3 . 4SiO2
Замещение лития с ионным радиусом 0,78Å калием с ионным радиусом 1,33 Å возможно только при соответствующем разрыхлении кристаллической решетки сподумена, которое происходит при высокой температуре. Реакция проходит через стадию образования b-сподумена. Следует отметить, что реакция разложения сподумена сернокислым калием обратима, и для ее практического осуществления необходим большой избыток сульфата калия. Сульфат калия частично можно заменить более дешевым сульфатом натрия.
Спекание осуществляется во вращающихся трубчатых печах с внутренним нагревом за счет сжигания жидкого топлива или газа. Концентрат предварительно измельчают до 0,83 мм и смешивают с сульфатом калия. Температура процесса в зависимости от состава концентрата меняется от 920 до 1150° С. Время пребывания материала в печи от 0,5 до 2 ч.
ТЕХНОЛОГИЧЕСКИЕ СХЕМЫ ВСКРЫТИЯ КОНЦЕНТРАТОВ
Рассмотрим некоторые технологические схемы вскрытия концентратов редких металлов нагреванием с серной кислотой и ее солями.
Вскрытие сподумена
Дробное осаждение фосфатов тория и РЗЭ
Фосфат тория выпадает в осадок из сернокислых растворов при рН = 1,0-1,2; фосфаты РЗЭ - при рН = 2,3. На рис. 28 представлена схема переработки сернокислых растворов с дробным осаждением фосфатов.
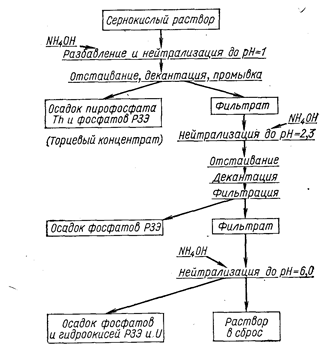
Рис. 28. Технологическая схема переработки сернокислых растворов с дробным осаждением фосфатов тория и РЗЭ.
Выделение тория ведут при pH » l из растворов, нагретых до кипения, при этом 98-99% всего тория переходит в осадок. Наряду с пирофосфатом тория ThP2O7.H2O осаждается, видимо, кислый ортофосфат Th(HPО4)2. Осадок имеет желатинообразный характер. Почти наполовину он состоит из захваченных сульфатов и фосфатов РЗЭ.
В процессе осаждения раствор должен быть разбавлен так, чтобы концентрация РЗЭ в нем не превышала 2%, иначе в осадок выпадают комплексные сульфаты РЗЭ и аммония. При нейтрализации раствора до рН = 2,3 РЗЭ выпадают в осадок в виде кислых фосфатов типа Ln2(HPO4)3. Чтобы уловить оставшиеся в фильтрате РЗЭ и уран, раствор нейтрализуют до рН = 6. Содержание урана в осадке, полученном при этом, составляет примерно 1%.
Несовершенство этой технологической схемы хорошо видно по распределению урана между фракциями (табл. 20).
Таблица 20
Растворимость некоторых сульфатов редких металлов в воде
(индекс внизу — температура, °С)
| сульфат | Растворимость, г/100 г воды | |
| холодной | горячей | |
| Li2SO4 | 33,720 | 31100 |
| Li2SO4.H2O | 41,520 | 38100 |
| BeSO4 | 35,30 | 85,9100 |
| BeSO4.4H2O | 86,315 | 323100 |
| La2(SO4)3 | 2,14225 | 0,69100 |
| Nd2(SO4)3.8H2O | 9,920 | 1,5100 |
| Pr2(SO4)3.8H2O | 16,320 | 4,480 |
| Gd2(SO4)3 | 2,8920 | 2,1840 |
| Gd2(SO4)3.8H2O | 3,2820 | 2,5440 |
| Eu2(SO4)3.8H2O | 2,56320 | 1,9340 |
| Er2(SO4)3 | 430 | 6,5340 |
| Er2(SO4)3.8H2O | 1620 | 6,5340 |
| Dy2(SO4)3.8H2O | 5,07220 | 1,9340 |
| Ho2(SO4)3.8H2O | 8,18120 | 4,5240 |
| Yb2(SO4)3 | 3515 | 4,7100 |
| Yb2(SO4)3.8H2O | 60,30 | 5,8100 |
| Y2(SO4)3 | 9,6725 | 1,6100 |
| Y2(SO4)3.8H2O | 1020 | 6,6100 |
| Th(SO4)2 | 0,750 | 1,6360 |
| Th(SO4)2.4H2O | 4,740 | 0,82100 |
| Zr(SO4)2.4H2O | 110,618 | 146,539,5 |
СУЛЬФАТИЗАЦИЯ СЕРНОЙ КИСЛОТОЙ
Серная кислота, являясь одним из основных продуктов химической промышленности, дешева и доступна. Она - одна из самых активных неорганических кислот. Химическая активность серной кислоты проявляется в ее свойствах, типичных для сильной кислоты, а также в окислительном, водоотнимающем и сульфирующем действии.
При нагреве рудных концентратов с концентрированной серной кислотой происходит разложение исходных минералов с переводом редких металлов в сульфаты.
Концентрированная серная кислота выпускается промышленностью под названием купоросного масла и производится контактным способом. Содержание H2SО4 в купоросном масле 92,5-94%. Это маслянистая жидкость с плотностью 1,83 г/см3. Вязкость 100%-ной H2SО4 при 20°С равна 28 спз.
В зависимости от концентрации H2SО4 в воде температура плавления колеблется в довольно широких пределах (рис. 22). Рассматриваемая система очень склонна к переохлаждению, так что фактически температура замерзания различных кристаллогидратов значительно ниже температуры плавления. Эти данные существенны при решении вопросов хранения H2SО4.
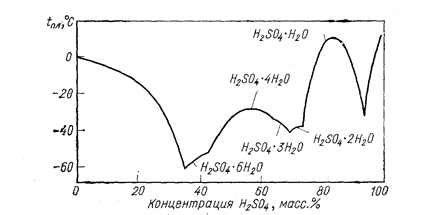
Рис. 22. Температура плавления в системе H2О - H2SО4 (Некрасов Б. В., 1965, рис. VIII—14).
Удельная теплоемкость безводной H2SО4 при 20° С составляет 0,338 кал/(г . град). В литературе имеются подробные таблицы значений теплоемкости растворов H2SО4 в воде в зависимости от концентрации и температуры. При нагревании разбавленного раствора H2SО4 из него отгоняется вода, причем температура кипения повышается до 337°С. В этих условиях в паровую фазу переходит азеотропная смесь, соответствующая 98,3% H2SО4 (рис. 23). Таким образом, если нагревать 100%-ную H2SО4, то она потеряет часть SO3 и превратится в 98,3%-ную. Разбавленные растворы H2SО4 нельзя сконцентрировать испарением выше 98,3%.
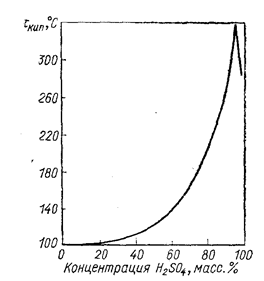
Рис. 23. Температура кипения растворов H2SO4 (Некрасов Б. В., 1965, рис. VIII-16).
Пары H2SО4 диссоциируют по реакции
H2SО4 « SО3 + H2О
Константа равновесия этой реакции зависит от температуры
lg Kp = 5000/T + 1,75lg T – 5,7.10-4T-3,0,
где Kp = pH2O . PSO3 / PH2SO4.
Серную кислоту используют в технологии редких металлов для вскрытия руд Li, Be, РЗЭ, Th, Ti, Zr, Nb, Та.
Вскрытие сподумена можно представить следующим уравнением реакции, происходящей при 150- 200° С:
Li2O . Al2O3 . 4SiO2 + H2SO4 = Li2SO4 + H2O . Al2O3 . 4SiO2
Таким же образом можно вскрыть лепидолитовые, циннвальдитовые и амблигонитовые концентраты.
В технологии бериллия предварительно термически обработанный берилл вскрывают серной кислотой по реакции:
3BeO . Al2O3 . 6SiO2 + 6H2SO4 = 3BeSO4 + Al2(SO4)3 + 6SiO2 + 6H2O
В технологии редкоземельных элементов и тория монацит разлагают нагреванием его с концентрированной серной кислотой по реакции:
2LnPO4 + H2SO4 = Ln2(SO4)3 + 2H3PO4
Th3(PO4)4 + 6H2SO4 = 3Th(SO4)2 + 4H3PO4
В технологии получения титановых белил ильменит вскрывают серной кислотой по реакции:
FeTiO3 + 3H2SO4 = Ti(SO4)2 + FeSO4 + 3H2O
FeTiO3 + 2H2SO4 = TiOSO4 + FeSO4 + H2O
В технологии циркония серную кислоту можно использовать для вскрытия бадделеитовых руд по реакции:
ZrO2 + 2H2SO4 = Zr(SO4)2 + 2H2O
Серную кислоту применяют также для получения обезжелезненного циркона, необходимого для стекольной и керамической промышленности. Процесс основан на том, что циркон не разлагается серной кислотой, в то время как примесь железа растворяется с поверхности циркона. Естественно, что очистка от железа зависит от степени измельчения циркона.
Серной кислотой можно вскрывать титано-ниобиевые минералы, такие, как пирохлор, лопарит и некоторые другие. Процесс идет при 150-200° С.
Термодинамический анализ реакций вскрытия рудных минералов серной кислотой весьма затруднителен из-за отсутствия необходимых данных. Кроме того, даже если удается рассчитать DG° процесса и тем самым константу равновесия реакции, выход продукта реакции вычислить исключительно сложно, так как зависимость между активностью и концентрацией в реальных системах, как правило, неизвестна.
Часто перед реакцией с H2SO4 рудный концентрат подвергают специальной термической обработке для перевода минералов в более реакционноспособную форму. При этом меняется термодинамическая характеристика вскрываемого материала и увеличивается его поверхность.
Так, сподумен предварительно подвергают процессу декрипитации при температуре 1000-1100° С. При этом резко изменяются свойства кристаллов: исчезает двойное лучепреломление, показатель преломления понижается с 1,65 до 1,52, а плотность - с 3,148 до 2,380 г/см3.
При нагревании сподумен становится мутным, белым и хрупким, по внешнему виду напоминающим мел. При температуре около 1000°С он растрескивается с сильным увеличением объема, расщепляясь при этом на отдельные пластинки. Эти пластинки отделяются от агрегата.
В целях обогащения руду крупнее 0,2 мм обжигают при 1000-2000° С в течение 1-2 ч. Полученный продукт подвергают избирательному измельчению и классификации. Класс -0,2 мм обожженной руды является концентратом. Термическое обогащение целесообразно только при определенном минеральном составе сырья. Наличие в руде альбита, флюорита, кальцита, слюды, которые также декрипитируются, значительно ухудшает качество концентрата.
Декрипитацию руды обычно осуществляют в трубчатой вращающейся печи. Корпус печи изготовляют из стали. Первую половину длины печи выкладывают кирпичом, устойчивым к истиранию, затем огнеупорным кирпичом. Печь обогревается газом или нефтью. Руда движется противотоком к газовому потоку. Длина печи 10-15 м, диаметр 1,2 м. Скорость вращения 1 об/мин. Производительность такой печи в зависимости от влажности руды составляет 1-2 т/ч. Переход a-сподумена в b-форму достигает 99-100%. Обожженный материал подается во вращающийся .стальной цилиндр, охлаждаемый снаружи водой: Там температура руды снижается до 95-120°С. Затем руда измельчается на валковой мельнице до 0,074 мм и поступает на сульфатизацию.
Берилловый концентрат перед сернокислотным вскрытием также подвергают специальной термической обработке. Она состоит в том, что берилл плавят при 1700° С и гранулируют, выливая расплав в воду. Необходимо обеспечить при этом резкое изменение температуры в объеме минерала, иначе берилл рекристаллизуется; гранулы размером более 12,5 мм отсеивают и возвращают в печь. После такой обработки полученный продукт вскрывается серной кислотой на 50-60%. Чтобы увеличить извлечение бериллия из такого плава, его нагревают до 900° С. Полагают, что при этом выделяется окись бериллия из твердого раствора окиси бериллия в кремнеземе, полученного в результате термической обработки. Из такого материала удается извлекать сернокислотным вскрытием до 95% бериллия.
Берилловый концентрат плавят в трехфазной электрической печи с графитовой футеровкой. Расплавленный берилл обладает хорошей электропроводностью. На подине печи располагают небольшое количество концентрата. Затем в него погружают электроды и добавляют постепенно новые порции берилла до образования в печи расплавленной ванны. Расплав выливают в бак с водой, причем струю плава разбивают сильной струёй воды из форсунки высокого давления. Небольшое количество расплавленной массы оставляют в печи для того, чтобы иметь необходимое исходное сопротивление для плавки следующей партии.
Для термообработки полученного плава применяют вращающиеся, обогреваемые газом печи.
Необходимо отметить, что термические методы изменения реакционной способности минералов основаны на изменении их структуры или на их разрушении. Нагрев с последующим медленным охлаждением, не вызывающий таких изменений, наоборот, приводит к совершенствованию поверхности кристаллов, уменьшению дефектов, выравниванию микротрещин и т. д., в результате чего устойчивость минералов повышается.
Вскрытие рудных концентратов нагреванием их с концентрированной серной кислотой, как правило, имеет в своей основе топохимические реакции. Кинетика процесса определяется диффузионными процессами подвода серной кислоты к непрореагировавшей поверхности минерала через слой продуктов реакции. Скорость процесса и степень превращения вещества связаны уравнениями
dq/dt = a [(1-q)⅓] / [1-(1-q)⅓] (23)
1- ⅔q /- (1-q)⅔ = a’t
где q - степень превращения исходного вещества в продукт (в долях единицы); t - время; а, а’ - константы, зависящие от свойств реагентов и условий процесса.
Скорость взаимодействия веществ зависит от поверхности их контакта. Поверхность, на которой происходит реакция, равна полной поверхности твердой фазы. В начале процесса поверхность измельченного материала пропорциональна квадрату диаметра зерна. Удельную поверхность (см^/г} монодисперсного материала можно рассчитать по формуле
s = kg⅔n⅓r⅔ (24)
где k - коэффициент, зависящий от формы зерен (для шара он равен 4,85); g - навеска, г; n - число зерен в 1 г; r - плотность вещества, г/см3.
Измельчение материала ведет к качественному изменению его реакционной способности. При этом изменяется энергия Гиббса на величину DG°= sDs, где s - поверхностное натяжение; Ds - изменение поверхности. Следует учитывать, что увеличение поверхности ведет к возрастанию относительного количества поверхностных дефектов, облегчающих проведение химической реакции.
Вместе с тем переизмельчение вредно сказывается на процессе, так как при этом увеличивается унос пыли и возрастает плотность полученного спека, что отрицательно сказывается при выщелачивании продукта. Концентраты при сернокислотном методе вскрытия измельчают, как правило, до 0,063 мм.
Очень важна в технологии вскрытия концентратов редких металлов классификация измельченного материала. Выгодно иметь монодисперсный материал. Это существенно влияет на производительность печей и реакторов, применяемых для вскрытия концентратов.
Весьма важна равномерность смешивания реагентов. От этого в значительной степени зависит получение материала, хорошо транспортируемого по длине аппарата, не образующего настылей. В зависимости от требований к размерам гранул или плотности пульпы измельченные концентраты смешивают с концентрированной серной кислотой в специальных грануляторах, смесителях со шнековыми мешалками, на бегунах и т. д.
Мощным фактором интенсификации всех гетерогенных процессов является температура. При этом ускоряются как химические, так и диффузионные процессы. Следует учитывать, что при сульфатизации некоторых рудных концентратов в результате химической реакции образуется вода, происходит понижение концентрации H2SO4 и, как следствие, уменьшение ее температуры кипения. Поэтому в процессе сульфатизации весьма важен интенсивный подвод тепла, обеспечивающий своевременное испарение воды.
В большинстве процессов вскрытия концентратов редких металлов серной кислотой образуются твердые продукты, структура и плотность которых в значительной степени зависят от температуры, а именно структура и плотность слоя продуктов реакции в основном определяют скорость переноса серной кислоты к поверхности реакции.
В случае процессов, осложняемых образованием при определенной температуре плотных пленок на поверхности твердой фазы, резко замедляющих и даже прекращающих процесс, температурный коэффициент x= kt+10/kt может быть меньше 1. Как правило, температурный режим процесса устанавливается эмпирически. При вскрытии серной кислотой максимальная температура лимитируется температурой кипения H2SO4. Необходимо учитывать повышение концентрации SO3 в газовой фазе с ростом температуры.
В некоторых процессах нецелесообразно повышать температуру из-за образования в этих условиях нерастворимых соединений редких металлов. Так, в процессе вскрытия монацита сульфатизацией при перегревах выше 230-250° С образуется практически нерастворимый в сернокислых растворах пирофосфат тория.
Существенно влияет на процесс сернокислотного вскрытия скорость перемешивания. При вскрытии во вращающихся печах перемешивание не только приводит к обновлению поверхности реагирующих компонентов, но и препятствует образованию нaстылей на стенках печи.
В настоящее время наклонная вращающаяся печь является основным аппаратом для непрерывного процесса вскрытия руды серной кислотой. Размеры печи, как правило, стандартны. Так, вскрытие сподумена на заводе в Миннеаполисе (США) проводят во вращающейся печи длиной 17,9 м и диаметром 0,915 м. Меняя число оборотов и угол наклона, можно изменить продолжительность пребывания частиц в печи. Для различных процессов эта продолжительность различна.
Вскрытие берилла проводят в обогреваемых стальных барабанах. Пульпу 93%-ной H2SO4 и берилла тонкой струйкой подают на стенки аппарата, обогреваемого газом до 250-300° С. Реакция протекает очень быстро.
Интенсификации процесса сульфатизации способствуют все мероприятия, ведущие к улучшению условий теплопередачи» т. е. к ускорению нагрева шихты. По этой причине в определенных условиях через печи непрерывного действия выгоднее пропускать материал тонким слоем, но с большой скоростью, так как теплопроводность шихты невелика.
Применение концентрированной H2SO4 позволяет в качестве материала печи использовать сталь, не защищенную футеровкой.
В случае периодического процесса аппаратом для вскрытия является обогреваемый реактор с мешалкой, выполненный из высокоуглеродистого, высококремнистого чугуна или стали. В процессе сернокислотного вскрытия получаются весьма вязкие пульпы.
В некоторых случаях предусматривается проведение вскрытия и последующее выщелачивание в одном аппарате. В этом случае аппарат должен быть футерован кислотоустойчивой плиткой.
Дата: 2019-03-05, просмотров: 3113.