Содержание железа в клетках определяется соотношением скоростей его поступления, использования и депонирования и контролируется двумя молекулярными механизмами. Скорость поступления железа в неэритроидные слетки зависит от количества белков-рецепторов трансферрина в их мембране. Избыток железа в клетках депонирует ферритин. Синтез шоферритина и рецепторов трансферрина регулируется а уровне трансляции этих белков и зависит от содержания железа в клетке.
На нетранслируемом 3'-конце мРНК рецептора трансферрина и на нетранслируемом 5'-конце мРНК апоферритина имеются шпилечные петли - железочувствительные элементы IRE (рис. 3 и 4). Причём мРНК рецептора трансферрина имеет 5 петель, а мРНК апоферритина - только 1.
Эти участки мРНК могут взаимодействовать с регуляторным IRE-связывающим белком. При низких концентрациях железа в клетке IRE-связывающий белок соединяется с IRE мРНК апоферритина и препятствует присоединению белковых факторов инициации трансляции (рис. 3, А). В результате этого снижаются скорость трансляции апоферритина и его содержание в клетке. Вместе с тем при низких концентрациях железа в клетке IRE-связывающий белок связывается с железочувствительным элементом мРНК рецептора трансферрина и предотвращает её разрушение ферментом РНК-азой (рис. 4, А). Это вызывает увеличение количества рецепторов трансферрина и ускорение поступления железа в клетки.
При повышении содержания железа в клетке в результате его взаимодействия с IRE-связывающим белком происходит окисление SH-групп активного центра этого белка и снижение сродства к железочувствительным элементам мРНК. Это приводит к двум последствиям:
· во-первых, ускоряется трансляция апоферритина (рис. 3, Б);
· во-вторых, IRE-связывающий белок освобождает шпилечные петли мРНК рецептора трансферрина, и она разрушается ферментом РНК-азой, в результате снижается скорость синтеза рецепторов трансферрина (рис. 4, Б). Ускорение синтеза апоферритина и торможение синтеза рецепторов трансферрина вызывают снижение содержания железа в клетке.
В целом эти механизмы регулируют содержание Fe в клетках и его использование для синтеза железосодержащих белков.
Нарушения метаболизма железа
Железодефицитная анемия может наблюдаться при повторяющихся кровотечениях, беременности, частых родах, язвах и опухолях ЖКТ, после операций на ЖКТ. При железодефицитной анемии уменьшается размер эритроцитов и их пигментация (гипохромные эритроциты малых размеров). В эритроцитах уменьшается содержание гемоглобина, понижается насыщение железом трансферрина, а в тканях и плазме крови снижается концентрация ферритина. Причина этих изменений - недостаток железа в организме, вследствие чего снижается синтез гема и ферритина в неэритроидных тканях и Hb в эритроидных клетках.
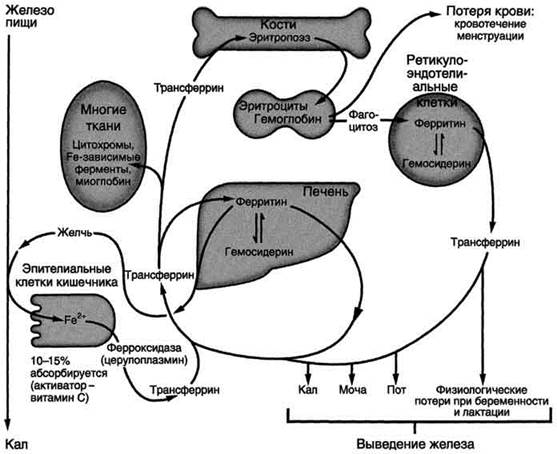
Рис. 2. Метаболизм железа в организме.
Гемохроматоз. Когда количество Fe в клетках превышает объём ферритинового депо, железо откладывается в белковой части молекулы ферритина. В результате образования таких аморфных отложений избыточного Fe ферритии превращается в гемосидерин. Гемосидерин плохо растворим в воде и содержит до 37% железа Накопление гранул гемосидерина в печени, поджелудочной железе, селезёнке и печени приводит к повреждению этих органов - гемохроматозу. Гемохроматоз может быть обусловлен наследственным увеличением всасывания Fe в кишечнике, при этом содержание Fe в организме больных может достигать 100 г. Это заболевание наследуется по аутосомнорецессивному типу, причём около 0,5% европеоидов гомозиготны по гену гемохроматоза. Накопление гемосидерина в поджелудочной железе приводит к разрушению р-клеток островков Лангерганса и, как следствие этого, к сахарному диабету. Отложение гемосидерина в гепатоцитах вызывает цирроз печени, а в миокардиоцитах - сердечную недостаточность. Больных наследственным гемохроматозом лечат регулярными кровопусканиями, еженедельно или один раз в месяц в зависимости от тяжести состояния больного.
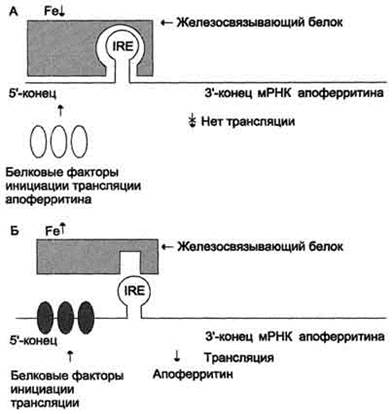
| Рис. 3. Регуляция синтеза апоферритина. А - при снижении содержания железа в клетке железосвязывающий белок обладает высоким сродством к IRE и взаимодействует с ним. Это препятствует присоединению белковых факторов инициации трансляции к мРНК, кодирующей апоферритин, и синтез апоферритина прекращается; Б - при повышении содержания железа в клетке оно взаимодействует с железосвязывающим белком, в результате чего снижается сродство этого белка к IRE. Белковые факторы инициации трансляции присоединяются к мРНК, кодирующей апоферритин, и инициируют трансляцию апоферритина. |
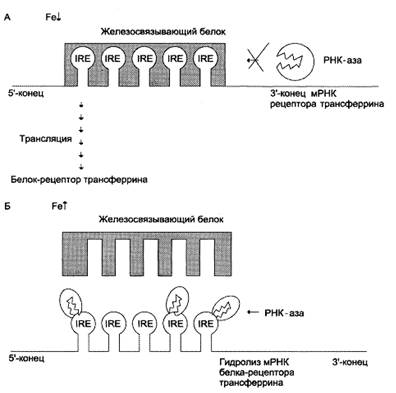
| Рис. 4 Регуляция синтеза рецептора трансферрина. А – при низком содержании в клетке железодефицитный белок обладает высоким сродством к IRE мРНК, кодирующей белок рецептор трансферрина. Присоединение железосвязывающего белка к IRE мРНК предотвращает ее разрушение и РНК-азой и синтез белка-рецептора трансферрина продолжается; Б – при высоком содержании железа в клетке сродство железосвязывающего белка к IRE снижается, и мРНК становится доступной для действия РНК-азы, которая ее гидролизует. Разрушение мРНК ведет к снижению синтеза белка-рецептора трансферрина. |
К гемохроматозу могут привести частые переливания крови, в этих случаях больных лечат препаратами, связывающими железо.
II Цель деятельности студентов на занятии
Студент должен знать:
1. Железо, его роль в организме;
2. В каких процессах участвует железо;
3. Как осуществляется всасывание железа в кишечнике;
4. Ферритин – депо железа в организме;
Дата: 2019-02-25, просмотров: 408.