В практике бурения скважин используются разнообразные технологические приемы приготовления буровых и технологических растворов.
Наиболее простая технологическая схема включает: емкость для приготовления компонентов бурового раствора, которая может быть оснащена механическими и гидравлическими перемешивателями; гидроэжекторный смеситель, оснащенный загрузочной воронкой и шиберным затвором; центробежный или поршневой насос (обычно один из подпорных насосов) и манифольды.
С использованием этой схемы приготовление бурового раствора осуществляется следующим образом. В емкость заливают расчетное количество дисперсионной среды (обычно 10-40 м3) и с помощью насоса по нагнетательной линии с задвижкой подают через гидроэжекторный смеситель по замкнутому циклу. Мешок с порошкообразным материалом передвижным подъемником или транспортером подается на площадку емкости, и порошок высыпается в воронку, откуда с помощью гидровакуума он подается в камеру гидроэжекторного смесителя, где смешивается с дисперсионной средой. Суспензия сливается в емкость, где она тщательно перемешивается механическим и гидравлическим перемешивателем. Скорость подачи материала в камеру эжекторного смесителя регулируют шиберной заслонкой, а величину вакуума в камере – сменными твердосплавными насадками.
Круговая циркуляция прекращается лишь тогда, когда смешано расчетное количество компонентов и основные технологические показатели свойств раствора близки к расчетным. Если раствор приготавливают впрок, то его готовят порционно, а порции откачивают в другие емкости циркуляционной системы, либо в специальные запасные мерники.
Утяжеление бурового раствора утяжелителями и обработку другими химическими реагентами осуществляют аналогично после приготовления порции исходной базовой системы.
Химическую обработку по управлению свойствами бурового раствора производят во время циркуляции за один или несколько циклов. Время одного цикла циркуляции находят по формуле
Т= Va / Q,
гдеТ – время одного цикла циркуляции раствора (мин), Va – активный или суммарный объем циркулирующей жидкости на поверхности и в скважине (м3), Q – подача (производительность) насосов (м3/мин).
Циркуляционная система. ЦС включает наземные устройства и сооружения, обеспечивающие промывку скважин путем принудительной промывки бурового раствора по замкнутому циклу: насос-скважина (забой)- насос. Устройства и сооружения ЦС выполняют следующие функции: приготовление и очистка растворов, прокачивание и оперативное регулирование свойств раствора, хранение и др. В состав ЦС входят: насосы, всасывающие и нагнетательные линии, рабочие емкости и емкости для хранения раствора, оборудование и емкости для приготовления раствора, желоба, отстойники, система очистки, емкости для хранения жидких и сухих реагентов, КИП и др. ЦС монтируют из отдельных блоков, это упрощает ее монтаж и техническое обслуживание. Важнейшее требование к ЦС – качественное приготовление и очистка растворов, при этом достигаются высокие скорости бурения и предотвращаются многие аварии и осложнения в скважине. В систему очистки входят: вибросита, песко- и илоотделители, центрифуги.
Потребное количество раствора для заканчивания скважин. Основным директивным документом, используемым при выборе необходимого объема раствора, является «Правила безопасности в нефтяной и газовой промышленности» (ПБ 08-624-03, 05.06.03, №56).
Потребное количество бурового раствора для заканчивания скважины ( V р) находим:
V р= V скв+ V пов+ V пот;
Объем раствора в скважине, V скв= V кол+ V н. с.;
Объем раствора в колонне V кол=0,785* d 2 *Н; где, d = D н-2δ - внутренний диаметр колонны; D н- наружный диаметр колонны; δ – толщина стенки колонны; Н – глубина спуска колонны (см. Конструкцию скважины)
Объем раствора в необсаженном интервале (новый ствол) V н. с.=0,785*( D д)2*( L -Н)К; где D д – диаметр долота; К – коэф. кавернознозности; L – проектная глубина скважины (см. Конструкцию скважины);
V пов – объем раствора на поверхности в ЦС; V пов= V отс+ V зап= V отс+2 V скв; V отс – объем раствора в отстойнике; V зап – запасной объем раствора на поверхности (принимается равным двум объемам скважины, см. «ПБ в Н и Г промышленности»).
V пот – объем раствора на потери при углублении скважины. Объем раствора на потери при углублении скважины зависит от геолого-технических условий бурения. Потеря раствора складывается из потерь на очистных устройствах со шламом, испарения, фильтратоотдачи, поглощений, непредвиденных потерь. При прохождении набухающих глин, поглощениях и др. объем раствора на потери определяется исходя из опыта бурения на данном интервале.
При расчетах потребного количества (объема) бурового раствора принимаются:
- объем отстойника (объем раствора в отстойнике) V отс=(40-50) м3
- объем рабочего мерника V м=(50-60) м3 (необходимое количество мерников должно соответствовать расчетному объему раствора на поверхности)
- при сохранении устойчивости ствола скважины коэффициент кавернозности К=1,05-1,10, при нарушении устойчивости К=1,2-1,4;
- объем раствора на потери V пот≈(1-3) V н.с.
ТЕМА5. 5.Межчастичные взаимодействия в буровых растворах на водной основе. Силы и связи, ответственные за свойства буровых растворов. Управление показателей бурового раствора. Представления супрамолекулярной химии в буровых растворах.
Одним из важнейших свойств материи является способность к взаимодействиям. Энергия и сила взаимодействия зависит от многих и различных факторов, но всегда обратно пропорционально расстоянию между действующими телами или частицами.
В природе известны следующие типы взаимодействий:
- сильные и слабые, проявляются на уровне нейтронов, протонов, электронов и др. элементарных частиц и изучаются ядерной физикой и физикой высоких энергий. действуют на расстояниях менее 10-5 нм;
- электромагнитные, проявляются на уровне атомно-молекулярных частиц, родоначальники всех межмолекулярных взаимодействий;
- гравитационные, проявляются на уровне космических масштабов.
Электромагнитные межмолекулярные взаимодействия определяют свойства твердых тел, жидкостей и газов, поведение частиц в растворах, протекание химических реакций, а также свойства дисперсных систем.
Согласно современным представлениям все межмолекулярные силы имеют электростатическую природу. Если заряды находятся в статике, между ними возникает кулоновское взаимодействие, в динамике – электромагнитное. Межатомные и межмолекулярные взаимодействия возникают всегда, даже между неполярными частицами за счет непрерывно флуктуирующего распределение заряда внутри и вокруг атомов. Несмотря на фундаментальную электростатическую природу межмолекулярных взаимодействий, удобнее их разделять на группы. Термины ионные, металлические и водородные связи, вандерваальсовы и гидрофобные взаимодействия хоть и кажутся различными, на самом деле имеют электростатическую природу. Для удобства, межмолекулярные взаимодействия группируют на слабые и сильные, короткие и дальние. Такое разделение может привести к путанице, хотя, в некоторых случаях, например при сравнении взаимодействий по величине, это может быть очень удобно.
Рассчитать силу или энергию взаимодействия между частицами глинистой фазы или между молекулами или ионами в системах, с динамически изменяющимся составом, буровых растворах задача сложная. С другой стороны, владея этими данными сложно управлять свойствами и показателями бурового раствора.
Свойства и показатели водных буровых растворов, как и всех водных дисперсных систем, зависят от полярности молекул воды и формирования ими водородных связей.
Буровой раствор представляет с собой многофазную полидисперсную систему, состоящую из дисперсионной среды (непрерывной фазы), в которой распределены нерастворимая дисперсная (диспергированная) фаза и реагенты для управления свойствами и показателями раствора.
Все межмолекулярные (межчастичные) взаимодействия в буровых растворах происходят между молекулами воды, молекулами воды и компонентами, а также молекулами или ионами компонентов в водной среде. Согласно современным представлениям, все взаимодействия в буровых растворах относятся к электростатическим (электромагнитным) и проявляются на уровне атомно-молекулярных частиц, которые являются родоначальниками всех межмолекулярных взаимодействий.
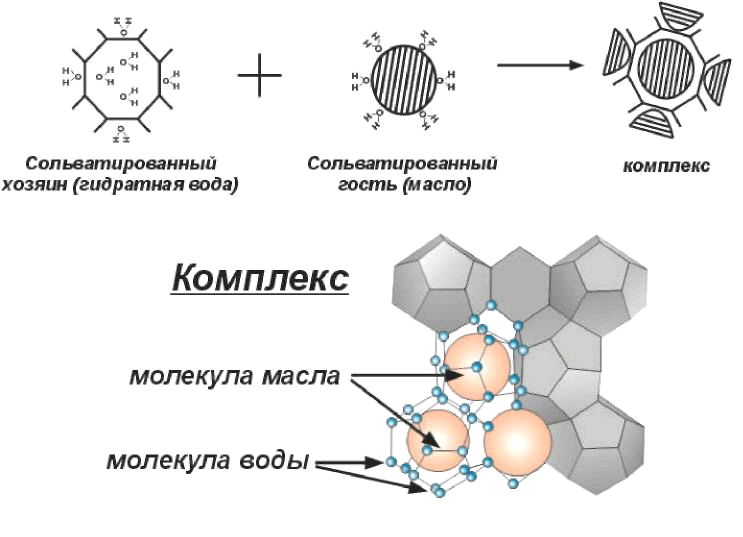
Буровые растворы, согласно представлениям супрамолекулярной химии, целесообразнее рассматривать как супраструктуры из молекулярных полиэдрических ассоциатов, образованных водородными связями между молекулами воды (рис.6).
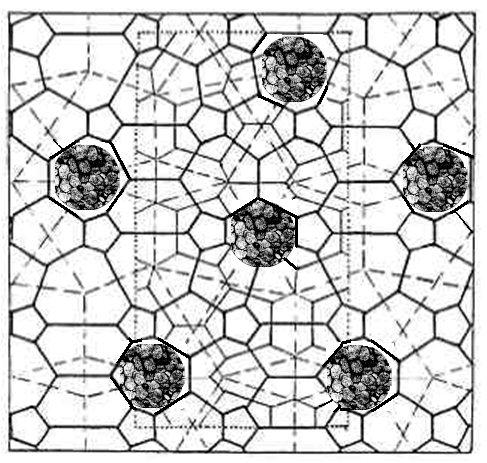
а) б)
Рисунок 6 - Полиэдрический водный каркас в глинистом растворе: а – вид на плоскости; б – пространственный вид (стрелками показаны молекулы воды, формирующие хозяйский каркас и молекулы гостей, заполняющие полости каркаса).
Межмолекулярные взаимодействия в буровых растворах для удобства могут быть группированы как электростатические, вандерваальсовые, гидрофобные, а также водородные связи – этим и занимается супрамолекулярная химия.
К электростатическим принято относить взаимодействия, возникающие между диполями (так называемые диполь-дипольные), между ионом и диполем (ион-дипольные) и между ионами (ион-ионные).
Диполь-дипольные взаимодействия возникают между полярными молекулами воды, воды и спирта, воды и неионного полимера и т.д. Кажущееся, беспорядочное расположение молекул воды, в объёме раствора, является на самом деле строго упорядоченным, благодаря ориентационным силам (табл. 4). Между молекулами воды существуют ориентационные (силы Кисома), индукционные (силы Дебая) и дисперсионные силы (силы Лондона).
Таблица 4 - Относительное значение составляющих межмолекулярных сил
| Вещество | Ориентационные силы, % | Индукционные силы, % | Дисперсионные силы, % |
| H2O | 76,9 | 4,1 | 19,0 |
| NH3 | 45,0 | 5,3 | 49,7 |
| HCl | 14,4 | 4,2 | 81,4 |
| HBr | 3,3 | 2,2 | 94,5 |
| HI | 0,1 | 0,4 | 99,5 |
| CH4 | 0 | 0 | 100 |
Взаимодействия между молекулами воды, с спиртами и с неионными полимерами протекает с сохранением гибких водородных связей в формируемых супраструктурах, поэтому управление свойствами и технологическими показателями буровых растворов с их использованием производится без затруднений.
Помимо полярных групп, вокруг которых вода гидратирована, в спиртах и полимерах имеются неполярные углеводородные цепи, формирующие вокруг себя из молекул воды ажурные каркасы, комплементарно сочетаясь с полостями этих каркасов. Взаимодействие между неполярными углеводородными цепями и молекулами воды, формирующими полости водных каркасов, относятся к гидрофобным и дисперсионным (см. ниже).
Ион-дипольное взаимодействие возникает между ионами электролитов и полиэлектролитов с молекулами воды и полярными группами неионных соединений.
Энергия ион-дипольного взаимодействия ионов с молекулами воды зависит от заряда и размера иона. При одинаковом заряде ионов энергия взаимодействия молекул воды с катионами выше, чем с анионами. Энергия взаимодействия между молекулами воды и полиэлектролита возрастает по мере увеличения молекулярной массы последнего.
В результате суммарного взаимодействия – ион-дипольного и гидрофобного эти полиэлектролиты оказывают упорядочивающее действие на молекулы воды, которое выражается в значительном увеличении вязкости.
Ион-ионное взаимодействие в водной среде сводится к ион-дипольному взаимодействию, так как любое взаимодействие в водной среде происходит при посредничестве молекул воды.
Электростатические взаимодействия оказывают существенное влияние на формирование водородных связей: свойства этих связей, такие как гибкость и прочность, зависят от электростатических взаимодействий.
Гидрофобное взаимодействие (гидрофобный эффект) – это кажущееся притяжение между неполярными молекулами, проявляющееся при их попадании в воду. На макроуровне гидрофобный эффект проявляется в том, что неполярные жидкости не смешиваются с водой, а их эмульсии типа вода-масло неустойчивы и стремятся к расслоению. Гидрофобный эффект является результатом выталкивания неполярных молекул из водной среды за счёт дипольных взаимодействий между молекулами воды. Это выглядит как притяжение между неполярными молекулами углеводородов.
Гидрофобное взаимодействие – важнейший фактор самоорганизации в водных средах. Ориентационные и гидрофобные взаимодействия оказывают решающее воздействие при самосборке супраструктур из водных молекул в буровых растворах. Они ответственны за формирование супраструктур из молекул воды и неполярных молекул.
Водородные связи, возникающие между молекулами воды, определяют её физические и химические свойства. Н-связь в растворах отвечает за структурно-реологические, тиксотропные, фильтрационные свойства. Н-связи между молекулами воды формируют упорядоченные ажурные супраструктуры.
Геометрия и прочность водородных связей и формируемые ими супрамолекулярные структуры в буровых растворах очень разнообразны. Например, супраструктуры из молекул воды формируются полимером, в виде ассоциаций взаимодействующих с полярными группами с одной стороны и углеводородными неполярными цепями с другой стороны, и/или ионами электролитов в виде гидратов и координационных связей, и/или глинистой фазой в виде сплошных водных каркасов и т.д. По поведению бурового раствора, структурно-реологическим и фильтрационным показателям можно предугадать состояние рабочей жидкости, определить превалирование той или иной супраструктуры. Другими словами, по технологическим показателям можно определить причины их изменения, а также установить, чьи супраструктуры (полимера, глинистой фазы, электролитов, концентрации твердой фазы и т.д.) преобладают и влияют на состояние и свойства бурового раствора. Решение о дальнейшей химической обработке бурового раствора по управлению его технологическими показателями принимают после выяснения всех условий изменения технологических показателей рабочей жидкости.
Уменьшение количества и прочности водородных связей приводит к образованию супраструктур с гибкими связями, которые способны к самосборке благодаря ориентационным и гидрофобным взаимодействиям. Буровые растворы с гибкими водородными связями легче управляются в процессе бурения. Буровые растворы с жёсткими и прочными водородными связями более сложны в управлении.
В формировании водородных связей и их разрушении ориентационные силы играют важнейшую роль. Такие свойства водородных связей как гибкость, прочность и др., прежде всего, зависят от ориентационных сил. Добавка любых реагентов приводит к изменению полярности молекул воды, что в конечном счете приводит к изменению прочности водородных связей между молекулами воды в супраструктурах.
Дата: 2019-02-25, просмотров: 370.