Массовое число - А - суммарное число нейтронов и протонов в ядре данного атома.
Атомный номер Z равен числу протонов, входящих в состав ядра. Очевидно, число нейтронов в атоме равно A-Z. Число Z еще называют зарядовым числом.
Ядра с одинаковыми зарядовыми числами Z, но различными массовыми А называются изотопами. В природе встречается около 300 изотопов и еще около 1000 изотопов получены искусственным путем. Примеры К39 19 ; К40 19 ; К41 19 .
Ядра с одинаковыми массовыми числами (А), но разными зарядовыми (Z) называются - изобарами. Примеры Be 10 4 ; B 10 5 ; C 10 6.
Строение электронных оболочек атома подчинено строгому физическому закону, согласно которому в одном атоме не может быть двух электронов, находящихся в одном и том же энергетическом состоянии, которое определяется четырьмя параметрами:
1) энергией связи электрона в атоме;
2) направлением вращения электрона вокруг своей оси;
3) формой орбиты;
Положением орбиты в пространстве.
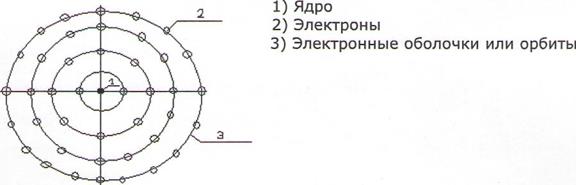
Рис 2 - строение электронных оболочек атома
Согласно этому принципу на ближайшей к ядру К-оболочке может располагаться не более 2 электронов, на следующей L-оболочке - 8 электронов, на М-оболочке - 18, на N-оболочке - 32 электрона и т.п. Отметим, что с увеличением Z идет последовательное заполнение электронных оболочек ( N = 2 n 2 ) . Химические свойства атомов определяются структурой электронных, в первую очередь внешних оболочек.
Явление радиоактивности
Энергия связи электрона в атоме тем меньше, чем на более удаленной от ядра оболочке он находится. Если один или несколько электронов оторвать от электронной оболочки, приложив соответствующую энергию, произойдет ионизация атома, который при этом из-за созданного дефицита отрицательно заряженных электронов станет положительно заряженным ионом.
Если атом, наоборот, присоединяет электрон, которого ранее не доставало на него внешней электронной оболочке, он превращается в отрицательно заряженный ион. Первый вариант взаимодействия легче всего происходит с атомами, у которых на внешней оболочке находится 1-3 электрона, а второй вариант-с атомами у которых на внешней оболочке 5-7 электронов.
Если энергия внешнего воздействия не достаточна для ионизации атома, электрон может быть переведен на более удаленную от ядра оболочку. Такой атом называется возбужденным. При переходе в невозбужденное состояние, т.е. когда освободившееся вакантное место на электронной оболочке занимает другой электрон, избыток энергии, равный энергии возбуждения, испускается в виде одного или нескольких квантов фотонного излучения.
Устойчивость атомного ядра обусловлена действующими между нуклонами ядерными силами притяжения. Особенность этих сил состоит в том, что они очень высоки на крайне коротких расстояниях - порядка размера ядра (10-13) - и во много раз превосходят кулоновские силы отталкивания, действующие между заряженными частицами, входящие в состав ядра - протонами.
Эта особенность ядерных сил обуславливает исключительно плотную «упаковку» протонов и нейтронов в ядре. Энергия связи частиц в ядрах составляет несколько миллионов электрон-вольт (электрон-вольт (эВ) - единица энергии, используемая в атомной физике. 1эВ - кинетическая энергия, приобретаемая электроном при прохождении разности потенциалов равной 1В), что от несколько сотен до несколько тысяч раз превышает энергию связи электрона в атоме. С увеличением атомного номера элемента Z , т.е. с увеличением суммарного заряда ядра, все более начинает проявляться разрыхляющее действие протонов, вследствие чего в ядрах тяжелых атомов наблюдается избыток нейтронов над протонами, это уменьшает силу ядерных притяжений и увеличивает эффект кулоновских сил отталкивания. У элементов с Z > 82 ядерные силы притяжения уже не способны обеспечить полную устойчивость ядер. В результате происходят процессы их внутренней перестройки. Процесс спонтанного перехода атомных ядер из менее устойчивого состояния в более устойчивое называется радиоактивностью.
Еще одно определение.
Радиоактивностью называется самопроизвольное превращение неустойчивых изотопов одного химического элемента в изотоп другого элемента, сопровождающееся испусканием элементарных частиц или ядер. (т.е. 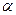 -,
-, 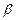 - и
- и 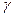 - излучением).
- излучением).
При этом различают 2 вида радиоактивности - естественную, наблюдающуюся у нестабильных изотопов атомов, существующих в природе и искусственную, наблюдающуюся у изотопов, образующихся в результате ядерных реакций.
Процесс естественного, самопроизвольно происходящего радиоактивного превращения называется радиоактивным распадом или просто распадом. Ядра, испытывающие распад, называются радионуклидами. Исходное атомное ядро называется материнским, а ядро, образовавшееся в результате распада, называется дочерним.
Основной закон радиоактивного распада. Период полураспада. Среднее время жизни радионуклида.
Радиоактивный распад происходит со строго определенной скоростью, характерной для каждого данного элемента.
Время, за которое исходное число радиоактивных ядер в среднем уменьшается вдвое, называется периодом полураспада (Т). Периоды полураспада различных ядер колеблются в очень широких пределах. Например, период полураспада урана-238 ( 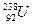 ) составляет 4,5 млрд. лет, радия-236(
) составляет 4,5 млрд. лет, радия-236( 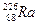 ) - 1620 лет, радона-222 (
) - 1620 лет, радона-222 ( 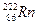 )- 3,8 суток. Более того, периоды полураспада у изотопов одного и того же элемента могут сильно различаться, например, у радия 226- 1630 лет, а у
)- 3,8 суток. Более того, периоды полураспада у изотопов одного и того же элемента могут сильно различаться, например, у радия 226- 1630 лет, а у 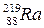 - 0,001 с.
- 0,001 с.
Поскольку отдельные радиоактивные ядра распадаются независимо друг от друга, то закон радиоактивного распада носит статистический характер и имеет вид:
N = 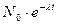 где N0 - число радиоактивных ядер в момент времени, принятый за начало отсчета, т.е. при t = 0,
где N0 - число радиоактивных ядер в момент времени, принятый за начало отсчета, т.е. при t = 0,
N - число нераспавшихся ядер в момент времени t;
знак «-» говорит об убывании числа ядер;
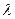 - постоянная для данного радиоактивного вещества величина, называемая - постоянная радиоактивного распада.
- постоянная для данного радиоактивного вещества величина, называемая - постоянная радиоактивного распада.
Между постоянной радиоактивного распада и периодом полураспада существует простая связь:
Т = 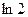 /
/ 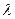 =
= 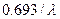 Среднее время жизни радиоактивного ядра - ť, есть величина, обратная постоянной радиоактивного распада, т.е.
Среднее время жизни радиоактивного ядра - ť, есть величина, обратная постоянной радиоактивного распада, т.е.
ť =1/ λ
Дата: 2019-02-25, просмотров: 445.