Круговорот азота
Азот (от греч. azoos - безжизненный). Газообразный азот, составляющий 78 % объёма земной атмосферы, не может непосредственно использоваться живыми организмами. В свободном состоянии он обладает химической инертностью, а соединяясь с другими элементами, весьма активен. Организмы нуждаются в различных химических формах азота для образования белков и генетически важных нуклеиновых кислот (ДНК"). Большинству зеленых растений требуется азот в форме нитрат - ионов (N03-) и ионов аммония (NН4+). Но он может преобразовываться в растворимые в воде соединения, содержащие ионы N03- и NН4+, которые и усваиваются корнями растений (рис.2.2).
В результате деятельности человека в круговорот включается азот, образующийся при сжигании топлива, выделяемый при добыче полезных ископаемых для производства минеральных удобрении, попадающий в окружающую среду со стоками животноводческих ферм и при удобрении сельскохозяйственных полей и др.
Соединения азота с кислородом называются оксидами азота. Известны N 2 0, NO , N203, N02 (и его димер N 2 0), N2G5.. Для окружающее среды наибольшую опасность представляет диоксид азота N02, который при взаимодействии с вотдой образует азотную кислоту и оксид азота, что является причиной образования кислотных дождей:
3N02 + Н20 = 2 НN03 + NO
Диоксид азота, взаимодействуя со щелочами, образует нитрит'.' п нитраты.
Азот вовлекается в биогенный круговорот двумя путями:
1 - путем растворения разных оксидов азота в дождевой воде и внесения их таким образом в почву и океан;
2 - путем биологической фиксации N2 клубеньковыми бактериями бобовых растений и микроорганизмами.
Значительные запасы азота сосредоточены в почве в виде минеральных и органических соединений. У животных большая часть азота выводится из организма, у растений обмен азота замкнут. Поступивший в них азот возвращается в почву с самими растениями. Остатки организмов, погребенные в толщах земли, под действием микроорганизмов подвергаются денитрификации, при которой элементарный азот возвращается в атмосферу.
Нитраты при несоблюдении норм могут накапливаться в продуктах, питания, питьевой воде и вызывать тяжелые отравления, а также нарушения кислородного обмена в организме человека, называемого метаглобинемией.
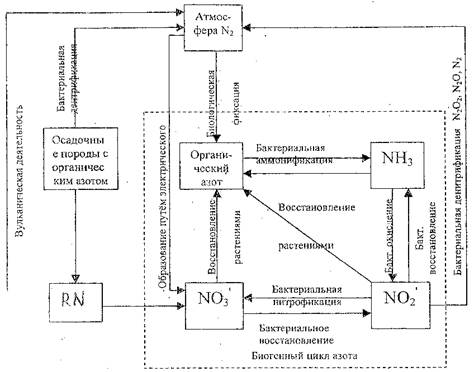
Рис.2.2. Упрощенная диаграмма круговорота азота
13. Круговорот углерода
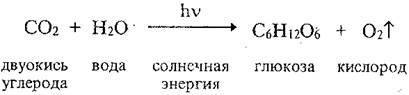
Углерод является основным строительным материалом молекул белков, жиров, нуклеиновых кислот (ДНК и РНК) и других важных для жизни органических соединений. Схема круговорота углерода приведена на рис. 2.4. Растения поглощают диоксид углерода IV (СО2) из атмосферы и под действием солнечного света с помощью хлорофилла осуществляют фотосинтез сложных органических соединений, например сахаров.
В процессе клеточного метаболизма молекулы сахара преобразуются в протеины, липиды и т.д. Эти различные вещества служат углеводным питанием животным и человеку. Для животных этот процесс осложняется необходимостью переваривания съеденной пищи, в процессе которого сложные молекулы, содержащие углерод, разлагаются до простых.
С другой стороны, все организмы осуществляют клеточное дыхание-процесс обратный фотосинтезу, то есть выбрасывают в атмосферу С02.
Когда наступает смерть, то детритофаги и биоредуценты разлагают и минерализуют трупы, образуя цепи питания, в конце которых углерод вновь поступает в круговорот в форме углекислоты. (почвенное дыхание"). Детритофаги превращают животные и растительные остатки в новые органические соединения (гумус). Грибы и бактерии разлагают гумус с выделением углекислого газа. При недостатке воздуха, а также высокой кислотности детритофаги не могут функционировать, и органические остатки накапливаются в виде торфа и образуют торфяные болота. Это приостанавливает круговорот.
В далекие геологические эпохи значительная часть фотосинтезированного органического вещества, не использованная консументами и редуцентами, накапливалась, погребаясь под минеральными осадками. За миллионы лет под действием высоких температур и давлений это вещество превратилось в нефть, газ и уголь, в зависимости от исходного материала, продолжительности и условий пребывания в земле. При сжигании их в качестве топлива накопившийся углерод вновь превращается в С02. При неполном сгорании топлива в атмосферу могут выбрасываться окись углерода СО (угарный газ), сажа С и другие углеродсодержащие соединения (альдегиды, бензапирен и др.). Они могут непосредственно вступать во взаимодействие с живым веществом, разрушая и отравляя его 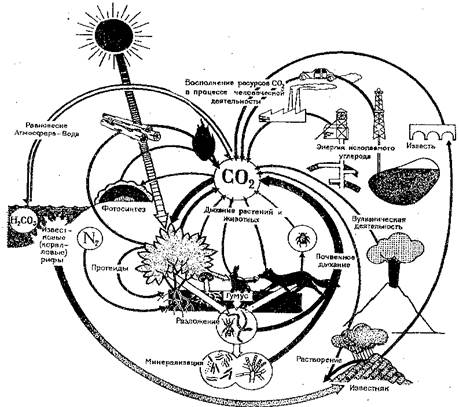
Круговорот углерода
В воде также происходит замедление круговорота углерода, так как углерод, помимо фотосинтеза водорослями, накапливается в составе СаСО3 (мел, известняк, кораллы) химического или биогенного происхождения. Эти массы углерода остаются вне круговорота в течение целых геологических периодов, пока СаСО3 в виде горных цепей не поднимается над поверхностью моря. С этого момента начинается выщелачивание известняка атмосферными осадками, а также пол действием корней растений.
СаСО3 + 2HN03 = Ca(N03)2 + Н20 + С02.
Углерод горных пород может быть также высвобожден в результате человеческой деятельности (добыче полезных ископаемых, разложении под действием кислотных дождей и др.). Так разрушаются мраморные памятники архитектуры, простоявшие несколько тысячелетий (Акрополь, Колизей и др.).
Кларки земной коры.
Количественную распространенность хим-х эл-в в ЗК впервые установил Ф. У. Кларк. В ЗК он включал также гидросферу и атмосферу. Поскольку масса гидросферы составляет лишь несколько %, а атмосферы — сотые доли % от массы твердой ЗК, поэтому числа Кларка в основном отражают состав ЗК.
Кларки ЗК.Кларки самых распространенных магматических, метаморфических и осадочных пород установлены достаточно точно.
Сложнее вопрос о среднем составе ЗК, так как неизвестно соотношение м/у различными группами ГП, особенно под океанами. А. П. Виноградов, предположив, что ЗК на 2/3 состоит из кислых пород и на 1/3 — из основных, вычислил ее средний состав, А. А. Беус установил кларки, исходя из соотношения мощностей гранитного и базальтового слоев 1:2.
Данные Виноградова свидетельствуют, что почти половина твердой ЗК состоит из - О (кларк-47). На втором месте стоит Si (кларк 29,5), на третьем — Al (8,05). В сумме они составляют 84,55 %. Если к этому числу добавить Fe (4,65), Са (2,96), Na (2,50), К (2,50), Mg (1,87), Ti (0,45), то получим 99,48%, т. е. практически почти вся ЗК. Остальные 80 эл-в занимают менее 1 %. Кларки большинства эл-в не превышают 0,01— 0,0001 %. Такие эл-ты наз-ся редкими. Если они обладают слабой способностью к концентрации, то именуются редкими рассея нными (Br, In, rа, I, Hf, Ке, Sc и др.). Например, у U и Br кларки почти одинаковы (2 5 10-1 и 2,1 10-1 %), но U просто редкий эл-т, так как известны его мест-я, а Br — редкий рассеянный, так как он почти не концентрируется в ЗК и известен лишь один собственный минерал этого эл-та. В геохимии употребляется также термин «микроэлементы», под кот. понимаются эл-ты, содержащиеся в данной системе в малых количествах (порядка 0,01 % и менее). Так, А1 — микроэлемент в организмах и макроэлемент в силикатных породах.
Итак, содержание элементов в ЗК колеблется в миллиарды миллиардов раз (n*10 — n*10-16), причем представления, почерпнутые из повседневного опыта, не всегда совпадают с данными геохимии. Например, Zn и Сu широко распространены в быту и технике, а Zr и Ti для нас «редкие элементы». Вместе с тем Zr в земной коре почти в четыре раза больше, чем Cu, Ti — даже в 95 раз. «Редкость» Zr и Ti объясняется трудностью извлечения их из руд, которая была преодолена только в середине ХХ в., когда эти металлы стали широко использоваться в промышленности.
Хорошо известно, что хим. Эл-ы вступают во взаимодействие друг с др. не пропорционально их массам, а в соответствии с количеством их атомов. Поэтому и кларки важно рассчитывать не только в массовых %, но и в % от числа атомов, т. е. с учетом атомных масс (П. Н. Чирвинский, А. Е. Ферсман). При этом кларки тяжелых элементов (например, U, Au) уменьшаются, а легких — увеличиваются.
Расчет на число атомов дает более контрастную картину распространенности химических элементов: выявляется еще большее преобладание О2 и редкость тяжелых эл-в в ЗК.
Когда был установлен средний состав ЗК, возник вопрос о причине столь неравномерного распространения эл-в. Его стали связывать с особенностями строения атомов.
А. Е. Ферсман построил график зависимости атомных кларков для четных и нечетных (по порядковому номеру) эл-в период. системы. Выявилось, что с усложнением строения атомного ядра, утяжелением его, кларки уменьшаются. Однако кривые оказались не монотонными, а ломаными. Ферсман прочертил гипотетическую среднюю линию, кот. плавно понижалась по мере возрастания порядкового номера. Эл-ты, расположенные выше линии, образующие пики, ученый назвал избыточными (О, Si, Fe и др.), а расположенные ниже — дефицитными (инертные газы и др.). Следовательно, в ЗК преобладают легкие атомы, занимающие начальные клетки периодической системы, ядра кот. содержат небольшое число протонов и нейтронов. Действительно, после Fe (№ 26) нет ни одного распространенного элемента.
Итак, в земной коре преобладают ядра с небольшим и четным числом протонов и нейтронов.
Осн-е законы распространенности эл-в в ЗК, очевидно, заложились еще в первые этапы развития Земли как планеты, так как в самых древних архейских породах, как и в самых молодых, преобладают О, Si, Al, Fe. Все же кларки некоторых эл-в изменились. Так, например, в результате радиоактивного распада стало меньше U и Th и больше Pb — конечного продукта их распада («радиогенный» Pb составляет часть атомов Pb ЗК). Известную роль в изменении кларков некоторых эл-в играла диссипация легких газов, выпадение метеоритов и др. причины.
Геох-я классификация эл-в В.И. Вернадского. Родственные по периодической системе эл-ы ведут себя в ЗК далеко неодинаково. Так, К и Na, Fe и Ni, Cl и I, Cr и Мо — аналоги в химии, но в ЗК мигрируют по-разному. Это связано с тем, что для геохимии часто осн. значение имеют такие св-ва эл-в, кот. с общехимических позиций второстепенны и не учитываются в классификации. След-но, необходима особая геох-я классификация эл-в. В классификации В. И. Вернадского учтены самые важные моменты истории эл-в в ЗК. Вернадский выделил 6 групп эл-в. Наиболее крупная из них: «циклические эл-ты», участвующие в сложных круговоротах. По массе они преобладают в ЗК, из них в основном состоят ГП, воды, организмы.
Б. А. Гаврусевич дополнил эту классификацию еще двумя группами: эл-ми, по-видимому, вымершими в ЗК, но известными в космосе, — Тс, Am, Cm, Bk и Cf, и эл-ми, неизвестными в природе, но полученными искусственно — Pm, Es, Md, No, Ku и др.
31. Физико-химические методы очистки сточных вод
Физико-химический метод очистки промышленных стоков используется для очистки стоков от коллоидных и мелкодисперсных загрязнений примесей. Данный метод может также быть эффективен при очистке сточных вод от некоторых типов ионов, кислот, щелочей.
Нейтрализация - один из методов данного метода очистки стоков. Обычно нейтрализации подвергают промышленные сточные воды, содержащие кислоты. Нейтрализующими веществами при обработке сточных вод в данном случае может быть аммиак, известь и прочие щелочные реагенты.
Коагуляция и флокуляция - это другие, принципиально близкие способы физико-химической очистки производственных сточных вод и стоков другого происхождения. Во время этих процессов происходит реакция загрязняющих стоки веществ
1. с минеральными соединениями - данный процес очистки сточных вод называется коагуляция
2. с высокомолекулярными агентами - данный процес очистки стоков называется флокуляция.
В качестве веществ, способствующих коагуляции загрязнений сточных вод используются в основном соли железа и алюминия. Данные коагулянты в результате химической реакции с загрязнениями промышленных сточных вод превращаются в нерастворимые формы гидроксидов этих металлов. При своем образовании эти гидроксиды захватывают органические и неорганические примеси из стоков. При этом в обрабатываемых сточных водах формируются рыхлые хлопья. Данные хлопья затем могут быть легко удалены из очищаемой воды. Необходимо отметить, что при использовании процесса коагуляции для очистки промышленных стоков образуются высоковлажные объемные осадки. Данные осадки, после очистки производственных сточных вод необходимо в дальнейшем утилизировать.
Сущность метода флокуляции для очистки сточных вод заключается в том, происходит адсорбция (прилипание) флокулянта на поверхности нескольких твердых частиц-загрязнителей стоков. В данном процессе также образуются хлопья. Самыми эффективными веществами-флокулянтами для очистки сточных вод являются органические полимеры и активированная кремниевая кислота. К недостатку данного метода очистки стоков можно отнести отсутствие единого вещества-флокулянта для очистки стоков от большинства загрязнителей.

Для глубокой очистки загрязненных промышленных сточных вод используется так называемые мембранные методы очистки стоков. Одним из таких методов очистки является обратный осомс. При этом сточные воды по давлением подаются на специальную полупроницаемую (обратноосмотическую) полимерную мембрану. При этом мембрана пропускает чистую воду, а загрязняющие агенты стоков эффективно задерживаются. Мембранными методами возможно выделять из сточных вод и утилизировать низкомолекулярные вещества, например соли, кислоты и т.д. При мембранных методах очистки сточных вод рекомендуется проведения предварительной очистки стоков.
Ионообменный метод очистки промышленных сточных вод заключается в фильтрации стоков в так называемых ионообменных смолах. Ионообменные смолы подразделяются на сильнокислотные и слабокислотные катиониты и сильноосновные и слабоосновные аниониты. Кроме того, существуют аниониты, содержащие специальные комплексообразующие группы. При прохождении через ионобменную смолу, загрязнения сточных вод катионного типа, вступают в реакцию обмена с катионитом ионита и оседает на нем. И наоборот, загрязнения сточных вод анионного типа, вступают в реакцию обмена с анионитом ионита с последующим оседанием. Достоинство ионообменного метода очистки сточных вод состоит в том, что данный метод способствует целенаправленному выделению определенные вещества из сточной воды.
В том случае, если из сточных вод загрязняющее вещество невозможно извлечь, обычно используют деструктивные методы очистки стоков. При использовании данных методов очистки сточных вод загрязненная вода разлагается до неопасных компонентов. Можно выделить термоокислительные и электрохимические способы деструкции загрязнений сточных вод, а также методы очистки стоков с использованием сильных окислителей.
Факторы изменения климата
Изменения климата обусловлены переменами в земной атмосфере, процессами, происходящими в других частях Земли, таких как океаны, ледники, а также эффектами, сопутствующими деятельности человека. Внешние процессы, формирующие климат, — это изменения солнечной радиации и орбиты Земли.
изменение размеров, рельефа и взаимного расположения материков и океанов,
изменение светимости солнца,
изменения параметров орбиты и оси Земли,
изменение прозрачности атмосферы и её состава в результате изменений вулканической активности Земли,
изменение концентрации парниковых газов (СО2 и CH4) в атмосфере,
изменение отражательной способности поверхности Земли (альбедо),
изменение количества тепла, имеющегося в глубинах океана.
изменение естественного подслоя Земли между ядром и земной корой, вследствие откачки нефти и газа.
Взаимодействие факторов
Влияние на климат всех факторов, как естественных, так и антропогенных, выражается единой величиной — радиационным прогревом атмосферы в Вт/м2.
Извержения вулканов, оледенения, дрейф континентов и смещение полюсов Земли — мощные природные процессы, влияющие на климат Земли. В масштабе нескольких лет вулканы могут играть главную роль. В результате извержения вулкана Пинатубо в 1991 года на Филиппинах на высоту 35 км было заброшено столько пепла, что средний уровень солнечной радиации снизился на 2,5 Вт/м2. Однако эти изменения не являются долгосрочными, частицы относительно быстро оседают вниз. В масштабе тысячелетий определяющим климат процессом будет, вероятно, медленное движение от одного ледникового периода к следующему.
В масштабе нескольких столетий на 2005 год по сравнению с 1750 годом имеется комбинация разнонаправленных факторов, каждый из которых значительно слабее, чем результат роста концентрации в атмосфере парниковых газов, оцениваемый как прогрев на 2,4-3,0 Вт/м2. Влияние человека составляет менее 1 % от общего радиационного баланса, а антропогенное усиление естественного парникового эффекта — примерно 2 %, с 33 до 33,7 град С. Таким образом, средняя температура воздуха у поверхности Земли увеличилась с доиндустриальной эпохи (примерно с 1750 года) на 0,7 °С
52. Как вы понимаете термин «кислотные дожди», каковы причины их образования
В последнее время довольно часто можно слышать о том, что пошел кислотный дождь. Он возникает, когда природа, воздух и вода взаимодействуют с разными загрязнениями. Такие осадки порождают ряд негативных последствий:
заболевания у людей;
гибель сельскохозяйственных растений;
загрязнения водоемов;
сокращение лесных массивов.
Выпадение кислотных дождей происходит из-за промышленных выбросов химических соединений, сжигания нефтепродуктов и другого топлива. Эти вещества загрязняют атмосферу. Затем аммиак, сера, азот и другие вещества взаимодействуют с влагой, из-за чего дождь становится кислотным.
Впервые в человеческой истории кислотный дождь был зафиксирован в 1872 году, а к ХХ веку это явление стало весьма частым. От кислотных дождей большего всего вред наносится США и европейским странам. Кроме того, экологи разработали специальную карту, на которой обозначено территории, наиболее подвергающиеся опасным кислотным дождям.

Фотохимический смог
Не смотря на то, что в последнее десятилетия цивилизация встает на путь третичного сектора экономики и заявляет о борьбе с глобальными проблемами, уничтожающими нашу планету, огромное количество людей, все живое нашей окружающей среды, с каждым днем погибает. Все это является следствием вседозволенности и халатности человека. Работа промышленных предприятий, чрезмерное использование автотранспортного средства, выброс выхлопных газов, приносит колоссальное количество загрязнения среды. Одним из плачевных последствий этого является ухудшение состояния здоровья человека путем воздействия разновидности атмосферного загрязнения – фотохимического смога. Об актуальности этой проблемы мы можем судить ежедневно, видя последствие всего этого.
Фотохимический смог – это пелена едких газов и аэрозолей повышенной концентрации (без тумана), возникающая под действием ультрафиолетовой радиации Солнца в воздухе в результате фотохимических реакций, происходящих в атмосфере в присутствии газовых выбросов автомашин и химических предприятий [4]. Для появления фотохимического смога необходимо сочетание следующих четырех условий:
окиси азота (NО2);
солнечный свет;
углеводороды (фотооксиданты);
температура выше 18оС.
Схема образования смога:
при продолжительной ясной погоде NO2 + УФ hν → NO + О;
УФ hν — ультрафиолетовая солнечная радиация;
O* + O2 → O3
NO + CnH2n выхлопных газов, расщепление алкенов происходит по двойной связи. Возникает циклическая реакция, в итоге которой в атмосфере постепенно накапливается озон. Этот процесс в ночное время прекращается.
Оз + CnH2n из алкенов образуются различные высокотоксичные перекиси-оксиданты (пероксиацетилнитрат - ПАН) — источники свободных радикалов, отличающихся высокой реакционной способностью.
Итоговое уравнение фотохимических реакций:
CnH2n + NO2 + O2 + УФ hν → HCOH + CH3COOONO + O3 [2]
При формировании смога двуокись азота под влиянием УФ-лучей распадается на NO и атомарный кислород, а он в свою очередь соединяется с молекулой атмосферного О2 и образует озон О3- главный ядовитый компонент фотохимического смога. Несмотря на то, что озон обладает бактерицидными и дезодорирующими свойствами, при повышенной концентрации он является одним из сильнейших окислителей с высокой степенью токсичности и способен с легкостью проникать в хвою и листья деревьев, нарушая процессы фотосинтеза. В нижних слоях тропосферы ᴇᴦο концентрация регистрируется в пределах 0.004 – 0.2 мг/м3 [1]. Дополнительными составляющими фотохимического смога служат угарный газ СО, оксиды азота NOХ, перекись ацетилнитрата, азотная кислота HNO3 и др. Аэрозоли фотохимического смога, представленные в виде капель, способны сохраняться в воздухе при относительной влажности 30 %. Это обуславливается их составом: сильно загрязненная вода, содержащая водонерастворимые органические соединения. При более низкой температуре окружающей среды, капли способны деформироваться в мелкие льдинки, как это и происходит в ряде случаев на Аляске.
Впервые фотохимический смог был обнаружен в 40-х годах в Лос-Анджелесе (США), а описан в 50 – х годах в Калифорнии Хаагеном–Смитом [3]. Ученые отмечают, что наиболее благоприятное время для развития смога 10-16 часов. Это объясняется предельной интенсивностью ультрафиолетового излучения в этот период, а значит и наибольшей концентрацией озона и других составляющих компонентов смога: альдегидов, пероксиацетилнитратов и окиси. Именно поэтому, под влияние попадают не только люди, состоящие в группе риска, но и здоровая часть населения, находящаяся в среде с повышенной температурой воздуха.
Распознать фотохимический смог не составит труда, так как для него характерно появление дымки голубоватого цвета и вследствие этого ухудшение видимости, резкий характерный запах. При этом происходит растрескивание красок резиновых и синтетических изделий, порча одежды коррозия металлов, нарушение работы транспорта.
Воздействие фотохимического смога на организм человека:
Раздражение глаз;
Раздражение воздушно – дыхательных путей;
Сухость кожи, кожные высыпания;
Сухость слизистых;
Аллергические конъюнктивиты и риниты;
Приступы БА;
Общетоксическое отравление;
Сердечные приступы;
Снижение иммунитета.
Смог особенно опасен для детей, пожилых людей и людей с пороками сердца и лёгких, больных бронхитом, эмфиземой и астмой. Он может стать причиной одышки, затруднения и остановки дыхания, бессонницы, головных болей, кашля, преждевременной смерти людей со слабым иммунитетом, склонности к сердечным и респираторным заболеваниям. Поэтому во время сильного смога частым явлением является госпитализация.
Фотохимический смог влияет и на растения. Особенно сильно это отражается на винограде, злаках, бобах, свекле, а также на декоративных растениях. Признаком того, что растение подверглось вредному влиянию фотохимического тумана, является набухание листьев, которое затем переходит в появление на верхних листьях пятен и белого налета, а на нижних ведет к появлению бронзового или серебристого оттенка. Затем растение начинает быстро чахнуть.
Смог является большой проблемой во многих мегаполисах мира. В настоящее время они периодически появляются в различных странах: Японии (Токио), Мексике, Аргентине, Канаде, Великобритании (Лондон), Франция (Париж), США (Нью-Йорк, Лос-Анджелес, Чикаго, Бостон, Детройт), Италии (Милан) и некоторых других странах Европы и Америки.
Таким образом, влияние фотохимического смога на окружающую среду пагубно. С целью сокращения числа возникновения смога, необходимо проводить грамотную политику, направленную на сокращение выбросов загрязняющих веществ в атмосферу. Например, создание и использование альтернативного средства передвижения, более щадящая для окружающей среды утилизация отходных материалов промышленных организаций. Вероятно тогда, жители планеты сделают небольшой шаг к сохранению экологии нашей планеты.
Характеристика большого и малого круговоротов
Круговорот веществ проявляется в многократном участия веществ в процессах, происходящих в атмосфере, гидросфере, литосфере и в том числе в тех их слоях, входящих в состав биосферы Различают дв ва основных круговороты веществ: большой (геологический) и малый (биологический, или биотический), которые охватывают всю планету.
Геологический (большой) круговорот - это обмен веществами между сушей и Мировым океаном Прежде происходит глобальная циркуляция воды, т.е. сначала выпадения атмосферных осадков, затем - поверхностный и подземный сток, инфильтрация, испарение и наконец - конденсация, затем снова выпадают осадки На круговорот воды расходуется почти треть всей солнечной энергии, поступающей к Земле Разо м с водой движутся огромные массы растворенных в ней химических веществ, которые в океане осидаються на дно в виде делювиальных отложений или осадка Вода - основной элемент, необходимый для жизни Количественно это наиболее распространенная неорганическая составляющая живой материи Большой круговорот веществ не является замкнутым: определенное количество веществ изымается из круговорота и сохраняется в осадочных породах в виде известняков, торфа, нефти и других пород и минералов Этим забезпечует ться поступательное развитие земной коры и биосферы Согласно концепции великого круговорота веществ и энергии в биосфере, изверженные глубинные породы мантийного происхождения (например, базальты) тектонические ими процессами выводятся из недр Земли в биосферу Под влиянием солнечной энергии и живого вещества они выветриваются, переносятся, вновь откладываются, превращаясь при этом в разнообразные осадочные пор оды В осадочных породах концентрируется и запасается солнечная энергия (например, из изверженных минералов образуются глины, а вулканические газы переходят в уголь, нефть
Малым, или биологическим, круговоротом веществ называют обмен химическими элементами между живыми организмами и неживыми (косного) компонентами биосферы - атмосферой, гидросферой и литосферой Иными словам мы, это две стороны единого процесса - образования живого вещества и его расписание Этот круговорот характеризуется тем, что сначала живое вещество заряжается энергией, а затем в процессе разложения органических концов ок энергия возвращается в окружающую среду Биологический круговорот - это циркуляция веществ между почвой, растениями, животными и микроорганизмами (рис 42) Эта циркуляция происходит в такой помет вности: сначала минеральные вещества и энергия поглощаются из окружающей среды и включаются в состав растительных организмов, затем от растений через трофические цепи они переходят в организм и животных и других консументов и далее через звено редуцентов возвращаются обратно в почву или атмосферосферу.
Геологический и биологический круговороты тесно взаимосвязаны, взаимодействуют между собой, иногда сливаясь воедино Но все же структурно и функционально они существенно отличаются биологическом круговороте в присущи следующие характерные особенности по сравнению с геологическимм:
его действие происходит, как правило, в пределах биогеоценоза, тогда как геологический происходит на больших территориях - материках и прилегающих к ним частях океана;
- главной причиной и движущей силой биологического круговорота является различный характер питания продуцентов, консументов и редуцентов, а геологического - круговорот воды между океаном и сушей; в малом круговороте участвуют только биогенные элементы, тогда как в большом - все химические элементы, которые есть в земной коре
- продолжительность циклов химических элементов в биологическом круговороте является кратковременной (год, несколько лет, десятки и сотни лет), а длительность цикла в геологическом составляет десятки и даже сотни тысяч Роки.
Круговорот азота
Азот (от греч. azoos - безжизненный). Газообразный азот, составляющий 78 % объёма земной атмосферы, не может непосредственно использоваться живыми организмами. В свободном состоянии он обладает химической инертностью, а соединяясь с другими элементами, весьма активен. Организмы нуждаются в различных химических формах азота для образования белков и генетически важных нуклеиновых кислот (ДНК"). Большинству зеленых растений требуется азот в форме нитрат - ионов (N03-) и ионов аммония (NН4+). Но он может преобразовываться в растворимые в воде соединения, содержащие ионы N03- и NН4+, которые и усваиваются корнями растений (рис.2.2).
В результате деятельности человека в круговорот включается азот, образующийся при сжигании топлива, выделяемый при добыче полезных ископаемых для производства минеральных удобрении, попадающий в окружающую среду со стоками животноводческих ферм и при удобрении сельскохозяйственных полей и др.
Соединения азота с кислородом называются оксидами азота. Известны N 2 0, NO , N203, N02 (и его димер N 2 0), N2G5.. Для окружающее среды наибольшую опасность представляет диоксид азота N02, который при взаимодействии с вотдой образует азотную кислоту и оксид азота, что является причиной образования кислотных дождей:
3N02 + Н20 = 2 НN03 + NO
Диоксид азота, взаимодействуя со щелочами, образует нитрит'.' п нитраты.
Азот вовлекается в биогенный круговорот двумя путями:
1 - путем растворения разных оксидов азота в дождевой воде и внесения их таким образом в почву и океан;
2 - путем биологической фиксации N2 клубеньковыми бактериями бобовых растений и микроорганизмами.
Значительные запасы азота сосредоточены в почве в виде минеральных и органических соединений. У животных большая часть азота выводится из организма, у растений обмен азота замкнут. Поступивший в них азот возвращается в почву с самими растениями. Остатки организмов, погребенные в толщах земли, под действием микроорганизмов подвергаются денитрификации, при которой элементарный азот возвращается в атмосферу.
Нитраты при несоблюдении норм могут накапливаться в продуктах, питания, питьевой воде и вызывать тяжелые отравления, а также нарушения кислородного обмена в организме человека, называемого метаглобинемией.

Рис.2.2. Упрощенная диаграмма круговорота азота
13. Круговорот углерода
Углерод является основным строительным материалом молекул белков, жиров, нуклеиновых кислот (ДНК и РНК) и других важных для жизни органических соединений. Схема круговорота углерода приведена на рис. 2.4. Растения поглощают диоксид углерода IV (СО2) из атмосферы и под действием солнечного света с помощью хлорофилла осуществляют фотосинтез сложных органических соединений, например сахаров.

В процессе клеточного метаболизма молекулы сахара преобразуются в протеины, липиды и т.д. Эти различные вещества служат углеводным питанием животным и человеку. Для животных этот процесс осложняется необходимостью переваривания съеденной пищи, в процессе которого сложные молекулы, содержащие углерод, разлагаются до простых.
С другой стороны, все организмы осуществляют клеточное дыхание-процесс обратный фотосинтезу, то есть выбрасывают в атмосферу С02.
Когда наступает смерть, то детритофаги и биоредуценты разлагают и минерализуют трупы, образуя цепи питания, в конце которых углерод вновь поступает в круговорот в форме углекислоты. (почвенное дыхание"). Детритофаги превращают животные и растительные остатки в новые органические соединения (гумус). Грибы и бактерии разлагают гумус с выделением углекислого газа. При недостатке воздуха, а также высокой кислотности детритофаги не могут функционировать, и органические остатки накапливаются в виде торфа и образуют торфяные болота. Это приостанавливает круговорот.
В далекие геологические эпохи значительная часть фотосинтезированного органического вещества, не использованная консументами и редуцентами, накапливалась, погребаясь под минеральными осадками. За миллионы лет под действием высоких температур и давлений это вещество превратилось в нефть, газ и уголь, в зависимости от исходного материала, продолжительности и условий пребывания в земле. При сжигании их в качестве топлива накопившийся углерод вновь превращается в С02. При неполном сгорании топлива в атмосферу могут выбрасываться окись углерода СО (угарный газ), сажа С и другие углеродсодержащие соединения (альдегиды, бензапирен и др.). Они могут непосредственно вступать во взаимодействие с живым веществом, разрушая и отравляя его 
Круговорот углерода
В воде также происходит замедление круговорота углерода, так как углерод, помимо фотосинтеза водорослями, накапливается в составе СаСО3 (мел, известняк, кораллы) химического или биогенного происхождения. Эти массы углерода остаются вне круговорота в течение целых геологических периодов, пока СаСО3 в виде горных цепей не поднимается над поверхностью моря. С этого момента начинается выщелачивание известняка атмосферными осадками, а также пол действием корней растений.
СаСО3 + 2HN03 = Ca(N03)2 + Н20 + С02.
Углерод горных пород может быть также высвобожден в результате человеческой деятельности (добыче полезных ископаемых, разложении под действием кислотных дождей и др.). Так разрушаются мраморные памятники архитектуры, простоявшие несколько тысячелетий (Акрополь, Колизей и др.).
Дата: 2018-12-28, просмотров: 830.