К более редким осложнениям деструктивной пневмонии у детей относится острая прогрессирующая эмфизема средостения. Распространение воздуха происходит по парабронхиальным пространствам в клетчатку средостения вследствие расплавления бронхиол и мелких бронхов стафилококковым некротоксином.
Клиническая картина. Для эмфиземы средостения характерно острое прогрессирующее течение. У больного выявляется симметричная подкожная эмфизема в области шеи, лица, плечевого пояса. Голос становится осиплым, нарастают одышка и цианоз слизистых оболочек и кожи. Появляются признаки нарушения гемодинамики как следствие своеобразной «экстракардиальной тампонады сердца». При рентгенологическом обследовании грудной клетки подтверждается наличие воздуха в клетчатке средостения, шеи, надплечий.
Лечение острой прогрессирующей эмфиземы средостения сводится к проведению экстренного хирургического вмешательства — супраюгу-лярной медиастинотомии. Операцию проводят под местной анестезией. Наркоз противопоказан ввиду опасности повышения внутрибронхиаль-ного давления и увеличения напряжения в средостении |Рокиц-кийР.М., 1978].
Техника операции. Разрез кожи длиной 3—4 см производят дугообразно над яремной вырезкой грудины. Тупым инструментом или пальцем раздвигают подкожную клетчатку и по задней поверхности
грудины- проникают в клетчатку средостения. Рану дренируют резиновой трубкой и прикрывают асептической повязкой.
При сочетании острой прогрессирующей эмфиземы средостения с локальными деструктивными изменениями в легких целесообразно производить радикальную операцию — торакотомию с резекцией пораженного отдела легкого.
Эмпиема плевры
Легочно-плевральные осложнения деструктивной пневмонии могут проявляться в виде пиоторакса и пиопневмоторакса. Клиническая симптоматика и лечебные мероприятия при каждом из осложнений зависят от его формы.
Клиническая картина пиоторакса. Распознавание этого заболевания, возникшего на фоне пупочного сепсиса у детей первых месяцев жизни, является наиболее трудным. Общее тяжелое состояние, наличие интоксикации и других признаков септикопиемии могут длительно маскировать симптомы, характерные для гнойного плеврита. Последний можно заподозрить только при внимательном наблюдении за больным и правильной оценке прогрессивного ухудшения общего состояния, нарастания интоксикации, повышения температуры тела и усиливающейся одышки, сопровождающейся цианозом. В таких случаях развивается сердечно-сосудистая недостаточность в результате смещения экссудатом средостения. Перегиб сосудов при смещении сердца и органов средостения иногда может быть причиной внезапной смерти ребенка. Перку-торно на стороне скопления жидкости выявляется притупление; максимальная тупость определяется в нижнем отделе, над диафрагмой. При правосторонней локализации процесса тупость сливается с печеночной, границы печени установить нельзя. При аускультации детей младшего возраста, даже при сравнительно большом гнойном выпоте, дыхание может быть только ослабленным. В верхних отделах часто определяются мелкие влажные хрипы.
У детей старшего возраста гнойный плеврит проявляется медленным, но прогрессивно нарастающим ухудшением общего состояния, высокой температурой тела. Больные жалуются на боли в грудной клетке при дыхании; нередко возникают иррадиирующие боли в животе. Ребенок становится вялым, адинамичным, плохо ест. Его беспокоит мучительный болезненный кашель. Нарастают явления интоксикации и дыхательной недостаточности; бледность кожи, потливость, одышка, цианоз, тахикардия. При осмотре пораженная половина грудной клетки отстает в акте дыхания. Перкуторный звук над легочным полем укорочен, четко определяются линия Дамуазо, пространство Траубе и треугольник Раухфуса. При большом скоплении выпота притупление распространяется на всю поверхность грудной клетки, справа сливается с печеночной тупостью. Дыхательные шумы не проводятся. Границы сердца смещены в здоровую сторону, тоны приглушены. Анализы крови свидетельствуют о вое-
палительном процессе — выявляются лейкоцитоз, нейтрофилез со сдвигом в формуле влево, увеличенная СОЭ.
Во всех случаях при подозрении на развитие плеврита необходимо рентгенологическое исследование, проводимое при вертикальном положении больного. Рентгенограммы делают в двух проекциях — передне-задней и боковой. При этом выявляется однородное гомогенное затенение легочного поля, диафрагма не контурируется. С увеличением выпота интенсивность затенения легочного поля усиливается, появляется смещение тени средостения в противоположную сторону.
Дифференциальную диагностику следует проводить с ателектазом легкого. Для этого заболевания характерны жалобы больного на внезапную острую боль в грудной клетке. Физикально на стороне поражения выявляются укорочение перкуторного звука и отсутствие дыхания.
Четкие данные дает рентгенологическое исследование: при ателектазе легкого тень средостения смещена в больную сторону, легочный рисунок не прослеживается. Легкое с другой стороны эмфизематозно.
Клиническая картина пиопневмоторакса. Осложнение развивается остро и нередко дает тяжелую картину плевропульмонального шока: ребенок внезапно начинает резко беспокоиться, появляются бледность кожи, холодный липкий пот, затрудненное дыхание. Больной хватает воздух открытым ртом, у него страдальческое испуганное выражение лица. Нарастает цианоз, пульс слабый, нитевидный, температура тела высокая, в некоторых случаях наблюдаются судороги. Все эти явления связаны с прорывом в полость плевры абсцесса легкого, массивным инфицированием плевральных листков, коллабированием легкого и резким смещением органов средостения, вызванным внезапным повышением внутриплеврального давления из-за наличия внутреннего бронхиального свища. Физикальные данные в таких случаях достаточно характерны: больная сторона грудной клетки слегка отстает в дыхании. В более поздние сроки видно сглаживание межреберий. При перкуссии выявляются тимпанический звук вместо имевшегося ранее притупления; органы средостения смещены в здоровую сторону. При выслушивании дыхательные шумы на больной стороне отсутствуют, на уровне воздушной полости возможны проводные шумы с амфорическим оттенком. У детей младшего возраста внезапный прорыв абсцесса, кроме указанных выше симптомов, в некоторых случаях может сопровождаться остановкой дыхания и сердца.
Спустя некоторое время организм ребенка приспосабливается к возникшему патологическому состоянию: больной успокаивается, дыхание становится более ровным, хотя сохраняется одышка. Несколько уменьшается цианоз, улучшается сердечная деятельность. Общее состояние остается очень тяжелым, но не ухудшается. Тяжесть состояния ребенка как бы стабилизируется.
Рентгенологически пиопневмоторакс проявляется довольно четко. В плевральной полости видно затенение в нижних отделах, купол диафрагмы и печень (при процессе справа) не дифференцируются. Тень
выпота отделена от воздуха резкой границей — горизонтальным уровнем. Легкое коллабировано и поджато к корню. Средостение смещено в противоположную сторону. Если в динамике при рентгенологическом контроле такая картина сохраняется, то можно предположить, что у больного имеется зияющее отверстие внутреннего бронхиального свища, воздух через него свободно входит и выходит из плевральной полости во время смены фаз дыхания.
Особенно тяжело протекает напряженный (клапанный) пиопневмото-ракс, который возникает при расширении перфорационного отверстия в легком на вдохе и сужении его на выдохе. Тогда проникающий, в плевральную полость воздух не выходит на выдохе и постепенно накапливается в ней в большом количестве. В результате постоянно нарастающего внутриплеврального давления резко смещаются органы средостения. Перегиб крупных сосудов, смещение трахеи и бронхов ведут к расстройству дыхания и нормальной циркуляции крови в большом и малом круге кровообращения. Кроме того, наступают коллапс легкого на стороне поражения и ухудшение функции другого легкого.
При осмотре ребенок резко цианотичен, дышит поверхностно, очень часто отмечается двигательное беспокойство. Больной задыхается. Пер-куторно на стороне поражения определяется высокий тимпанит, при аус-культации дыхание не прослушивается. Границы сердца резко смещены в здоровую сторону. Общее состояние ребенка с напряженным (клапанным) пиопневмотораксом катастрофически ухудшается вследствие нарастающей гипоксии и сердечно-сосудистой недостаточности.
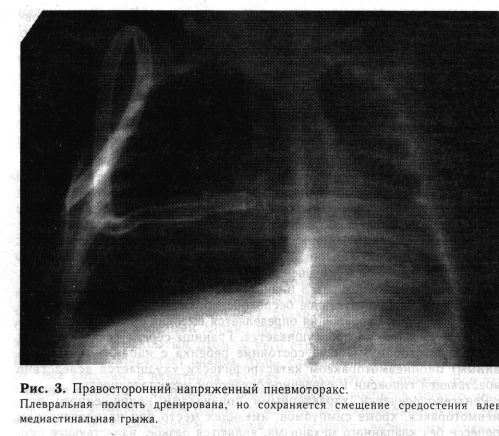
Рентгенологически характерными признаками напряженного пио-пневмоторакса, кроме симптомов, имеющих место при патологическом процессе без клапанного механизма, являются резкое, нарастающее смещение органов средостения в здоровую сторону и наличие медиасти-нальной грыжи (рис. 3).
В случаях клапанного пиопневмоторакса требуется немедленная хирургическая помощь, без которой больной неминуемо погибнет вскоре после развития осложнения.
Дифференциальную диагностику пнопневмоторакса проводят с врожденными инфицированными кистами легких. Правильной диагностике помогают данные анамнеза (при кисте — указание на имевшуюся ранее воздушную полость в легком) и рентгенологического исследования (при кистах легких свободны синусы, в окружности кисты прослеживается легочная ткань, контуры кисты четкие, форма округлая).
Врожденная диафрагмальная грыжа в ряде случаев может симулировать пиопневмоторакс. Сомнений не остается после обследования желудочно-кишечного тракта с контрастирующим веществом. Заполнение контрастирующей массой желудка и петель кишечника, находящихся в грудной полости, позволяет диагностировать диафрагмальную грыжу.
Лечение. Хирургическая тактика при легочно-плевральных осложнениях деструктивной пневмонии определяется характером патологичес-
кого процесса. Однако во всех случаях лечение местного очага должно сочетаться с энергичной общеукрепляющей и антибактериальной терапией.
Общее лечение. Сразу после поступления всем детям для снятия интоксикации начинают проводить инфузионную терапию (см. гл. 1). Антибактериальная терапия должна быть массивной, с использованием препаратов широкого спектра действия. Антибиотики вводят внутривенно, смену их производят по показаниям, но с обязательным учетом данных высева флоры и определения чувствительности возбудителей к ним. Одновременно больной получает большие дозы витаминов С и группы В, кокарбоксилазу и сердечные средства. В комплекс лечебных мероприятий входят оксигенотерапия, физиотерапевтические процедуры, щелочные аэрозоли.
Хирургическое лечение. Все легочно-плевральные осложнения требуют экстренной хирургической помощи. Выбор метода должен быть индивидуальным и зависит от общего состояния больного, возраста, условий, при которых начинают лечение, и характера осложнения. В настоящее время применяют несколько методов хирургического лечения: плевральные пункции, дренирование плевральной полости с активной аспирацией содержимого и радикальные операции — удаление пораженного отдела легкого. К применению каждого метода имеются определенные показания. Следует лишь подчеркнуть, что каждый метод не исключает другой, а дополняет его, делая лечение в целом более правильным и радикальным. Лечение пиоторакса во всех случаях необходимо начинать с плевральной пункции, которая одновременно является и диагностической. Лечение направлено на эвакуацию гноя, расправление легкого и подавление инфекции.
Техника проведения плевральной п у н к ц и и. Положение больного — сидя, рука на стороне пункции поднята. Анестезируют кожу и подлежащие мягкие ткани в области пятого—шестого межребе-рья по задней подмышечной линии 0,25% раствором новокаина с антибиотиками. Специальной иглой, пережав резиновую .трубку зажимом, производят прокол грудной стенки по верхнему краю нижележащего ребра. Затем подсоединяют к канюле шприц, снимают зажим и начинают отсасывание гноя. При снятии шприца трубку на игле вновь пережимают. Жидкость нужно отсасывать медленно, так как быстрая эвакуация может привести к резкому ухудшению общего состояния ребенка вследствие наступающего смещения органов средостения. Появление кашля и изменение общего состояния указывают на необходимость прекращения отсасывания жидкости. Удалив экссудат, в полость плевры вводят раствор антибиотиков.
Если после первой пункции состояние больного заметно улучшилось; уменьшилась одышка, снизилась температура тела, физикальные данные и данные рентгеновского исследования свидетельствуют об уменьшении выпота в плевральной полости, то повторную пункцию проводят спустя 1—2 дня. В процессе лечения приходится делать не меньше 3—4 пункций.
Тяжелое состояние ребенка без заметного улучшения после первой пункции является показанием к ежедневному проколу плевры, отсасыванию гноя и введению антибиотиков. Обычно спустя 2—3 дня наступает улучшение, количество выпота уменьшается, и тогда пункцию проводят сначала через день, а затем и реже-Неполная эвакуация гноя неблагоприятно отражается на общем состоянии ребенка, поддерживая явления интоксикации, лихорадку, изменения в крови. В связи с этим в тех случаях, когда ежедневные пункции в течение 2—3 дней не дали желаемого результата, лучше переходить к более эффективным мерам хирургического лечения — торакоцентезу и активной аспирации гноя. Быстрая и полная эвакуация экссудата, а также расправление легкого благоприятно отражаются на общем состоянии больного и дают уверенность в благоприятном исходе.
В некоторых случаях уже после первой, правильно технически проведенной плевральной пункции в полости плевры появляется свободный газ. Можно полагать, что воздух проникает через бронх, ранее прикрытый сгустком гноя (при создании отрицательного давления при отсасывании экссудата бронх начинает зиять, и воздух свободно поступает в полость плевры). Возникает пиопневмоторакс, что ставит хирурга перед необходимостью соответственно менять метод лечения.
Лечение пиопневмоторакса. Хирургическая тактика при возникновении пиопневмоторакса зависит от распространенности и тяжести деструкции легких, возраста и общего состояния ребенка. Немедленной хирургической помощи требуют дети с напряженным («клапанным») пиопневмотораксом. В таких случаях, как только установлен диагноз (в терапевтическом отделении), производят прокол грудной стенки толстой инъекционной иглой, тем самым переводя напряженный закрытый пиопневмоторакс в открытый. Эта простая манипуляция сохраняет жизнь ребенку, позволяет перевести его в хирургическое отделение и приступить к дальнейшему лечению — дренированию плевральной полости— или радикальной операции.
Пневмония может осложняться одномоментным двусторонним пиопневмотораксом. В таких случаях необходимо интубировать трахею и проводить управляемое дыхание с одновременным двусторонним тора-коцентезом, дренированием плевральных полостей и подключением к системе активной аспирации.
Метод активной аспирации — основное лечебное мероприятие при пиопневмотораксе. Торакоцентез и дренирование плевральной полости (для подключения к системе активной аспирации) проводят под местной анестезией 0,25% раствором новокаина с антибиотиками.
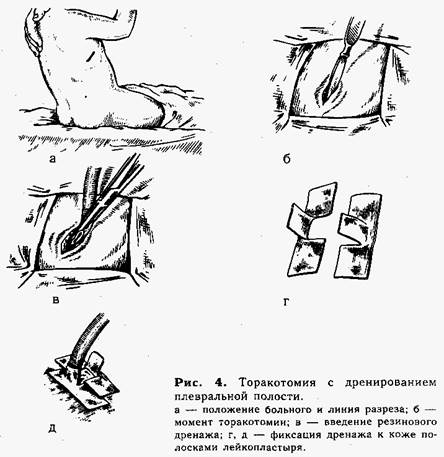
Техника торакоцентеза с дренированием плевральной полости. Положение ребенка — сидя (рис. 4, а). Контрольной пункцией в пятом—шестом межреберье по средней подмышечной линии подтверждают наличие гноя и воздуха в плевральной полости ("симптом шприца" указывает на функционирующий внутренний бронхиальный свищ). Производят разрез кожи длиной 0,7—1 см (на месте пробной пункции). Расслаивая мягкие ткани в межреберье концом кровоостанавливающего зажима Бильрота, проникают в полость плевры и расширяют рану на длину разреза путем раздвигания бранш. Затем берут резиновую трубку-дренаж (не менее 0,5 см в поперечнике) со срезанным П-образно концом и дополнительным боковым отверстием, захватывают кровоостанавливающим зажимом и вводят через рану в плевральную полость (рис. 4, б, в). Трубку фиксируют к коже шелковым швом, и для полной герметизации края отверстия вокруг дренажа заклеивают липким пластырем (рис. 4, г, д).
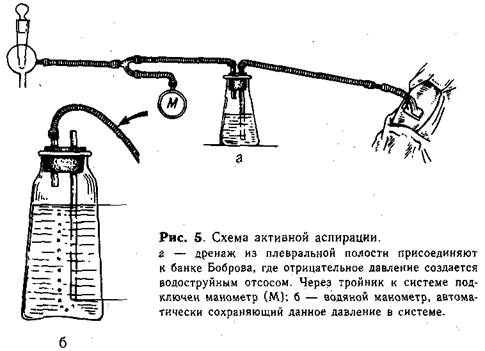
Через дренаж с помощью шприца отсасывают гной и тщательно промывают плевральную полость раствором антисептиков, затем вводят антибиотики, растворенные в 20—40 мл 0,25% раствора новокаина. После этого свободный конец дренажа присоединяют к системе водоструйного отсоса (рис. 5). При большом отделении гноя только в течение первых суток промывание и введение в плевральную полость антибиотиков можно повторить. Раствор вводят через полиэтиленовый катетер, не пережимая дренаж на фоне активной аспирации.
С помощью аппарата активной аспирации в плевральной полости создают отрицательное давление до 15—25 см вод. ст. и более. При наличии внутреннего бронхиального свища необходимо усиливать работу
отсоса до тех пор, пока количество отсасываемого воздуха не будет превышать количество поступающего через свищ (создают так называемый «режим бронхиального свища»). Если у ребенка в процессе активной аспирации в гнойном отделяемом появляется примесь крови или больной начинает беспокоиться, давление в системе снижают. Найденные оптимальные условия режима бронхиального свища позволяют поддерживать в плевральной полости постоянное отрицательное давление, в результате чего легкое расправляется.
Степень расправления легкого контролируют ежедневно путем тщательной аускультации и перкуссии. Через 1—2 дня производят рентгенограмму грудной полости (в палате, не отключая аппарата активной аспирации!). При частой закупорке дренажа густым гнойным отделяемым рекомендуют установить вторую дренажную трубку в верхние отделы плевральной полости. Для этого осуществляют торакоцентез в третьем межреберье по передней подмышечной линии и вводят дренаж, который также подключают к системе активной аспирации.
Длительность проведения аспирации зависит от характера патологического процесса в легком и величины бронхиального свища. При ограниченном поражении легкое обычно расправляется через 3—5 дней, бронхиальный свищ перестает функционировать. За это время наступает достаточно прочное сращение листков париетальной и висцеральной плевры, удерживающее легкое от повторного коллапса.
При более тяжелом распространенном процессе гнойное отделяемое бывает обильным и постоянно отсасывается воздух, поступающий в плевральную полость через широкий бронхиальный свищ. В таких случаях легкое расправляется значительно''медленнее; только на 5—7-й день рентгенологически устанавливают уменьшение пневмоторакса.
Прекращают активную аспирацию после того, как наступило полное расправление легкого. Перед удалением дренаж пережимают на 18— 24 ч. Затем производят рентгенологический контроль. Если легкое не спалось, то дренаж извлекают из плевральной полости.
При позднем поступлении ребенка проведение активной аспирации не всегда приводит к расправлению легкого. Это объясняется тем, что легкое ригидно из-за окутывающих его фибринозных наслоений. В таких случаях в комплекс лечебных мероприятий должно быть включено поднаркозное «раздувание» легкого.
Техника «раздувания» легкого. Процедуру проводят в рентгеновском каби-нете под эндотрахеальным наркозом. Хирург подсоединяет шприц Жане к дренажной трубке, находящейся в плевральной полости ребенка. Под контролем мановакуумметра анестезиолог кратковременно повышает давление в легких до 25—30 мм рт.ст. Одномоментно хирург от-сасывает воздух из плевральной полости. Рентгемоскопически контролируют степень распрэв-ления легкого. Повторив нагнетание и отсасывание воздуха 3—5 раз, обычно удается добить-ся полного нли значительного раеправления лeгкгo. После этого больного переводят в пала-ту и подключают к системе активной аспирации.
Необходимость постоянного сохранения отрицательного давления в плевральной полости определяет некоторые особенности ведения больных с пиопневмотораксом: аппарат активной аспирации не отключают в течение 5—7 дней; все процедуры (внутривенные вливания, трансфузии крови и др.) производят в палате. Здесь же делают контрольные рентгенограммы, подтверждающие расправление легкого. Погрешности в проведении этих правил снижают эффективность изложенного метода.
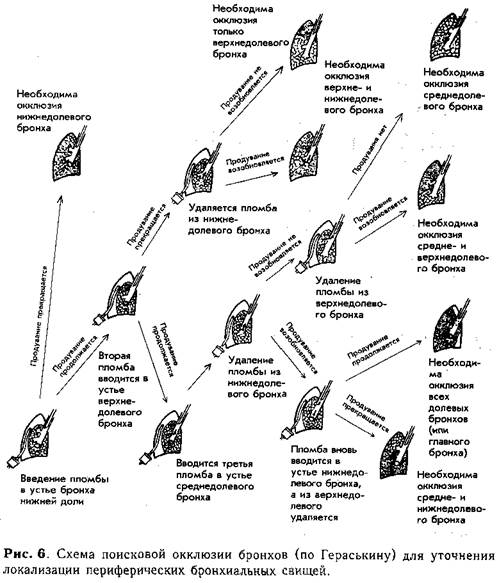
При больших или множественных внутренних бронхиальных свищах иногда с помощью активной аспирации не удается создать отрицательное давление в плевральной полости и расправить легкое из-за большого сброса воздуха через свищи. В таких случаях допустимо [Бай-ров Г. А., Рошаль Л. М., 1991] уменьшить давление или вообще перевести больного на несколько часов (иногда на сутки) на пассивную аспирацию для того, чтобы свищ сузился, а затем снова приступить к активной аспирации. В подобных ситуациях эффективнее применение метода искусственной герметизации путем временной окклюзии бронха, несущего периферические бронхоплевральные свищи, по Rafinski—Гераськи-ну. При этом ценой временного ателектаза пораженной доли здоровые участки получают возможность немедленного расправления и участия в вентиляции (рис, 6).
Техника временной окклюзии бронха. Больному с пиопневмотораксом и дренажем в плевральной полости производят бронхоскопию под наркозом с помощью дыхательного бронхоскопа. Тубус бронхоскопа вводят в бронх пораженной доли. В качестве обтуратора используют крупнопористую поролоновую губку, смоченную йодолиполом. Диаметр пломбы должен в 2—3 раза превышать диаметр устья бронха, что обеспечивает его плотную обтурацию. Пломбу-обтуратор вводят в устье бронха с помощью бронхоскопических щипцов. Эффективность закупорки проверяют проведением форсированного дыхания большим объемом, одновременно наблюдая за выхождением воздуха из плевральной полости по дренажу, подсоединенному к банке аппарата Боброва. Прекращение сброса воздуха свидетельствует о герметичной закупорке бронха, несущего свищ. Во всех случаях, когда продувание после закупорки бронха прекратилось, необходимо, не извлекая трубки бронхоскопа, дождаться восстановления спонтанного дыхания и кашлевых движений для контроля за герметичностью легкого.
Поролоновую губку оставляют в просвете бронха на 7—8 дней и затем удаляют при повторной бронхоскопии. Необходимость в экстренной торакотомии и резекции легкого возникает в случаях кровотечения из его некротизированных тканей, а также при повторном коллабирова-нии легкого.
Несмотря на самую энергичную комплексную терапию, спасти таких детей удается редко.
Выздоровевшие дети подлежат длительному диспансерному наблюдению с обязательным регулярным рентгенологическим контролем за состоянием легких.
Глава 4
ЗАБОЛЕВАНИЯ ПИЩЕВОДА
Различные заболевания пищевода встречаются у детей всех возрастных групп. Наиболее часто необходимость срочного оперативного вмешательства возникает в связи с врожденными пороками развития и по-вреждениями пищевода.
Несколько реже показания к неотложной помощи обусловлены кро-вотечением из расширенных вен пищевода при портальной гипертен-зии.
ПОРОКИ РАЗВИТИЯ ПИЩЕВОДА
Пороки развития пищевода принадлежат к числу заболеваний, которые нередко являются причиной гибели детей в первые дни жизни или возникновения у них серьезных осложнений, нарушающих дальнейшее развитие. Среди многочисленных врожденных дефектов пищевода для неотложной хирургии представляют интерес те виды, которые несовместимы с жизнью ребенка без срочной оперативной коррекции: врожденная непроходимость (атрезия) и пищеводно-трахеальные свищи.
Непроходимость пищевода
Врожденная непроходимость пищевода обусловлена его атрезией. Этот сложный порок развития формируется на ранних этапах внутриутробной жизни плода и, по нашим данным, встречается сравнительно часто (на каждые 3500 детей 1 рождается с пороком развития пищевода).
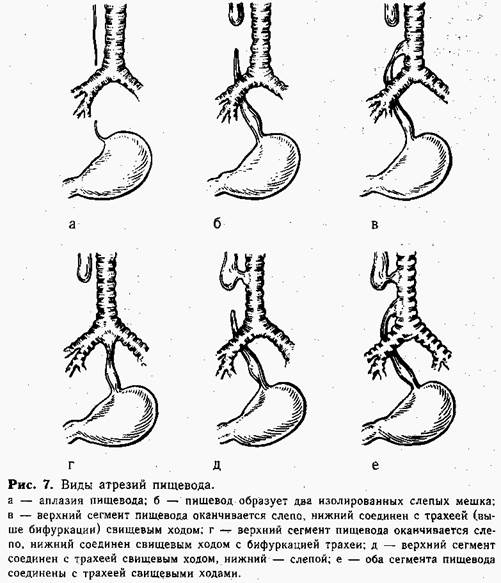
Возможно образование 6 основных видов врожденной непроходимости пищевода (рис. 7).
При атрезии в большинстве случаев верхний конец пищевода заканчивается слепо, а нижняя часть сообщается с трахеей, образуя трахеопи-щеводный свищ (90—95%). Понятно, что околоплодные воды и жидкость, которую ребенок заглатывает после рождения, не могут попасть в желудок и накапливаются вместе со слюной в верхнем слепом мешке пищевода, затем срыгиваются и аспирируются. Наличие свища в верхнем сегменте пищевода ускоряет аспирацию — жидкость после проглатывания частично или полностью попадает в трахею. У ребенка быстро развивается аспирационная пневмония, которая усиливается за счет забрасывания в трахею содержимого желудка через пищеводно-трахе-альный свищ нижнего сегмента. Спустя несколько дней после рождения ребенок погибает от аспирационной пневмонии. Таких детей может спасти только неотложная хирургическая коррекция порока.
Благоприятный исход лечения врожденной непроходимости пищевода зависит от многих причин, но прежде всего от своевременного выявления атрезии. При раннем начале специального лечения уменьшаетсявозможность аспирации. Диагноз, поставленный в первые часы жизни ребенка (до первого кормления!), предупредит или значительно облегчит течение аспирационной пневмонии Однако педиатры родильных домов недостаточно знают симптоматику врожденной непроходимости пищевода. Так, например, среди оперированных нами за период с 1961 по 1981 г. 343 детей только 89 направлены в 1-е сутки после рождения, а остальные поступали в сроки от 1 до 23 дней.
Общее состояние больного и степень поражения легких находятся в прямой зависимости от времени поступления: в группе больных, поступивших в 1-е сутки, только у 29 клинически определялась пневмония; у 126 детей, поступивших на 2-е сутки, состояние расценивалось как тяжелое, и была диагностирована двусторонняя пневмония; почти у всех новорожденных, которых направили в возрасте старше 2 сут (128), отмечался более тяжелый процесс в легких (у 1/3 из них, кроме пневмонии, был выявлен ателектаз различной степени с одной или с двух сторон).
Клиническая картина. Первым наиболее ранним и постоянным признаком, позволяющим подумать об атрезии пищевода у новорожденного, является большое количество пенистых выделений изо рта и носа. Этому признаку, который отмечен в документации родильных домов у всех детей, к сожалению, не всегда придают должное значение и правильно оценивают. Подозрение на атрезию пищевода должно усилиться, если после обычного отсасывания слизи последняя продолжает быстро накапливаться в большом количестве. Слизь временами имеет желтую окраску, что зависит от забрасывания желчи в трахею через фистулу дистального сегмента пищевода. У всех детей с непроходимостью пищевода к концу 1-х суток после рождения можно выявить довольно отчетливые нарушения дыхания (аритмию, одышку) и цианоз. Аускультативно в легких определяется обильное количество влажных разнокалиберных хрипов. Вздутие живота указывает на имеющийся свищ между дисталь-ным сегментом пищевода и дыхательными путями.
Для раннего выявления порока мы считаем необходимым всем новорожденным и особенно недоношенным детям сразу после рождения производить зондирование пищевода. Это не только поможет выявить атрезию, но и позволит заподозрить другие аномалии пищеварительного тракта. Следует отметить, что для новорожденного, не имеющего пороков развития, зондирование принесет пользу, так как эвакуация содержимого желудка предотвращает срыгивание и аспирацию.
Если были выявлены первые косвенные признаки атрезии в родильном доме, то следует подтвердить или отвергнуть диагноз также зондированием пищевода.
Для зондирования пользуются обычным тонким резиновым катетером (№8—10), который вводят через рот или нос в пищевод. При атрезии происходит задержка свободно проталкиваемого катетера на уровне вершины мешка проксимального сегмента пищевода (10—12см от края десен). Если пищевод не изменен, то катетер легко проходит на большее расстояние. При этом надо помнить, что в ряде случаев катетер может сложиться, и тогда создается ложное впечатление о проходи-
мости пищевода. Для уточнения диагноза катетер проводят на глубину больше 24 см, и тогда конец его (если имеется атрезия) обязательно будет обнаружен во рту ребенка.
При первом кормлении непроходимость пищевода выявляется довольно определенно. Вся выпитая жидкость (1—2 глотка) сразу же выливается обратно. Кормление сопровождается резким нарушением дыхания; новорожденный синеет, дыхание становится поверхностным, аритмичным, наступает его остановка. Приступ кашля может длиться от 2 до 10 мин, а затруднение и аритмия дыхания — еще дольше. Указанные явления возникают во время каждого кормления. Постепенно нарастает цианоз. При выслушивании легких выявляется обильное количество разнокалиберных влажных хрипов, больше справа. Общее состояние ребенка прогрессивно ухудшается.
С исчерпывающей полнотой и достоверностью диагноз устанавливают на основании рентгенологического исследования пищевода с применением контрастирующего вещества, которое проводят только в условиях хирургического стационара. Получаемые данные являются необходимой частью предоперационного обследования и служат ориентиром для выбора способа хирургического вмешательства. Рентгенологическое обследование детей с подозрением на атрезию пищевода начинают с обзорной рентгенограммы грудной клетки (очень важно внимательно оценить состояние легких!). Затем в верхний сегмент пищевода проводят резиновый катетер и отсасывают слизь, после чего через тот же катетер в пищевод с помощью шприца вливают 1 мл 30% водорастворимого контрастирующего вещества. Введение большого количества может привести к нежелательному осложнению — переполнению слепого верхнего отрезка пищевода и аспирации с заполнением контрастирующим веществом бронхиального дерева. Рентгенограммы производят при вертикальном положении ребенка в двух проекциях. Контрастирующее вещество после рентгенологического исследования тщательно отсасывают. Применение бария сульфата для исследования пищевода у новорожденных при любой форме атрезии противопоказано, так как попадание его в легкие, возможное при этом, вызывает ателектатическую пневмонию.
При общем тяжелом состоянии ребенка (позднее поступление, недоношенность III—IV степени и др.) можно не предпринимать обследования с контрастирующим веществом, а ограничиться введением в пищевод тонкого резинового катетера (под контролем рентгеновского экрана), который позволит довольно точно определить наличие и уровень ат-резии. Следует помнить о том, что при грубом введении малоэластично-го толстого катетера можно сместить податливую пленку слепого орального сегмента пищевода, и тогда создается ложное впечатление о низком расположении препятствия.
Характерным рентгенологическим симптомом атрезии пищевода при исследовании с контрастирующим веществом является умеренно расширенный и слепо оканчивающийся верхний сегмент пищевода (рис. 8)-. Уровень атрезии точнее определяется на боковых рентгенограммах. На-
личие воздуха в желудочно-кишечном тракте указывает на соустье между нижним сегментом пищеБОда и дыхательными путями.
Видимый верхний слепой мешок и отсутствие газа в желудочно-ки-шечном тракте позволяют думать об атрезии без фистулы между дис-тальным сегментом пищевода и трахеей. Однако этот рентгенологический симптом не всегда полностью исключает наличие свища между дистальным сегментом пищевода и дыхательными путями. Узкий просвет свища бывает закупоренным слизистой пробкой, что служит препятствием для прохождения воздуха в желудок.
Наличие фистулы между верхним сегментом пищевода и трахеей рентгенологически может выявиться по забрасыванию контрастирующего вещества через свищ в дыхательные пути. Это обследование не всегда помогает обнаружить свищ, который в таких случаях находят только во время операции.
При анализе клинико-рентгенологическнх данных и постановке окончательного диагноза следует помнить о возможных сочетанных пороках развития, которые, по нашим данным, встречаются у 44,7% больных, и часть из них (26%) нуждаются в экстренной хирургической коррекции или несовместимы с жизнью (5%).
Дифференциальную диагностику приходится проводить с асфик-сическими состояниями новорожденного, вызванными родовой травмой и аспирационной пневмонией, а также изолированным трахеопищевод-чым свищом и «асфиксическим ущемлением» диафрагмальной грыжи. В таких случаях атрезию пищевода исключают зондированием. 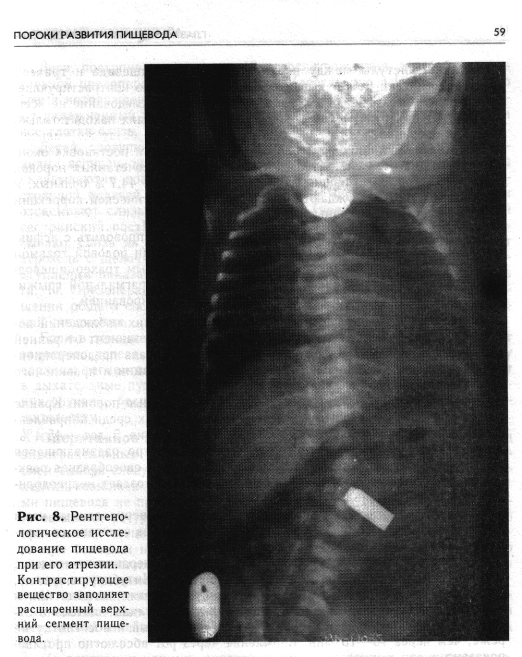
Лечение. Опубликованные данные и анализ наших наблюдений показывают, что успех хирургического вмешательства зависит от ранней диагностики порока, а отсюда — своевременного начала предоперационной подготовки, рационального выбора метода операции и правильного послеоперационного лечения.
Существенно влияют на прогноз многие сочетанные пороки. Крайне сложно лечение недоношенных детей, число которых среди направленных в нашу клинику достигало 38%, а в последние 5 лет — 45,4%. У новорожденных этой группы наблюдаются быстро развивающаяся пневмония, пониженная сопротивляемость ребенка и своеобразная реакция на хирургическое вмешательство, что нередко создает непреодолимые трудности в лечении.
Следует отметить, что в последние 5 лет среди оперированных нами 44 недоношенных детей выздоровели 23 (из них 8 без сочетанных пороков развития).
Предоперационная подготовка. Подготовку к операции начинают с момента установления диагноза в родильном доме. Интубируют трахею, непрерывно дают увлажненный 40% кислород, вводят антибиотики и витамин К. Выделяющуюся в большом количестве слизь тщательно отсасывают через, мягкий резиновый катетер, вводимый в носоглотку не реже, чем через 10—15 мин. Кормление через рот абсолютно противопоказано.
Транспортировку больного в хирургическое отделение осуществляют по правилам, предусмотренным для новорожденных, с обязательной непрерывной подачей кислорода и периодическим отсасыванием слизи из носоглотки. Из отдаленных районов и областей новорожденных доставляют самолетом (перелет ребенок переносит обычно удовлетворительно).
Дальнейшую подготовку к операции продолжают в хирургическом отделении, стремясь главным образом к ликвидации явлений пневмонии. Длительность подготовки зависит от возраста и общего состояния ребенка, а также от характера патологических изменений в легких.
Дети, поступившие в первые 12 ч после рождения, не требуют длительной предоперационной подготовки (достаточно 1 1/2—2 ч). На это время новорожденного помещают в обогреваемый кувез, постоянно дают увлажненный кислород, каждые 10—15 мин отсасывают изо рта и носоглотки слизь. Вводят антибиотики, витамин К.
Детей, поступивших в более поздние сроки после рождения, с явлениями аспирационной пневмонии готовят к операции 6—24 ч. Ребенка укладывают в возвышенном положении в обогреваемый кувез с постоянной подачей увлажненного кислорода. Через каждые 10—15 мин отсасывают слизь изо рта и носоглотки (необходим индивидуальный сестринский пост!). При длительной подготовке каждые 6—8 ч отсасывают слизь из трахеи и бронхов. Вводят антибиотики, назначают аэрозоль с щелочными растворами и антибиотиками. При позднем поступлении показано парентеральное питание (расчет жидкости см. в гл. 1). Предоперационную подготовку прекращают при заметном улучшении общего состояния ребенка и уменьшении клинических проявлений пневмонии.
Если в течение первых б ч предоперационная подготовка не имеет заметного успеха, то надо заподозрить наличие свищевого хода между верхним сегментом и трахеей, при котором слизь неминуемо попадает в дыхательные пути. Продолжение предоперационной подготовки в таких случаях бесполезно, необходимо переходить к оперативному вмешательству.
Оперативное вмешательство при атрезии пищевода проводят под эндотрахеальным наркозом и защитным Переливанием крови. Операцией выбора следует считать создание прямого анастомоза. Однако последний возможен только в тех случаях, когда диастаз между сегментами пищевода не превышает 1,5 см (при высоком расположении верхнего сегмента, на уровне Th1,—Th2 создание анастомоза возможно только при помощи специального сшивающего аппарата). Наложение анастомоза при большом натяжении тканей сегментов пищевода не оправдано из-за технических трудностей и возможного прорезывания швов в послеоперационном периоде.
У новорожденных с массой тела менее 1500 г производят многоэтапные «нетипичные» операции: отсроченный анастомоз с предварительной перевязкой пищеводно-трахеального свища и др. (Бабляк Д. Е., 1975, и др.].
На основании клинико-рентгенологических данных практически невозможно установить истинное расстояние между сегментами. Окончательно этот вопрос решается только во время хирургического вмешательства. Если во время торакотомии обнаружен значительный диастаз (больше 1,5 см) между сегментами или тонкий нижний сегмент (до 0,5 см), то производят первую часть двухмоментной операции — ликвидируют пищеводно-трахеальный свищ нижнего сегмента и выводят на шею верхний конец пищевода. Эти мероприятия предупреждают развитие аспирационной пневмонии, сохраняя тем самым жизнь больному. Созданная нижняя эзофагостома служит для кормления ребенка до
II этапа операции — формирования искусственного пищевода из толстой кишки.
Операция создания анастомоза пищевода. Наиболее рационально пользоваться экстраплевральным оперативным доступом, который, по нашим наблюдениям (156 новорожденных), значительно облегчает течение хирургического вмешательства и послеоперационного периода.
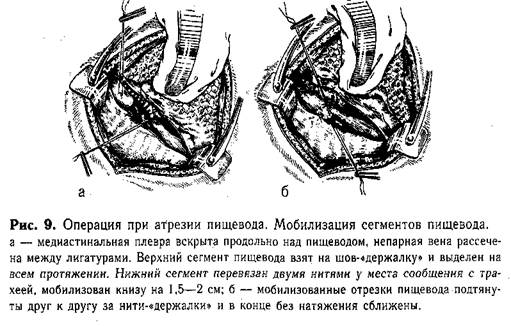
Техника экстраплеврального доступа. Ребенок лежит на левом боку. Правую руку фиксируют в поднятом и отведенном кпереди положении. Под грудь подкладывают свернутую в виде валика пеленку. Разрез проводят от средней аксиллярной линии до паравертебральной по ходу IV ребра. Кровоточащие сосуды тщательно лигируют. Осторожно рассекают мышцы в четвертом межреберье. Медленно отслаивают плевру (вначале пальцем, затем влажным малым тупфером) на протяжении разреза кверху и книзу на 3—4 ребра. Специальным винтовым ранорасшнрителем малых размеров разводят края раны грудной стенки, после чего отводят кпереди и вниз покрытое плеврой легкое. Отслаивают над пищеводом медиастинальную плевру вверх до купола. Если анатомические взаимоотношения позволяют создать прямой анастомоз, то приступают к мобилизации сегментов пищевода.
Техника мобилизации сегментов п и щ е в о д а. Находят нижний сегмент пищевода. Ориентиром служит типичное-расположение блуждающего нерва. Последний отстраняют кнутри, пищевод сравнительно легко выделяют из окружающих тканей и берут на держалку (полоска резины). Нижний сегмент пищевода мобилизуют на небольшом протяжении (2—2,5 см), так как значительное обнажение его может привести к нарушению кровоснабжения. Непосредственно у места сообщения с трахеей пищевод перевязывают тонкими лигатурами и пересекают между ними. Культи обрабатывают спиртовым раствором йода. Концы нити на короткой культе пищевода (у трахеи) отсекают. Ушивания свища трахеи обычно не требуется. Только широкий просвет (больше 7 мм) является показанием для наложения на культю одного ряда непрерывного шва. Вторую нить на свободном нижнем конце пищевода временно используют как «держалку». Верхний сегмент пищевода находят по катетеру, введенному в него до начала операции через нос. На вершину слепого мешка накладывают Шов-«держалку», за который подтягивают его, отслаивая медиастинальную плевру, и осторожно выделяют кверху влажным тупфером (пинцетом не трогать!). Оральный сегмент имеет хорошее кровоснабжение,1 что позволяет мобилизовать его возможно выше. Плотные сращения с задней стенкой трахеи осторожно рассекают ножницами. При наличии между верхним сегментом и трахеей фистулы последнюю пересекают, и образовавшиеся в трахее и пищеводе отверстия зашивают однорядным непрерывным краевым швом атравматичными иглами. Мобилизованные отрезки пищевода подтягивают друг к другу за нити-«держалки» (рис. 9). Если концы их свободно заходят друг за друга, то приступают к созданию анастомоза.
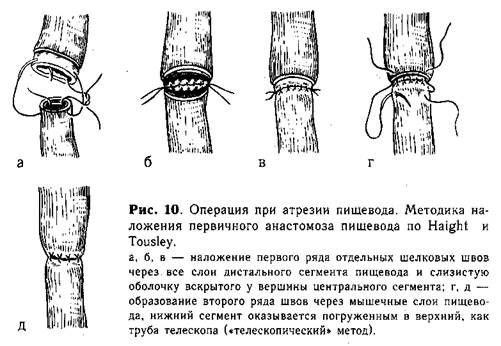
Техника создания анастомоза. Создание анастомоза является наиболее трудной частью операции. Следует отметить, что затруднения возникают не только в связи с диастазом между отрезками пищевода, но зависят и от ширины просвета дистального сегмента. Чем уже его просвет, тем труднее наложение швов, больше вероятность их прорезывания и возникновения сужения места анастомоза в послеоперационном периоде. По нашим данным, наиболее часто дистальный сегмент имеет ширину просвета до 0,4—0,6 см.
В связи с многообразием анатомических вариантов при атрезии пищевода применяют различные методы создания анастомоза. Для наложения швов пользуются атравматичными иглами.
Анастомоз путем соединения отрезков пищевода по типу «конец в конец». Первый ряд отдельных шелковых швов накладывают через все слои нижнего конца пищевода и слизистую оболочку верхнего сегмента (рис. 10, а, б, в). Второй ряд швов проводят через мышечный слой обоих сегментов пищевода (рис. 10, г. д). Наибольшая трудность этого метода — в наложении первого ряда швов на крайне тонкие и нежные ткани, которые прорезываются при самом ничтожном натяжении. Анастомоз применяют при небольшом диастазе между отрезками пищевода и широком нижнем сегменте.
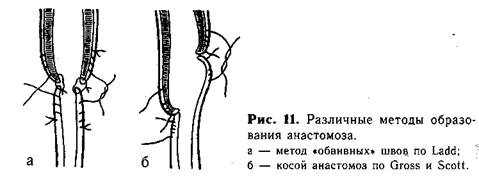
Для соединения концов пищевода можно пользоваться специальными швами типа обвив-ных. Четыре пары таких нитей, наложенных симметрично на оба сегмента пищевода, вначале служат как «держалки», за которые подтягивают концы пищевода. После сближения их краев соответствующие нити связывают. При завязывании швов края пищевода вворачиваются внутрь. Анастомоз укрепляют вторым рядом отдельных шелковых швов. Подобные швы дают возможность накладывать анастомоз при некотором натяжении, без опасения прорезать нитями нежные ткани органа (рис. 11, а).
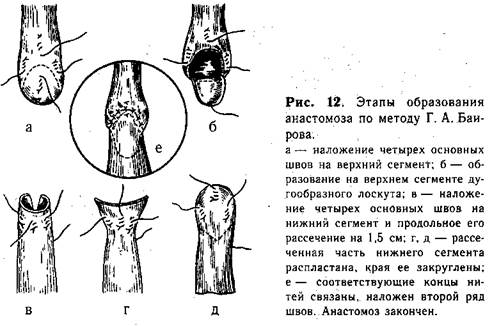
Методика косого анастомоза пищевода значительно уменьшает возможность образования стриктуры в месте сшивания (рис. 11, б). Мы разработали и применяем в клинике с 1956 г. метод наложения анастомоза, удлиняющий сегменты пищевода. На боковых поверхностях центрального отрезка пищевода, на расстоянии приблизительно 0,7 см от его вершины, накладывают 1-й и 2-й швы, захватывая каждой нитью 2—3 раза только мышечный слой пищевода («обвивной» шов, рис. 12, а). Свободные концы указанных нитей временно служат «держалками», потягивая за которые удается полностью избежать травматизации пищевода инструментами. 3-й шов накладывают по передней поверхности на 0,5 см выше боковых, а 4-й — также на передней поверхности, но несколько ниже предыдущего. Между 3-м и 4-м швами проводят дугообразный разрез, образуя лоскут диаметром 0,5—0,7 см из всех слоев стенки пищевода. 4-й шов остается на образованном лоскуте, а когда последний отворачивают книзу, то он оказывается на задней поверхности пищевода (рис. 12, б). 5-й и 6-й швы (рис. 12, в) накладывают на нижнийсегмент пищевода с обеих его сторон, отступя от вершины мобилизованного конца на 0,5—0,7 см. Эти швы временно служат «держалками». Затем нижний сегмент рассекают между 5-м и 6-м швами по задней поверхности продольно от вершины книзу. Длина разреза должна быть около 1 —1,5 см. 7-й шов накладывают у верхнего края передней поверхности нижнего сегмента пищевода. Последний, 8-й, шов накладывают на задней поверхности у конца продольного разреза. Рассеченную часть нижнего сегмента распластывают, кран его закругляют (рис. 12, г, д).
Катетер, который до начала операции вводят через нос в верхний сегмент пищевода, продвигают далее через образованное отверстие в нижний отрезок и желудок. Над катетером связывают соответствующие нити-«держалки», сначала задние, а затем боковые и передние. Таким образом создают первый ряд анастомоза (рис. 12, е). Второй ряд швов анастомоза образуют отдельными шелковыми нитями, которые особенно внимательно следует накладывать на задней поверхности пищевода. После завершения второго ряда швов анастомоз можно считать законченным.
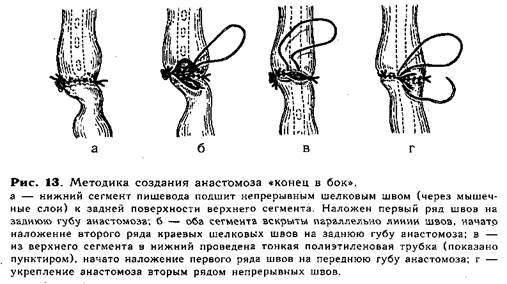
В тех случаях, когда при операции выясняется, что отрезки пищевода соприкасаются без натяжения или заходят друг за друга, мы пользуемся наиболее простым анастомозом — «конец в бок». После мобилизации, перевязки и отсечения, от трахеи нижний сегмент пищевода подшивают через мышечные слои задней поверхности на протяжении до 0,8 см непрерывным швом ко дну расширенного верхнего сегмента, образуя первый ряд швов на задней губе будущего анастомоза (рис. 13, а). Вскрывают (0,5—0,7см) просвет обоих сегментов пищевода, отступая на 1—2мм от линии шва, и накладывают второй ряд швов на задней губе анастомоза (рис. 13, б). Затем удаляют из пищевода ранее введенный в верхний сегмент катетер и через нос в желудок проводят тонкую полиэтиленовую трубку для последующего питания ребенка (трубку проводят во всех случаях создания анастомоза!). .Переднюю губу анастомоза образуют над трубкой двухрядным швом (рис. 13, в, г), второй ряд закрывает культю нижнего сегмента.
В нашей клинике с успехом использовался механический шов отрезков пищевода специальным сшивающим аппаратом НИИХАИ. Применение механического шва значительно сокращает время операции и упрощает технику создания анастомоза. Противопоказаниями являются значительный диастаз между сегментами, резкое недоразвитие дистального отрезка пищевода и недоношенность III—IV степени.
Техника наложения анастомоза с помощью, сшивающего аппарата. После выделения и мобилизации сегментов пищевода, перевязки и пересечения пищеводно-трахеального свища убеждаются в возможности создания анастомоза. Затем на край нижнего сегмента пищевода накладывают обвивной шов, не затягивая его.
Перед наложением анастомоза хирург тщательно готовит и проверяет аппарат (рис. 14, а). Для этого упорную головку 1 отвинчивают от стержня 2, заостренный конец его убирают внутрь корпуса аппарата 3 и закрепляют в таком положении фиксатором 4. Проверив зарядку аппарата танталовыми скрепками, подвижную рукоятку отводят в исходное положение и закрывают предохранитель 5. В таком положении ассистент вводит аппарат осторожно через
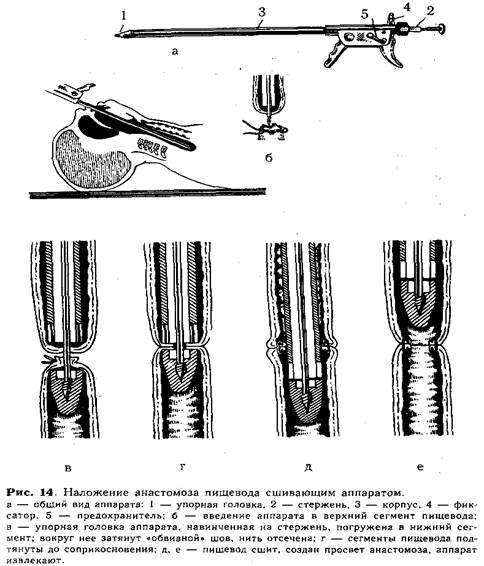
рот ребенка вверхний сегмент пищевода (рис. 14, б). Открыв фиксатор, продвигают стержень вперед, прокалывая им стенку слепого конца пищевода. Затем хирург, вращая стержень за пуговку, навинчивает упорную головку и погружает ее в нижний сегмент. Над упорной головкой завязывают ранее наложенный «обвивной» шов, нить отсекают (рис. 14, в). Подтягивая стержень в корпус, приводят в соприкосновение нижний и верхний сегменты (рис. 14, г), закрепив это положение фиксатором с зазором 0,7 или 1,2 мм (в зависимости от толщины сшиваемых стенок пищевода). Открыв предохранитель, ассистент плавным нажатием подвижной рукоятки прошивает пищевод скобками. При этом происходит высечение участков нижнего и верхнего сегментов и образуется просвет созданного анастомоза. Далее, возвратив рукоятку в исходное положение и открыв предохранитель поворотом фиксатора, освобождают стержень и продвигают упорную головку в нижний сегмент на 0,5—1 см, а затем осторожно проводят вперед за линию анастомоза конец корпуса аппарата (рис. 14, д, е). Только после этого, вплотную сомкнув упорную головку с корпусом, аппарат осторожно извлекают из пищевода. Удаление аппарата производят строго по продольной оси пищевода под контролем зрения.
Закончив создание анастомоза, через нос ребенка в желудок проводят тонкую полиэтиленовую трубку — дренаж для последующего питания. Грудную клетку послойно зашивают наглухо, оставляя в средостении тонкий полиэтиленовый дренаж на 1—2 дня.
Двойная эзофагостомия по Г. А. Баирову является первым этапом двухмоментной операции и состоит из ликвидации пищеводно-трахеаль-ных свищей, выведения орального сегмента пищевода на шею и создания из дистального его отрезка свища для питания ребенка в послеоперационном периоде. Поступающее через нижнее эзофагостомическое отверстие молоко не вытекает после кормления, так как при этой операции остается сохраненным кардиальный жом.
Техника нижней эзофагостомии. Убедившись, что создание прямого анастомоза невозможно, приступают к мобилизации сегментов пищевода. Вначале выделяют верхний сегмент на возможно большем протяжении. При наличии трахеального свища последний пересекают, и образовавшееся отверстие в пищеводе и трахее ушивают непрерывным краевым швом. Затем мобилизуют нижний сегмент, перевязывают его у трахеи и пересекают между двумя лигатурами. На короткую культю у трахеи накладывают несколько отдельных шелковых швов. Блуждающий нерв отстраняют кнутри, и пищевод осторожно выделяют до диафрагмы (рис. 15, а). Тупым путем (раскрывая введенный зажим Бильрота) расширяют пищеводное отверстие, подтягивают желудок и рассекают вокруг кардиального отдела листок брюшины (беречь блуждающий нерв!}. После этого ребенка поворачивают на спину и про--изводят верхнюю лапаротомию правым парамедианным разрезом. Мобилизованный дистальный сегмент проводят в брюшную полость через расширенное пищеводное отверстие (рис. 15, б, в). В надчревной области слева от средней линии производят поперечный разрез (1 см) через все слои брюшной стенки.
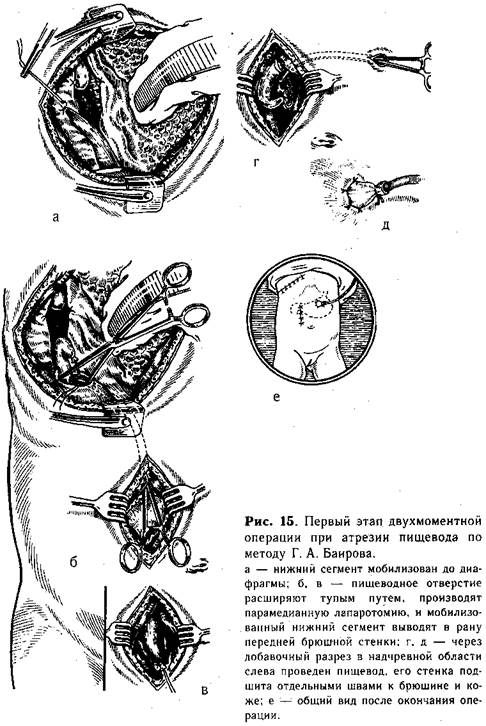
В образованное отверстие проводят мобилизованный пищевод (рис. 15, г) таким образом, чтобы он возвышался над кожей не менее 1 см. Стенку его изнутри фиксируют несколькими швами к брюшине, снаружи подшивают к коже (рис. 15, д). В желудок через выведенный пищевод вставляют тонкую трубку, которую фиксируют шелковой нитью, завязанной вокруг выступающей части пищевода. Раны брюшной стенки и груди зашивают наглухо (рис. 15, е). Операцию заканчивают выведением верхнего сегмента пищевода.
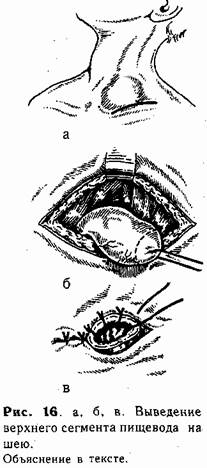
Техника верхней эзофа-гостомии. Под лопатки ребенку под-кладывают тонкий валик (свернутую пеленку). Голову поворачивают направо. Разрез кожи длиной до I —1,5 см проводят над ключицей слева у внутреннего кран груднно-ключично-сос-цевидной мышцы (рис. 16, а). Рассекают поверхностную фасцию и тупо расслаивают ткани до пищевода (последний обнаруживают по введенному в него до операции катетеру). Изогнутым концом диссектора обходят пищевод, мобилизуют в дистальном направлении, и слепой конец выводят в рану (рис. 16, б). Несколькими (4—5) отдельными швами {атравматической иглой) стенку его по окружности фиксируют в глубине раны к мышцам шеи. Затем просвет пищевода вскрывают, отсекая его верхушку, и края через все слои подшивают к коже (рис. 16, в).
Второй этап операции — образование пищевода из толстой кишки — проводят в возрасте 1 1/2—2 лет.
Послеоперационное лечение. Успех операции во многом зависит от правильного проведения послеоперационного периода. Для более тщательного ухода и внимательного наблюдения в первые дни после хирургического вмешательства ребенку необходим индивидуальный сестринский пост и постоянный контроль врача. Ребенка укладывают в обогреваемый кувез, придавая телу возвышенное положение, постоянно дают увлажненный кислород. Продолжают введение антибиотиков, витаминов К, С, группы В, поле УВЧ на грудь. Через 24 ч после операции проводят контрольную рентгенограмму грудной полости. Выявление ателектаза на стороне операции является показанием к санации трахео-бронхиального дерева.
В первые часы после операции у ребенка может прогрессивно нарастать дыхательная недостаточность, которая требует срочной интубации трахеи и вспомогательного дыхания (после отсасывания из трахеи слизи). Через несколько часов состояние ребенка обычно улучшается и можно удалить трубку из трахеи. Повторно интубацию после создания анастомоза следует делать с большой осторожностью и только врачу, имеющему опыт проведения этой манипуляции у новорожденных. Ошибочное введение трубки вместо трахеи в пищевод грозит разрывом швов анастомоза.
Положительный эффект дает проведение оксигенобаротерапии. В послеоперационном периоде после одномоментного восстановления непрерывности пищевода дети получают в течение 1—2 дней парентеральное питание. Очень важен правильный расчет количества жидкости, необходимой для парентерального введения ребенку (см. гл. 1).
Некоторые хирурги для кормления ребенка после наложения анастомоза образуют свищ желудка. Мы не прибегаем к этой добавочной операции, так как проводим в желудок во время основного вмешательства тонкую (0,2 см) полиэтиленовую трубку-дренаж, через которую начинаем питание ребенка (каждые 3 ч, очень медленно, грудным молоком, чередуя с раствором глюкозы). Разовое количество жидкости в первый день кормления не должно превышать 5—7 мл. В последующие дни постепенно добавляют грудное молоко и глюкозу (по 5— 10 мл), доводя суточный объем жидкости к концу недели после операции до возрастной нормы. Кормление через зонд производят при вертикальном положении ребенка, что предупреждает регургитацию жидкости через функционально неполноценный у новорожденного карди-альный жом. При неосложненном течении зонд удаляют на 8—9-й день.
Проходимость пищевода и состояние анастомоза контролируют через 9—10 дней рентгенологическим обследованием с йодолиполом. Отсутствие признаков несостоятельности анастомоза позволяет начинать кормление через рот из рожка или с ложечки. В первое кормление ребенку дают 10—20 мл 5% раствора глюкозы, а затем — грудное молоко в. половинной дозе от того количества, которое новорожденный получал при кормлении через зонд. В последующие дни к каждому кормлению количество молока увеличивают ежедневно на 10—15 мл, доводя его постепенно до нормы соответственно возрасту и массе тела. Дефицит жидкости компенсируют парентерально дробным ежедневным введением 10% раствора глюкозы, плазмы, крови или альбумина. Это позволяет избежать у новорожденного заметного падения массы тела.
На 10—14-й день ребенка прикладывают к груди сначала на 5 мин и производят контрольное взвешивание. Докармливают ребенка из рожка. В этот период необходимое количество пищи рассчитывают, исходя из массы тела ребенка: оно должно колебаться между 1/5 и 1/6 массы тела новорожденного.
Постепенно увеличивают время прикладывания к груди и в начале 4-й недели переходят на 7-кратное кормление.
Послеоперационное ведение ребенка, которому произведена первая часть двухэтапной пластики пищевода, имеет некоторые отличия в связи с возможностью питания через эзофагостомическое отверстие. Незначительные размеры желудка новорожденного, нарушение его моторной функции из-за травмы во время создания свища требуют дробного кормления с постепенным увеличением количества вводимой жидкости. Ниже приводим примерную схему кормления ребенка после проведения первого этапа двухмоментной операции: 1-й день —3—5мл х 10; 2-й день — 7 мл х 10; 3—4-й день—15—20мл х 10; 5-й день —25—30мл х 10; 6-й день — 30—40мл х 10. Остальное необходимое количество жидкости вводят парентерально. С 7-го дня после операции объем желудка увеличивается настолько, что через эзофагостомическое отверстие можно медленно вводить до 40—50 мл (3/4 общего количества жидкости восполняют грудным молоком и 1/4—10% раствором глюкозы). С 10-го дня переходят на 7-разовое кормление с нормальными по объему дозировками.
В первые дни и недели после вмешательства необходим тщательный уход за свищами на шее и передней брюшной стенке. Последний особенно нуждается в частой смене повязок, обработке кожи антисептическими пастами, УФО. Введенный в желудок тонкий резиновый дренаж не извлекают 10—12 дней до полного формирования нижнего эзофагеального свища. Затем зонд вводят только на время кормления.
Швы снимают на 10—12-й день после операции. Выписывают детей из стационара (при неосложненном течении) после того, как устанавливается стойкая прибавка массы тела (5—6-я неделя). Если новорожденному была сделана двойная эзофагостомия, то мать ребенка необходимо обучить правильному уходу за свищами и методике кормления.
Дальнейшее наблюдение за ребенком ведут амбулаторно хирург совместно с педиатром. Профилактические осмотры следует проводить каждый месяц до направления ребенка на II этап операции — создание искусственного пищевода.
Хирургические осложнения в послеоперационном периоде возникают преимущественно у новорожденных, которым проведена одномоментная пластика пищевода.
Наиболее тяжелым осложнением следует считать несостоятельность швов анастомоза, которая, по опубликованным данным, наблюдается у 10—20% оперированных. Возникающие при этом медиастинит и плеврит обычно заканчиваются летальным исходом, несмотря на создание гастростомы, дренирование средостения и полости плевры. При раннем распознавании расхождения швов анастомоза необходимо срочное проведение реторакотомии и создание двойной эзофагостомии.
В ряде случаев после создания прямого анастомоза наступает река-нализация трахеопищеводного свища, которая проявляется резкими приступами кашля при каждой попытке кормления через рот. Осложнение распознается при исследовании пищевода с контрастным веществом, (йодолипол затекает в трахею), и окончательный диагноз устанавливается путем поднаркозной трахеобронхоскопии. Лечение проводят путем
создания гастростомы и дренирования средостения (при нарастании явлений медиастинита).
После стихания воспалительных изменений и окончательного формирования свищевого хода показана повторная операция. Иногда реканали-зация сочетается со стенозом в области анастомоза.
После одномоментного создания анастомоза пищевода все дети подлежат диспансерному наблюдению не менее 2 лет, так как в этот период возможно возникновение поздних осложнений.
У части детей спустя 1 1/2—2 мес после операции появляется грубый кашель, который связан с образованием спаек и рубцов в области анастомоза и трахеи. Проведение физиотерапевтических мероприятий помогает избавиться от этого позднего осложнения, которое ликвидируется обычно в возрасте 5—6 мес.
В период до 1 —1 1/2лет после операции может возникнуть изолированное сужение пищевода в области анастомоза. Лечение указанного осложнения обычно не вызывает затруднений: несколько сеансов бужи-рования (под контролем эзофагоскопии) приводят к выздоровлению.
В редких случаях консервативные мероприятия оказываются безуспешными, что является показанием к повторной торакотомии и пластике суженного отдела пищевода.
Отдаленные результаты, прослеженные нами в течение 5— 40 лет у детей после создания анастомоза, показывают, что они не отстают в развитии от своих сверстников. Применение механического шва пищевода не сказывается отрицательно на развитии органа.
Обследование 35 детей, которым завершен II этап двухмоментной операции (загрудинная пластика пищевода толстой кишкой), выявило, что созданный пищевод хорошо функционирует, регургитации нет в связи с сохраненным кардиальным жомом.
ПИЩЕВОДНО ТРАХЕАЛЬНЫЕ СВИЩИ
Наличие врожденного соустья между пищеводом и трахеей без других аномалий этих органов встречается редко. За последние 30 лет мы оперировали 28 детей в возрасте от первых дней жизни до 10 лет с изолированными пищеводно-трахеальными свищами. Кроме того, в клинику был направлен 31 новорожденный с подозрением на это патологическое состояние. При тщательном обследовании заболевание у них было исключено.
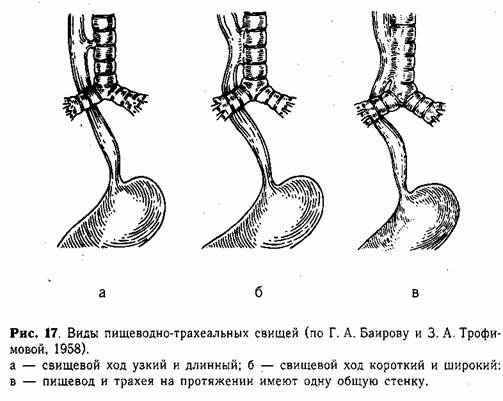
Встречаются три основных варианта порока (рис. 17), среди которых наблюдается преимущественно короткий и широкий свищевой ход. Соустье, как правило, расположено высоко, на уровне первых грудных позвонков.
Наличие свищевого хода между пищеводом и трахеей ведет к быстрому развитию пневмонии в связи с аспирацией жидкости, проглатываемой ребенком. Нераспознанный и нелеченный свищ обычно является причиной гибели ребенка. Только при узком соустье симптомы иногда выражены слабо, и в таких случаях больные могут жить долго.
Клиническая картина. Симптомы пищеводно-трахеального свища проявляются в большинстве случаев после первых кормлений ребенка, но интенсивность их зависит от варианта порока развития.
Узкий и длинный свищевой ход (рис. 17, а) обычно не выявляется в период новорожденности. У таких детей при кормлении изредка возникают сильные приступы кашля. Родители не придают им значения, так как кормление в определенном положении ребенка избавляет его от приступов. Ребенок часто болеет пневмонией.
В случаях широкого и короткого свища (рис. 17, б) кормление новорожденного почти всегда сопровождается приступом кашля, цианозом, пенистыми выделениями изо рта. У таких детей быстро развивается ас-пирационная пневмония. После еды количество влажных крупнопузырчатых хрипов в легких увеличивается. Кормление ребенка в вертикальном положении уменьшает возможность затекания молока через свищевой ход в трахею, и кашель возникает реже, не сопровождаясь цианозом.
Большое соустье, при котором оба органа на некотором расстоянии представлены как бы одной общей трубкой (рис. 17, в), проявляется при первом кормлении. Каждый глоток жидкости вызывает приступ кашля. Нарушение дыхания бывает продолжительным, сопровождающимся резким цианозом. Общее состояние прогрессивно ухудшается из-за тяжелой пневмонии и обширных ателектазов легких.
Рентгенологическое исследование имеет определенное значение для диагностики пищеводно-трахеального свища. На обзорных рентгенограммах выявляют характер патологических изменений в легких. Если клинически и рентгенологически определена аспирационная пневмония, то специальные исследования откладывают до стихания процесса в легких (лечение пневмонии является частью предоперационной подготовки). У старших детей свищевой ход может быть выявлен рентгенологически при исследовании пищевода с жидким контрастирующим веществом — йодолиполом или липоидолом. Ребенка укладывают на экран на рентгеновском столе в горизонтальном положении. Контрастирующее вещество дают из ложки или вводят через катетер, введенный в начальный отдел пищевода. Принято считать, что частичное или полное заполнение бронхиального дерева контрастирующим веществом свидетельствует о наличии соустья. Последнее на рентгенограмме обычно не определяется. Внимательно наблюдая через экран за прохождением контрастирующего вещества по пищеводу, иногда можно уловить момент прохождения его через свищ в трахею.
Клинико-рентгенологические данные о наличии пищеводно-трахеального свища могут быть подтверждены при эзофагоскопии. При введении эзофагоскопа и осмотре пищевода свищевой ход становится заметным по выделяющимся из него в такт дыханию мелким пузырькам воздуха. Узкий свищ при эзофагоскопии обычно не виден, он маскируется складками слизистой оболочки.
Отчетливо свищевой ход определяется только при трахеобронхоско-пии, которую производят под наркозом всем детям с подозрением на пищеводно-трахеальную фистулу. При введении бронхоскопа на глубину 8—12 см обычно выше бифуркации трахеи на 1—2 см по заднепра-вой ее поверхности виден щелевидный дефект (фистула), расположенный вдоль хрящевого кольца. Выявление фистулы облегчается при введении в пищевод 1 % раствора метиленового синего, который, проникая в трахею через свищ, подчеркивает его контуры.
Дифференциальная диагностика затруднена в период новорожденности, когда приходится исключать пищезодно-трахеальный свищ при наличии у ребенка родовой травмы, сопровождающейся нарушением акта глотания или парезом мягкого неба. При кормлении у таких новорожденных периодически возникают приступы кашля, нарушение ритма дыхания и нарастает пневмония. Рентгенологическое исследование пищевода с йодолиполом в этих случаях не уточняет диагноза, так как при обоих заболеваниях может произойти забрасывание (аспирация) контрастирующего вещества в дыхательные пути (бронхография). Для дифференциальной диагностики кормление ребенка начинают только через зонд, вводимый в желудок. После стихания аспирационной пневмонии производят трахеобронхоскопию, которая позволяет подтвердить или исключить диагноз пищеводно-трахеального свища.
Лечение. Ликвидация врожденного пищеводно-трахеального свища возможна только оперативным путем. Хирургическое вмешательство проводят сразу после установления диагноза.
Предоперационная подготовка. Предоперационную подготовку начинают сразу после выявления клинических симптомов пищеводно-трахеального свища. Ребенку полностью исключают кормление через рот — все необходимое количество жидкости вводят в желудок через зонд, который удаляют после каждого кормления. С первого дня начинают активное противопневмоническое лечение: антибиотики, оксигеноте-рапия, поле УВЧ на грудную клетку, щелочной аэрозоль с антибиотиками, горчичное обертывание, внутривенное введение плазмы крови, витаминов. Ребенок находится в обогреваемом кувезе с повышенной влажностью. Проводят несколько сеансов оксигенобаротерапии. Длительность предоперационной подготовки различна: 2—10 дней (до ликвидации или заметного уменьшения явлений пневмонии).
Операцию при врожденном пищеводно-трахеальном свище проводят под эндотрахеальным наркозом и защитным переливанием крови. Положение ребенка — на левом боку.
Техника операции. Наиболее удобный доступ у грудных детей— экстраплевральный, в четвертом межреберье справа (при высоком свище — C1—Th1—рекомендуют доступ разрезом на шее). Легкое, покрытое плеврой, отводят кпереди и кнутри, над пищеводом отслаивают медиастинальную плевру. Пищевод мобилизуют на протяжении 1,5—2 см кверху и книзу от места его сообщения с трахеей.
При наличии длинного свищевого хода (см. рис. 17, а) последний выделяют, перевязывают двумя шелковыми лигатурами, пересекают между ними, а культи обрабатывают спиртовым раствором йода. Над пересеченным свищевым ходом на пищевод и трахею накладывают один ряд погружных шелковых швов атравматической иглой.
При широкой и короткой фистуле (см. рис. 17, б) пищевод осторожно отсекают ножницами от трахеи, и образовавшиеся отверстия закрывают двухрядным непрерывным швом атравматичными иглами. Для предупреждения послеоперационного сужения пищевода последний сшивают в поперечном направлении (над введенным до операции катетером).
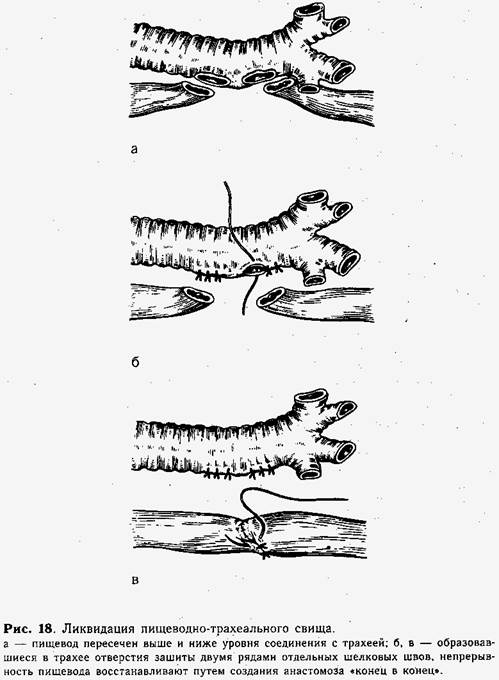
Наиболее сложным для ликвидации является большой пищеводно-трахеальный свищ, при котором оба органа на некотором протяжении (0,7—1 см) имеют общие стенки (см. рис. 17, в). В таких случаях пищевод пересекают выше и ниже уровня соединения с трахеей (рис. 18, а). Образовавшиеся на трахее отверстия зашивают двумя рядами шелковых швов (рис. 18, б), затем восстанавливают непрерывность пищевода путем создания анастомоза «конец в конец» (рис. 18, в). В желудок проводят тонкую полиэтиленовую трубку для кормления ребенка. При экстраплевральном доступе в медиастинальное пространство к области швов пищевода подводят (через отдельный прокол в шестом межреберье) тонкую (3—4 мм) полиэтиленовую трубку на 2—3 дня. Грудную, полость закрывают наглухо. При трансплевральном доступе зашивают медиастинальную плевру. Оставшийся после зашивания грудной стенки в полости плевры воздух (выявленный на контрольных рентгенограммах) отсасывают шприцем при пункции.
Послеоперационное лечение. В послеоперационном периоде ребенок продолжает получать активную терапию против пневмонии, так как обычно операция вызывает обострение процесса в легких. Больному создают возвышенное положение, назначают аэрозольтерапию, постоянно дают увлажненный кислород, вводят антибиотики, сердечные средства. В первый день после операции ставят горчичники на грудную клетку слева, а со следующего дня на область легких назначают поле УВЧ. По показаниям проводят бронхоскопию и отсасывание слизи.
Б первые сутки ребенку необходимо парентеральное питание, затем кормление осуществляют дробными дозами каждые 3 ч через тонкий зонд, оставленный при операции. Количество жидкости рассчитывают в зависимости от возраста и массы тела ребенка. В течение 2—3 дней '/3 объема жидкости вводят через зонд, остальное количество — капельно внутривенно. Зонд удаляют на 5—6-е сутки (при создании анастомоза «конец в конец» кормление через зонд продолжают 9—10 дней). К б—8-му дню ребенок должен получать обычную возрастную норму грудного молока. Старшим детям назначают жидкую пищу с 7—8-го дня после операции.
Больного выписывают домой на 20—25-й день при ликвидации явлений пневмонии (у грудных детей, кроме того, должна установиться стойкая прибавка массы тела). Перед выпиской производят контрольное рентгенологическое исследование пищевода с контрастированием. В случаях выявления сужения в области бывшего свища следует провести' курс бужирования, которое начинают не раньше, чем спустя месяц после операции.
ПОВРЕЖДЕНИЯ ПИЩЕВОДА
У детей повреждения пищевода наблюдаются сравнительно редко, возникая главным образом в связи с химическими ожогами или перфорацией стенки органа (инородными телами, инструментами). Клиническое течение и лечебные мероприятия при этих различных по своему характеру повреждениях имеют особенности.
Химические ожоги
Тяжесть ожога пищевода и степень его патологоанатомических изменений зависят от количества и характера химического вещества, проглоченного ребенком.
При воздействии кислот глубина поражения стенки пищевода меньше, чем при воздействии щелочей. Это объясняется тем, что кислоты, нейтрализуя щелочи тканей, коагулируют белок клеток и одновременно
отнимают от них воду. В результате образуется сухой струп, препятствующий проникновению кислот вглубь. Воздействие щелочей на ткани сопровождается колликвационным некрозом. Отсутствие струпа приводит к глубокому проникновению едкого вещества в ткани и повреждению их. С. Д. Терновский и соавт. (1963) различают три степени ожога пищевода: легкую, среднюю и тяжелую.
Легкая степень характеризуется повреждением слизистой оболочки по типу десквамативного эзофагита. При этом отмечаются гиперемия, отек и участки поверхностного некроза. Стихание воспалительного процесса и эпителизация наступают в течение 7—10 дней. Образующиеся поверхностные рубцы эластичны, не суживают просвета пищевода и не влияют на его функцию.
При средней степени поражения более глубокие. Некроз распространяется на все слои органа. Через 3—6 нед, по мере отторжения некротических тканей, раневая поверхность покрывается грануляциями, а затем рубцуется. Глубина и распространенность рубцовых изменений зависят от тяжести поражения стенки пищевода.
Тяжелая степень характеризуется глубокими и обширными повреждениями пищевода с некрозом всех слоев его стенки. Ожог сопровождается медиастинитом.
Клиническая картина ожога пищевода зависит от характера вещества, вызвавшего ожог, и степени поражения пищевода. С первых часов после ожога состояние детей тяжелое из-за развивающихся явлений'шока, отека гортани и легких, а также интоксикации и эксикоза. В результате быстро нарастающего воспаления отмечается обильное слюноотделение, нередко повторные, болезненные рвоты. С момента попадания едкого вещества появляется жгучая боль во рту, в глотке, за грудиной и в надчревной области. Она усиливается при глотательных, кашлевых и рвотных движениях, поэтому все дети упорно отказываются от принятия пищи и питья. Воспалительный процесс сопровождается повышением температуры тела до высоких показателей. Явления дисфагии можно объяснить как болью, так и набуханием слизистой оболочки пищевода.
В клиническом течении заболевания различают три периода. Первый период характеризуется острыми явлениями воспаления слизистой оболочки глаз, глотки и пищевода, причем в ближайшие часы отек и боль нарастают, ребенок отказывается от еды, отмечается высокая лихорадка. Это продолжается нередко до 10 дней, а затем состояние ребенка улучшается, исчезает боль, уменьшается отек, нормализуется температура тела, восстанавливается проходимость пищевода — дети начинают есть любую пищу. Острая стадия постепенно переходит в бессимптомный период. Кажущееся благополучие иногда длится-до 4 нед. Через 3—6 нед после ожога наступает период рубцевания. Постепенно нарастают явления непроходимости пищевода. У детей возникает рвота, присоединяются загрудинные боли.
Рентгенологическое исследование с контрастированием в период рубцевания позволяет выявить характер, степень и протяженность патологического процесса.
Лечение. Ребенка, получившего химический ожог пищевода, необходимо экстренно госпитализировать. В острой стадии заболевания проводят мероприятия по выведению из шокового состояния н энергичную детоксикационную терапию, направленную на предупреждение или уменьшение местного и общего действия яда. Для этого пострадавшему вводят обезболивающие и сердечные средства, через зонд промывают желудок. В зависимости от характера едкого вещества промывания делают либо 0,1% раствором соляной кислоты (при ожоге щелочью), либо 2—3% раствором питьевой соды (при ожоге кислотой) в объеме 2—3 л. По данным С. Д. Терновского, осложнений от введения желудочного зонда не возникает. Боязнь перфорации пищевода при этой манипуляции следует считать необоснованной.
В комплекс противошоковых мероприятий, кроме введения сердечных средств и пантопона, включают внутривенные вливания плазмы, раствора глюкозы, вагосимпатическуго шейную новокаиновую блокаду. Для предупреждения легочных осложнений целесообразны постоянная ингаляция увлажненным кислородом и возвышенное положение. Возможность наслоения вторичной инфекции диктует раннее применение антибактериальной терапии (антибиотики широкого спектра действия).
Желудок промывают не только при оказании неотложной помощи, но также и через 12—24 ч после ожога. При этом удаляются оставшиеся в желудке химические вещества.
Важным лечебным фактором считают применение гормонов, витаминотерапии и назначение рационального питания. В тяжелых случаях, когда дети отказываются от пищи и воды, для снятия интоксикации и с целью парентерального питания в течение 2—4 дней вводят внутривенно белковые препараты и жидкость. По улучшении общего состояния больному назначают кормление через рот высокоэнергетичной охлажденной пищей, сначала жидкой (бульон, яйцо, молоко), а затем хорошо протертой (овощные супы, творог, каши). С первых дней после травмы дети должны получать через рот по I десертной ложке растительного или вазелинового масла, оно действует смягчающе и улучшает прохождение пищевого комка по пищеводу.
До последних лет основным методом лечения ожогов пищевода считают бужирование. Различают раннее, или профилактическое, бужирова-ние и позднее, лечебное,— при Рубцовых стенозах пищевода. Тактика лечения определяется степенью ожога полости рта, глотки и пищевода. Для выявления и оценки характера поражения и его распространенности проводят диагностическую эзофагоскопию.
Раннее бужирование предупреждает формирование рубцовых стенозов пищевода. К бужированию приступают с 5—8-го дня после ожога. Применяют только специальные мягкие бужи. К этому времени стихают острые воспалительные изменения в стенке пищевода, появляются грануляции, улучшается общее состояние ребенка, нормализуется температура тела [Биезинь А. П., 1966]. Бужирование проводят без обезболивания 3 раза в неделю на протяжении 1 1/2—2 мес. В этот период ребенок находится в стационаре. Затем его выписывают на амбула-
торное лечение, назначив бужирование 1 раз в неделю в течение 2— 3 мес, а в последующие полгода—1—2 раза в месяц.
В редких случаях, при тяжелых и распространенных ожогах, сопровождающихся медиастинитом, ребенок не может принимать пищу. Для предупреждения истощения прибегают к созданию гастростомы, которая необходима также для полного покоя органа. Это благоприятно отражается на течении воспалительного процесса и способствует регенерации. Только после того, как ребенок будет выведен из тяжелого состояния, решают вопрос о методе дальнейшего лечения. Обычно с 5—7-й недели начинают попытки прямого бужирования с помощью эзофагоскопа. Наличие гастростомы позволяет применять «бужирование по нитке».
При своевременном и правильном лечении химических ожогов пищевода у детей хорошие отдаленные результаты получают почти в 90% случаев [Терновский С. Д. и др., 1963; Биезинь А. П. и др., 196.6], Возникшая после ожога рубцовая непроходимость пищевода является показанием к пластике пищевода кишечным трансплантатом.
Перфорация пищевода
Перфорация пищевода у детей возникает преимущественно при бужиро-вании по поводу рубцового стеноза, повреждениях острым инородным телом или при инструментальном исследовании. До 80% этих осложнений возникают в лечебных учреждениях, что создает благоприятные условия для раннего распознавания их и оказания необходимой лечебной помощи. Однако в связи с тем, что повреждения пищевода чаще наблюдаются у детей первых лет жизни, своевременная диагностика осложнений бывает крайне затруднена. Обычно у лечащего врача мысль о перфорации пищевода возникает в связи с развитием признаков меди-астинита. Крайне тяжелое течение и прогноз этого осложнения у детей большинство хирургов объясняют анатомическими особенностями строения средостения.
Клиническая картина острого гнойного медиастинита у детей, особенно младшего возраста, непостоянна и в значительной степени зависит от характера повреждения пищевода.
При медленном образовании прободения, наблюдаемом в связи с пролежнем стенки пищевода инородным телом (монетой, костью), в процесс постепенно вовлекаются окружающие ткани, которые реагируют воспалительной демаркацией. Это ведет к некоторому отграничению процесса, и момент повреждения пищевода уловить крайне сложно. Осложнение в таких случаях диагностируется по совокупности быстро развивающихся общих симптомов, физикальных и рентгенологических данных.
Одним из первых симптомов острого гнойного медиастинита является боль в груди. Локализацию выяснить трудно, и только у старших детей можно уточнить, что она бывает загрудинной и усиливается при глотании.
Сопротивление ребенка обследованию обычно исключает возможность использования для диагностики «болевых» симптомов — появление болей при запрокидывании головы или пассивном смещении трахеи.
Ребенок становится малоподвижным, всякое изменение положения в постели вызывает беспокойство и сопротивление из-за усиливающейся боли. Общее состояние больного быстро ухудшается. Появляется одышка. Заболевание часто сопровождается упорным кашлем. Повышается температура тела до 39—40 0С. При физикальном обследовании выявляются влажные хрипы, в ряде случаев—укорочение перкуторного звука в межлопаточном пространстве. При исследовании крови отмечается резкое повышение количества лейкоцитов, нейтрофилов со сдвигом в лейкоцитарной формуле влево.
Рентгенологический метод исследования, как правило, подтверждает предположительный диагноз. Расширение тени средостения, наличие эмфиземы и исследование с контрастированием обычно позволяют установить уровень повреждения пишевода. Эзофагоскопию при острых гнойных медиастинитах у детей обычно не проводят, так как добавочная травматизация органа может ухудшить и без того тяжелое состояние больного.
Медиастиниты, возникающие у детей при перфорации пищевода острыми инородными телами, диагностируются с меньшими трудностями. Сам факт наличия в пищеводе острого тела позволяет думать о повреждении стенки органа. Если инструментальное удаление инородного тела оказалось невозможным и у больного наступило резкое ухудшение общего состояния, появилась боль в груди, повысилась температура тела, то сомневаться в диагнозе не приходится. Распознаванию медиастинита помогают данные рентгенологического исследования (стационарное положение инородного тела, расширение тени средостения, а иногда и наличие в нем газа). В таких случаях показано немедленное оперативное удаление инородного тела.
Перфорация пищевода инструментами возникает обычно во время бу-жирования по поводу рубцового сужения или при эзофагоскопии. Опубликованные данные указывают на серьезный прогноз при этом осложнении. Диагностика, как правило, не вызывает затруднений из-за появления резкой боли в момент повреждения стенки пищевода. Перфорация сопровождается явлениями шока, ребенок бледнеет, наполнение пульса уменьшается, заметно понижается артериальное давление. После извлечения бужа и проведения специальной терапии (обезболивающие средства, внутривенное вливание кальция хлорида, крови, противошоковой жидкости) состояние больного несколько улучшается, но боль в груди продолжает беспокоить. Быстро развиваются общие симптомы медиастинита: повышается температура тела, появляются одышка, явления пневмонии, изменяется картина крови, резко ухудшается самочувствие. При повреждении пищевода и локализации воспаления в нижних отделах средостения отмечаются боль под мечевидным отростком и симптомы раздражения брюшины. Часто выявляется подкожная эмфизема. Ведущую роль в установлении диагноза перфораций пищевода играет
рентгенологическое исследование. Прямыми рентгенологическими симптомами являются наличие воздуха в мягких тканях средостения и шеи, а также затекание контрастирующей массы за контуры пищевода.
Лечение детей с перфорацией пищевода и развитием гнойного очага в средостении требует индивидуального подхода и должно быть комплексным. Сразу по установлении диагноза начинают интенсивную консервативную терапию.
Консервативная терапия заключается во внутривенном капельном введении крови, 10% раствора глюкозы, белковых препаратов, назначении антибиотиков, физиотерапии. Питание через рот полностью исключается. Наши наблюдения показывают, что только незначительное повреждение пищевода при бужировании (прикрытое) может быть излечено консервативными методами. Однако такие больные нуждаются в пристальном внимании хирурга. Отсутствие улучшения общего состояния в течение первых суток вынуждает производить оперативное вмешательство. В таких случаях проводимые консервативные мероприятия являются предоперационной подготовкой, длительность которой определяется индивидуально, но в тяжелых случаях не должна превышать нескольких часов.
Оперативное лечение начинают с создания гастростомы. Дальнейшая хирургическая тактика зависит от характера повреждения пищевода и степени распространения медиастинита.
Судя по опубликованным данным, вопрос о методе оперативного вмешательства при значительном повреждении пищевода еще не решен. Большинство авторов указывают, что у детей необходимо производить срочное ушивание перфорационного отверстия.
Наличие в пищеводе острого инородного тела, приведшего к перфорации и развитию медиастинита, является показанием к срочной медиасти-нотомии. Операция в таких случаях преследует две цели — удаление инородного тела и дренирование средостения. Промедление с хирургическим вмешательством ухудшает течение послеоперационного периода.
При медленном образовании прободения (пролежни), связанного с длительным пребыванием инородного тела в пищеводе, показано дренирование средостения. Характер оперативного доступа зависит от уровня воспаления: верхние отделы дренируют путем шейной медиастинота-мии по Разумовскому, средние и задненижние — внеплевральным доступом по Насилову. Независимо от методов дренирования, при вмешательстве необходимо щадить образовавшиеся в средостении сращения, которые в известной мере предупреждают распространение гнойного процесса.
Если осложнение диагностировано сравнительно поздно, и у ребенка имеется сформировавшийся отграниченный гнойник, то дренирование средостения также бывает необходимым и часто оказывается эффективным.
Повреждение пищевода и быстрое распространение гнойного процесса в средостении обычно ведет к прорыву гнойника в плевральную полость. В таких случаях показана срочная торакотомия с дренированием полости плевры. Однако хирургу, приступающему к операции, следует
помнить о том, что вмешательство редко бывает «типичным». Иногда приходится сталкиваться с крайне тяжелым поражением пищевода, при котором требуется резекция.
В нашу клинику был направлен мальчик 3'/2 лет, который месяц назад случайно выпил едкую шелочь. По улучшении общего состояния в больнице по месту жительства при попытке бужирования перфорирован пищевод. Во время операции мы обнаружили расплавление пищевода от Th4 до диафрагмы и продольный разрыв его по задней стенке. Произведена резекция измененной части органа. Верхний сегмент пищевода выведен на шею, нижний — зашит, средостение дренировано. Создана га-стростома по Кадеру. Через 3 года осуществлена загрудинная пластика пищевода кишечным трансплантатом.
Послеоперационное лечение детей с перфорацией пищевода и медиас-тинитом требует настойчивости и большого внимания, применения всего комплекса терапевтических мероприятий.
Ребенку после операции создают возвышенное положение, назначают постоянно увлажненный кислород. Обезболивающие средства вводят через 4—6 ч. Капельное внутривенное вливание продолжают 2—3 дня. Трансфузию крови и белковых препаратов (плазма, альбумин) на первой неделе производят ежедневно, затем через I—2 дня. Ребенку назначают антибиотики широкого спектра действия (соответственно чувствительности), производя их. замену через 6—7 дней. Тампоны подтягивают через 2—3 дня, затем удаляют. Дренаж в средостении оставляют до прекращения гнойных выделений. Свищ пищевода обычно закрывается самостоятельно. Ребенку проводят физиотерапевтическое лечение (УВЧ, электрофорез калия йодида). Если имеется сообщение гнойника средостения с плевральной полостью и последняя была дренирована, то в системе активной аспирации следует создавать минимальное отрицательное давление — 5—7 см вод. ст. (0,490—0,686 кПа). Трубку из плевральной полости удаляют после ликвидации пищеводного свища и явлений плеврита.
Кормление ребенка осуществляют через гастростому высокоэнерге-тичной пищей. После ликвидации медиастинита и заживления раны пищевода начинают кормление через рот (если нет стеноза). Пластические операции на пищеводе (трансплантация кишки, резекция) возможны спустя не менее 2 лет после полного выздоровления от медиастинита.
Дата: 2019-02-02, просмотров: 332.