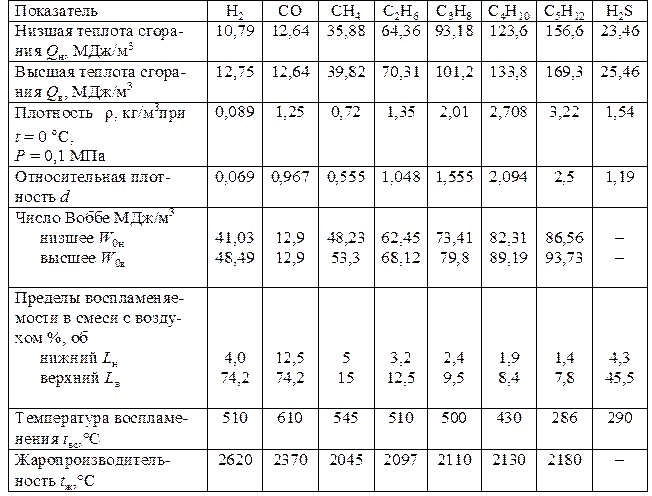
 Химическая формула газа отражает элементный химический состав последнего и позволяет отчасти представить его химические и физические свойства. Так, углеводородные газы состоят из простых углеводородных соединений, являющихся органическими веществами, содержащими в своем составе два химических элемента: углерод С и водород Н2. Самый простой углеводород, содержащий всего один атом углерода, – метан СН4. Все углеводороды, имеют общую формулу – СmHn, входят в гомологический ряд так называемых предельных или насыщенных углеводородов – соединений, в которых углерод до предела насыщен атомами водорода. При температуре 0 °С и давлении 760 мм рт. ст. из предельных углеводородов газами являются лишь метан – СН4, этан – С2Н6, пропан – С3Н8 и бутан – С4Н10. Наряду с нормальными предельными углеводородами существуют так называемые изомерные соединения, имеющие одинаковые с первыми химические формулы, но отличающиеся от них характером расположения атомов углерода, а также некоторыми свойствами. Пропан изомера не имеет. Начиная с бутана, каждая суммарная формула алканов охватывает несколько углеводородов, имеющих одинаковые молекулярные массы, но разную структуру. Так формуле С4Н10 отвечают два бутана: СН3–СН2–СН5–СН3 нормальный бутан; СН3–СН–СН3–СН3 изобутан. Изомер бутана – изобутан. Для обозначения нормального бутана используют русскую строчную курсивную букву «н» и записывают н-бутан, а к химической формуле изобутана добавляют приставку изо (также курсивом) и записывают изо-С4Н10 либо i-С4H10. Кроме предельных и их изомеров в составе сжиженных углеводородов могут присутствовать ненасыщенные или непредельные углеводороды, характеризующиеся двойной или тройной связью между атомами углерода. Это этилен – С2Н4, пропилен – С3Н6, бутилен – C4H8 и изобутилен – i-C4H8. Непредельные углеводороды с называются олефинами, или алкенами. Топливные газы представляют собой смесь отдельных газов, но при рассмотрении теплотехнических характеристик этой смеси нужно учитывать, что ее компоненты не вступают в химические реакции друг с другом.
Химическая формула газа отражает элементный химический состав последнего и позволяет отчасти представить его химические и физические свойства. Так, углеводородные газы состоят из простых углеводородных соединений, являющихся органическими веществами, содержащими в своем составе два химических элемента: углерод С и водород Н2. Самый простой углеводород, содержащий всего один атом углерода, – метан СН4. Все углеводороды, имеют общую формулу – СmHn, входят в гомологический ряд так называемых предельных или насыщенных углеводородов – соединений, в которых углерод до предела насыщен атомами водорода. При температуре 0 °С и давлении 760 мм рт. ст. из предельных углеводородов газами являются лишь метан – СН4, этан – С2Н6, пропан – С3Н8 и бутан – С4Н10. Наряду с нормальными предельными углеводородами существуют так называемые изомерные соединения, имеющие одинаковые с первыми химические формулы, но отличающиеся от них характером расположения атомов углерода, а также некоторыми свойствами. Пропан изомера не имеет. Начиная с бутана, каждая суммарная формула алканов охватывает несколько углеводородов, имеющих одинаковые молекулярные массы, но разную структуру. Так формуле С4Н10 отвечают два бутана: СН3–СН2–СН5–СН3 нормальный бутан; СН3–СН–СН3–СН3 изобутан. Изомер бутана – изобутан. Для обозначения нормального бутана используют русскую строчную курсивную букву «н» и записывают н-бутан, а к химической формуле изобутана добавляют приставку изо (также курсивом) и записывают изо-С4Н10 либо i-С4H10. Кроме предельных и их изомеров в составе сжиженных углеводородов могут присутствовать ненасыщенные или непредельные углеводороды, характеризующиеся двойной или тройной связью между атомами углерода. Это этилен – С2Н4, пропилен – С3Н6, бутилен – C4H8 и изобутилен – i-C4H8. Непредельные углеводороды с называются олефинами, или алкенами. Топливные газы представляют собой смесь отдельных газов, но при рассмотрении теплотехнических характеристик этой смеси нужно учитывать, что ее компоненты не вступают в химические реакции друг с другом.
Масса т, физическая величина, являющаяся мерой инертности и тяготения вещества (жидкости, газа). Измеряется в килограммах (кг). Однако масса не является мерой количества вещества. Единицей количества вещества считается моль, который равен количеству вещества системы, содержащей столько же структурных элементов (атомов, молекул), сколько атомов содержится в углероде массой 0,012 кг. Массу одного моля (киломоля) М называют молярной массой.
Объем газов V измеряют в кубических метрах (м3). Вследствие того, что объем газов изменяется при нагревании, охлаждении и сжатии, за его единицу принимают 1 м3 газа при нормальных условиях. Если температура t или давление Р отличаются от нормальных, то объем газа при нормальных условиях V0 определяется по формуле
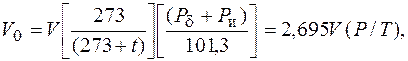
где V – объем газа, измеренный при рабочих условиях, м3; Рd – барометрическое давление, кПа, нормальное атмосферное давление Рd = 101,3 кПа; Ри – избыточное давление (измеренное манометром), кПа; Р – абсолютное давление, кПа, Р = Рd + Ри; t – температура, °С.
Основными точками для градуировки шкалы являются: температура плавления льда 0 °С и температура кипения воды 100 °С при нормальном атмосферном давлении 101,325 кПа; Т – абсолютная температура, К (абсолютная температура Т связана с температурой в градусах Цельсия t уравнением Т = t + 273 °С, абсолютный нуль температуры в градусах Цельсия равен – 273,15 °С).
Плотность газа – r характеризует его массу, приходящуюся на единицу объема (кг/м3). Известно, что плотность газов и их объем зависят от температуры. С повышением температуры объем газа в незамкнутых пространствах увеличивается, а в замкнутых возрастает его избыточное давление. В обоих случаях изменяется плотность газа. Для возможности сравнения свойств различных газов основные их характеристики должны быть приведены к одинаковым условиям. В технических расчетах это нормальные условия (Р = 760 мм рт. ст. t = 0 °С).
В финансовых же расчетах между поставщиками и потребителями газа применяют стандартные условия. В этом случае фактический объем газа, измеренный приборами учета при рабочем давлении и температуре, приводят с помощью специальных таблиц к объему при давлении 760 мм рт. ст. и температуре 20 °С. Плотность газа при нормальных условиях обозначается r0.
Зависимость изменения плотности при изменениях температуры и давления может быть выражена для газа однокомпонентного состава формулой
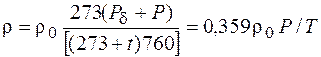 ,
,
где r – плотность газа при температуре отличной от 0 °С; r0 – плотность газа при температуре 0 °С и давлении 760 мм рт.ст.; Р – фактическое избыточное давление, мм рт. ст.; Рd – атмосферное (барометрическое) давление, мм рт. ст.; t – температура газа, °С; Р – абсолютное давление, мм рт. ст.; Т – абсолютная температура, К;
Плотность сложных газов при нормальных физических условиях может быть определена по формуле
rсм = 0,01(Sri × ri),
rсм = 0,01(r1r1 + r2r2 + ... + rn rn) = 0,01(0,72×СН4 + 1,35×С2Н6 +
+ 2,01×С3Н8 + 2,7×С4Н10 + 3,22×С5Н12 + 1,53×Н2S + 1,97×СО2 +
+ 1,25×N2) кг/м3;
ρ1, ρ 2, ..., ρn – плотность компонентов газа, кг/м3;
r1, r2, ..., rn – содержание компонентов, %.
Удельный объем v – величина обратная плотности r, определяющая отношение объема газа (м3) к его массе (кг), измеряется в кубических метрах на килограмм (м3/кг).
Давление – физическая величина, характеризующая интенсивность нормальных (перпендикулярных к поверхности) сил, с которыми одно тело действует на поверхность другого. В газовой среде давление связано с передачей импульса при столкновениях находящихся в тепловом движении молекул газа друг с другом или с поверхностью граничащих с газом тел. В СИ единица измерения давления – паскаль (Па). Паскаль равен давлению, вызываемому силой 1Н (ньютон), равномерно распределенной по нормальной (вертикальной) к ней поверхности площадью 1 м2. Удобно использовать Па×10 , т. е даПА так как давление выраженное в даПа равно величине давления выраженному в мм. рт. ст. На практике еще действующей единицей давления является техническая атмосфера (1 атм), равная в системе МКГСС давлению 1 кгс на поверхность 1 см2 (1 кгс/см2). Многие страны пользуются единицей давления – бар. Соотношения наиболее употребляемых в теплотехнике единиц, включая единицы давления, приводятся в табл. 4.
Для паров и газов различают избыточное Pи, абсолютное Pа и парциальное Pп давление. Причем абсолютное давление включает в себя избыточное давление (измеренное манометром) и барометрическое (атмосферное давление на данный момент).
Поскольку топливные газы практически всегда являются смесями отдельных (идеальных) газов, не вступающих между собой в химические соединения, то каждый идеальный газ, входящий в смесь, распространяется по всему объему смеси и имеет свое давление, называемое парциальным. Согласно закону Дальтона общее давление смеси равно сумме давлений отдельных газов, образующих эту смесь
Pa = P1 + P2 + ...+ Pn.
Таблица 7
Соотношение единиц давления
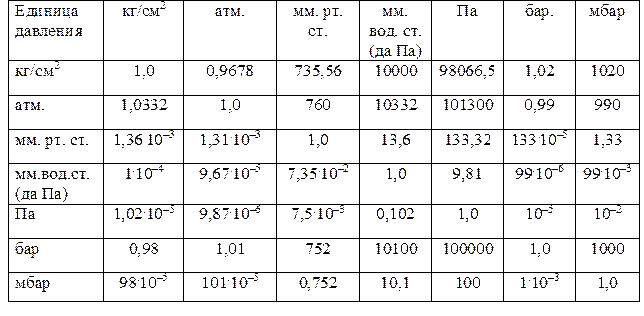
При этом парциальное давление каждого компонента смеси pi равно общему давлению, умноженному на объемное (молярное) содержание yi данного газа в смеси:
pi = yi Pи.
Давление избыточное Pи газов в практике их использования является одним из основных показателей, определяющих технику и технологию их применения. Системы газоснабжения по этому показателю подразделяются на четыре градации:
высокого давления I категории при избыточном давлении от 1,2МПа до 0,6МПа включительно для природного газа и газовоздушных смесей, и от 1,6МПа для сжиженных углеводородных газов (СУГ);
газопроводы высокого давления II категории при избыточном давлении газа свыше 0,3 МПа (3 кгс/см2) до 0,6 МПа (6 кгс/см2);
газопроводы среднего давления – при рабочем давлении свыше 500 даПа (0,05 кгс/см2) до 0,3 МПа (3 кгс/см2);
газопроводы низкого давления – при рабочем давлении газа до 500 даПа (0,05 кгс/см2) включительно.
Теплота сгорания Q – количество тепла, которое выделяется при полном сгорании единицы массы или объема газа (топлива). Теплоту сгорания газов в СИ измеряют в кило(мега) джоулях на килограмм (кДж/кг, МДж/кг) или в кило (мега-) джоулях на кубический метр (кДж/м3, МДж/м3), а на практике – нередко в килокалориях на килограмм (ккал/кг) или в килокалориях на кубический метр (ккал/м3), а так же в кВт.
Соотношения между единицами теплоты сгорания газов
1ккал/м3 = 4,19 кДж/м3; 1ккал / (ч×м2)  = 1,16 Вт/м2; 1МДж = 3,6 кВт
= 1,16 Вт/м2; 1МДж = 3,6 кВт
Для оценки тепловых свойств газов могут применяться низшая QH и высшая QB теплота сгорания. QH отличается от QB тем, что она не включает в себя скрытую теплоту испарения водяных паров, образующихся при сгорании одной единицы топлива. Поэтому не следует понимать показатель низшей и высшей теплоты сгорания как некие пределы, в границах которых колеблется теплообразующая способность топлива. Теплота сгорания некоторых индивидуальных газов, входящих в состав топливных углеводородных газов, приведена в табл. 4.
Определение низшей и высшей теплоты сгорания сложного газа
Qн,в = 0,01(SQ н,в i × CmHn), кДж/м³
где Q н,в i – низшая или высшая теплота сгорания отдельного компонента; CmHn – процентное содержание горючего в смеси газа.
Qн = 0,01(35880×CH4 + 64360×C2H6 + 93180×C3H8 +
+ 123600×C4H10), кДж/м³
Определение низшей и высшей теплоты сгорания
Qн,в = 0,01(∑Qн,вi × CmHn),
где Qн,вi – низшая теплота сгорания отдельного компонента; CmHn – процентное содержание газа. Развернутая формула для определения Qн. Для определения Qв смеси газов следует значения Qвi для каждого газа брать из справочника или таблицы 6, приведенной в пособии.
Число Воббе W o – показатель, также характеризующий тепловые свойства газа во взаимосвязи с его относительной плотностью. Определяется по формуле:
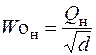 или
или 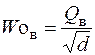
где Woн и Woв – число Воббе низшее и высшее, кДж/м3; Qн – низшая теплота сгорания газа, кДж/м3; Qв – высшая теплота сгорания газа, кДж/м3; d – относительная плотность газа.
Определение относительной плотности
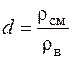
где rсм – плотность смеси сложного газа при нормальных физических условиях, кг/м3; rв =1,29, кг/м3 – плотность воздуха при нормальных физических условиях.
Равенство чисел Воббе 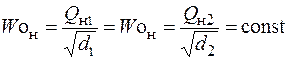 указывает на взаимозаменяемость газов, т. е. возможность их использования в одном горелочном устройстве без изменений конструкции последнего. Практически считается, что взаимозаменяемость газов без нарушения нормальной работы газогорелочных устройств возможна при колебаниях числа Воббе в пределах ±5% номинального значения и равенстве скоростей распространения пламени. ПГ и СУГ имеют скорость распространения пламени 0,36–0,37 м/сек. Скорости распространения пламени ИГ и БГ значительно отличаются от скорости сгорания ПГ и СУГ из-за присутствия в них значительного количества балластных газов и водорода.
указывает на взаимозаменяемость газов, т. е. возможность их использования в одном горелочном устройстве без изменений конструкции последнего. Практически считается, что взаимозаменяемость газов без нарушения нормальной работы газогорелочных устройств возможна при колебаниях числа Воббе в пределах ±5% номинального значения и равенстве скоростей распространения пламени. ПГ и СУГ имеют скорость распространения пламени 0,36–0,37 м/сек. Скорости распространения пламени ИГ и БГ значительно отличаются от скорости сгорания ПГ и СУГ из-за присутствия в них значительного количества балластных газов и водорода.
Температура воспламенения – это минимальная температура, при которой газовоздушная смесь воспламеняется. Для большинства горючих газов температурой воспламенения является температура открытого огня самого различного происхождения: пламени спички, зажженной сигареты, ударной или электрической искры. Например, температура воспламенения газовоздушной смеси метана 645, пропана 490, бутана 475 °С. Значения минимальных температур воспламенения газовоздушных смесей приведены в табл. 4.
Максимальная температура продуктов полного сгорания газов адиабатических условиях при температуре газа и воздуха равной 0 °С – tж (жаропроизводительность). Это максимальная температура, которую будут иметь продукты сгорания газа. Максимальная температура горения углеводородных газов достигается при осуществлении комплекса условий, обеспечивающих полноту их сгорания. К этим условиям относятся обеспечение стехиометрического состава газовоздушной смеси, поддержание стабильной температуры горения в течение экзотермической реакции окисления горючих компонентов газа кислородом воздуха.
Сложность практического создания указанных условий объясняет значительную разницу между теоретической максимальной температурой и температурой, действительно достигаемой при сжигании топлива. Так, теоретическая температура горения большинства углеводородных газов приблизительно одинакова и равна 2000 °С, а температура, создаваемая, например, в топочном пространстве паровых котлов, составляет 1200–1400 °С.
Пределы воспламеняемости. Диапазон необходимой концентрации газа в смеси с воздухом, при котором возможна реакция окисления (горения), начинающаяся с внесением открытого огня или другого источника высокой температуры, называют пределами воспламеняемости или пределами взрываемости. Минимальное процентное (по объему) содержание горючего газа в смеси с воздухом, при котором с введением источника огня начинается реакция горения горючих компонентов газа, называют нижним пределом воспламеняемости (взрываемости) Lн, а максимальное – верхним пределом воспламеняемости (взрываемости) Lв в % объемных. Значения пределов воспламеняемости отдельных горючих газов приведено в табл. 4. При содержании газа в газовоздушной смеси меньше нижнего предела воспламеняемости горения не будет. Если газа в газовоздушной смеси больше верхнего предела воспламеняемости, эта смесь может гореть, взрыва не будет. Воздуха в этой смеси не достаточно для сгорания газа, присутствующего в смеси, поэтому сгорит столько газа на сколько хватит воздуха.
Пределы воспламеняемости (взрываемости) сложных газов можно определить по формуле Ле Шателье:
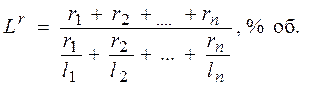
где 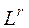 – нижний или верхний предел воспламенения сложного газа в газовоздушной или газокислородной смеси, % об.;
– нижний или верхний предел воспламенения сложного газа в газовоздушной или газокислородной смеси, % об.; 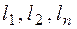 – нижние или верхние пределы воспламения отдельных компонентов сложного газа в газовоздушно смеси в % об. по данным табл. 2;
– нижние или верхние пределы воспламения отдельных компонентов сложного газа в газовоздушно смеси в % об. по данным табл. 2; 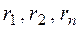 –содержание отдельных компонентов в сложном газе, % об.;
–содержание отдельных компонентов в сложном газе, % об.; 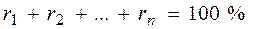 ;
;
При наличии в газе небольшого количества балластных примесей пределы воспламеняемости могут быть определены по формуле:
Нижний предел воспламеняемости с балластом:
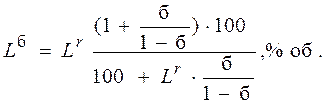
где 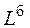 – нижний или верхний предел воспламенения смеси, содержащей инертные (балластные) примеси, % об.;
– нижний или верхний предел воспламенения смеси, содержащей инертные (балластные) примеси, % об.; 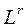 – нижний или верхний предел воспламенения горючей части смеси, % об.;
– нижний или верхний предел воспламенения горючей части смеси, % об.; 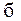 – содержание балластных примесей (СО2 и N2), в долях единицы.
– содержание балластных примесей (СО2 и N2), в долях единицы.
При содержании в газе балластных примесей для определения пределов воспламеняемости необходимо пересчитать процентное содержание горючей части. Например, в смеси присутствует 90 процентов горючих газов и 10 процентов не горючих, т. е. балласта. Принимаем 90% за 100% и определяем для каждого горючего компонента смеси его новое процентное количество. Определение нового процентного содержания горючих компонентов выполняют следующим расчетом:
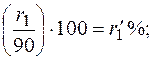
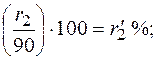
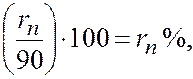
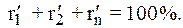
Время образования взрывоопасной смеси при утечке газа.
Если газовоздушная смесь с концентрацией в пределах воспламеняемости заполнила, какой либо замкнутый объем, то при появлении источника высокой температуры смесь воспламениться сразу во всем объеме. Сгорание газовоздушной смеси произойдет с большой скоростью, Произойдет взрыв всего объема газовоздушной смеси скопившейся в помещении, топке, котловане и др. Вся масса газовоздушной смеси превратиться в продукты сгорания, восприняв все тепло выделившееся при горении. Максимальная температура горения стехиометрической смеси природного газа с воздухом может достигать примерно 2000 °С . Нагретые газы расширяются, что сопровождается мгновенным повышением избыточного давления в замкнутом объеме. Давление продуктов сгорания повышается до тех пор, пока стены помещения, топки не перестанут выдерживать напор и не разрушаться. Тогда газы с силой выходят наружу. Образуется взрывная волна, которая распространяется во все стороны. может Скорость взрывной волны может достигнуть 600 м/сек. Если предусмотреть отверстие, через которое волна выйдет из топки или помещения, то разрушения основной конструкции не произойдет. В помещениях взрывная волна сбрасывается через оконные проемы, а в топках устанавливают сбросные клапаны. Максимальное давление возникает в подвале, где нет окон и сопротивление ограждающих конструкций большое. Максимальное давление при взрыве может достигнуть 0,8 МПа. Эффективная и надежно действующая вентиляция является одним из важных мероприятий предотвращающее образование взрывоопасной смеси. Вместо воздуха удаляемого из помещения, поступает свежий воздух, т. е. организуется воздухообмен. Наиболее опасными являются газы у которых нижний предел взрываемости наименьший и те, у которых наибольший диапазон между нижним и верхним пределами взрываемости.
Можно приблизительно определить время образования нижнего предела и верхнего предела взрываемости того или иного газа в помещении или в топке при утечке газа. Последовательность вычисления следующая:
1 – определение количества газа для данного объема помещения (топки) для образования нижнего предела взрываемости – V загазованности м3
Vзаг = Vпом × Lн,
где Vпом – объем помещения (топки), м³; Lн – нижний предел взрываемости, в долях;
2 – определить или задаться утечкой газа, т. е. количеством газа, поступающего в помещение (топку) – V утечки, м3/час;
3 – время образования опасной смеси – τ, час;
4 – время образования взрывоопасной смеси с учетом вентиляции помещения – τ¢, час,
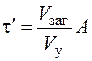 ,
,
где А – часовая кратность воздухообмена.
Если газовоздушная смесь с концентрацией газа в пределах воспламеняемости образовалась в горелочных устройствах, то при поджигании ее на выходе из горелки она будет гореть. На поверхности разгерметизированных газопроводов, газовых резервуаров при поднесении источника высокой температуры она будет гореть диффузионным пламенем. Газовоздушная смесь с концентрацией газа в пределах воспламеняемости, распространившаяся по всему замкнутому объему (помещение, подвал, котлован, топка и др.), при внесении открытого огня сгорает с большой скоростью передачи теплоты от одних частиц к другим и с практически мгновенным выходом энергии – происходит тепловой взрыв всей смеси. Например, мгновенное сгорание, т. е. взрыв, стехиометрической смеси метана с воздухом сопровождается мгновенным повышением избыточного давления в замкнутом объеме до значений, близких 0,8 МПа за счет резкого повышения температуры и увеличения объема продуктов сгорания. Максимальное давление может возникнуть только в том случае, если происходит полное сгорание газа в каком-то объеме и прочность ограждающих конструкций выдержит это давление. В помещении величина давления будет такая, какое давление выдержит легко разрушающаяся часть ограждающих конструкций, например – окна, двери.
Максимальное давление, возникающее при взрыве газовоздушных смесей может быть определено по следующей формуле
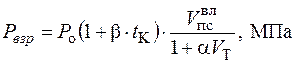
где Po – атмосферное давление, Ро = 0,1 МПа; tК – калориметрическая температура горения, °С, tК = 2000 °С; 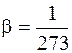 – коэффициент объемного расширения;
– коэффициент объемного расширения; 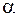 – коэффициент избытка воздуха, при котором происходит горение. При взрыве в помещении можно принять
– коэффициент избытка воздуха, при котором происходит горение. При взрыве в помещении можно принять 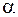 = 1.
= 1.
При взрыв смеси газа с воздухом на уровне нижнего предела воспламеняемости 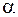 = 1,8 для метана,
= 1,8 для метана, 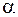 = 1, для пропана. В этом случае
= 1, для пропана. В этом случае
tК – калориметрическая температура горения понизится, °С, для метана tК = 1730°С; для пропана tК = 1340°С
Объем влажных продуктов сгорания на 1 м3 газа
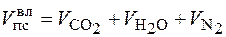 м3/м3
м3/м3
Горение газов в воздухе может быть записано в общем виде ниже представленного выражения:
CmHn + (m + 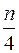 ) (O2 + 3,76N2) = mCO2 +
) (O2 + 3,76N2) = mCO2 + 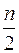 H2O + (m +
H2O + (m + 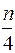 ) × 3,76 N2
) × 3,76 N2
Кислород необходимый для горения поступает с воздухом, являясь его составной частью. Воздух состоит из:
О2 » 21%;
N2 » 79%.
Для использования 1м3 О2 требуется 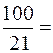 4,76 м3 воздуха.
4,76 м3 воздуха.
На 1м3 О2 приходится 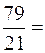 3,76 м3 N2.
3,76 м3 N2.
Определение теоретического расхода сухого воздуха необходимого для полного сгорания 1м3 газа.
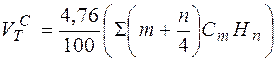 м³/м³
м³/м³
 = (2CH4 + 3,5C2H6 + 5C3H8 + 6,5C4H10 + 8C 5H12 + Н2 S ) м3/м3
= (2CH4 + 3,5C2H6 + 5C3H8 + 6,5C4H10 + 8C 5H12 + Н2 S ) м3/м3
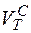 = (2×93+3,5×3,1+5×0,7+6,5×0,6) = 9,7 м3/м3
= (2×93+3,5×3,1+5×0,7+6,5×0,6) = 9,7 м3/м3
Определение теоретического расхода влажного воздуха необходимого для полного сгорания.
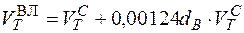 м3/м3
м3/м3
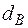 = 10гр – количество водяных паров в воздухе.
= 10гр – количество водяных паров в воздухе.
Опасные свойства горючих газов. Обладая высокими теплотой сгорания, температурой горения и незначительной температурой воспламенения, все углеводородные газы чрезвычайно опасны при разгерметизации газопроводов, газового оборудования и газовых резервуаров. При даже незначительных, на первый взгляд, утечках газа в плохо вентилируемых помещениях могут создаваться взрыво- и пожароопасные газовоздушные смеси.
Для определения утечек газу придают запах путем добавки остропахнущего вещества – этилмеркаптана C2H5SH. Такой процесс называется одоризацией газов. Запах одорированного газа должен ощущаться при содержании его в воздухе около 1/5 нижнего предела воспламенения.
Вследствие того что природные газы легче воздуха (плотность воздуха r = 1,293 кг/м3, а природного газа r = 0,73 кг/м3) при утечках они будут скапливаться в верхних частях помещений, затрудняя обнаружение. Пары сжиженных газов будут скапливаться в низких и непроветриваемых местах, так как их плотность больше плотности воздуха.
Природные газы не токсичны. Однако, человек, находящийся в атмосфере с небольшим содержанием горючего газа в воздухе, испытывает кислородное голодание, а при значительных концентрациях газа в воздухе может погибнуть от удушья. Так, содержание сжиженного газа в воздухе в количествах, снижающих концентрацию в нем кислорода от 21 до 15–16 % (по объему) может привести к удушью.
Сжиженные углеводородные газы, на организм человека оказывают наркотическое действие. Признаками наркотического действия вначале являются недомогание и головокружение, затем наступает состояние опьянения, сопровождаемое беспричинной веселостью, потерей сознания. Предельно допустимая концентрация в воздухе рабочей зоны предельных углеводородов 300, непредельных– 100 мг/м3 (в пересчете на углерод), в атмосфере населенных пунктов – пропана и бутана 200 мг/м3. Попадая на кожу человека, жидкая фаза пропан-бутанов в результате интенсивного испарения вызывает обмораживание. По характеру действия обмораживание напоминает ожог. Возможное присутствие в сжиженном газе сероводорода H2S иногда из-за химического соединения последнего с металлом внутренней полости газопроводов и газовых резервуаров создает опасность образования пирофорных отложений, способных самовоспламеняться на воздухе.
Несоблюдение температурного режима хранения, транспортирования и использования сжиженных газов создает опасность разрушения резервуаров-хранилищ и транспортных сосудов при избыточном давлении, поскольку при повышении температуры жидкой фазы ее объем резко увеличивается вследствие высокого коэффициента объемного расширения сжиженных газов. Так, например, коэффициент объемного расширения жидкого пропана в 16 раз больше, чем воды, а у бутана – в 11 раз. Поэтому при использовании сжиженных газов следует не допускать бесконтрольного нагрева стенок сосудов с газом. Необходимо тщательно следить за нормой заполнения сосудов жидкостью, оставляя резервные объемы. «Правилами безопасности в газовом хозяйстве» заполнение сжиженными газами емкостей регламентировано: не более чем 85 % геометрического объема для надземных резервуаров и баллонов.
Дата: 2019-02-02, просмотров: 489.