Занятие № 7
Методические указания для студентов
ТЕМА: Химия элементов d-блока. Лигандообменные процессы. Строение металлоферментов, биокомплексных соединений.
ЦЕЛЬ: Изучить положение d-элементов в периодической системе, их свойства и биологическое действие. На основе знаний координационной теории Вернера сформировать представление о ферментах как биокомплексных соединениях, их свойствах и роли в жизнедеятельности организма.
Теоретические вопросы:
1. Химия элементов d-блока. Электронные структуры атомов и катионов. Наиболее важные биогенные элементы d-блока.
2. Общая характеристика d- элементов. Изменение химической активности d-элементов вподгруппах в направлении сверху вниз. Степень окисления, закономерности изменения кислотно-основных и окислительно-восстановительных свойств d- элементов в зависимости от степени окисления. Роль d- элементов в организме. Характерные степени окисления для d-элементов, встречающихся в организме.
3. Классификация и номенклатура комплексных соединений. Координационная теория Вернера. Получение комплексных соединений. Природа химической связи в комплексных соединениях. Геометрическая форма комплексных соединений и гибридизация атомных орбиталей комплексообразователя (sp-, sp3-, sp3d2-, dsp2-). Поляризующая способность лигандов. Внутриорбитальные и внешнеорбитальные комплексы.
4. Представления о строении металлоферментов и других биокомплексных соединений: (гемоглобин, цианкобаламин, каталаза, цитохромы). Физико-химические принципы транспорта кислорода гемоглобином.
5. Метало-лигандный гомеостаз и причины его нарушения. Механизм токсического действия тяжёлых металлов и мышьяка. Термодинамические принципы хелатотерапии.
6. Общая характеристика d- элементов VI Б группы. Электронные формулы для хрома, молибдена, вольфрама и наиболее устойчивые их степени окисления. Характер соединений хрома в степени окисления +2, +3, +6. Биологическая роль Сг+3, Мо+6. Ксантиноксидаза и альдегидоксидаза - ферменты, содержащие Мо+6.
7. Общая характеристика элементов VII Б группы. Электронные формулы для марганца, технеция, рения. Наиболее устойчивые степени окисления для них. Изменение химической активности в ряду указанных элементов. Соединения марганца в степени окисления +2, +4, +6, +7. Окислительная активность перманганат- иона в зависимости от среды. Биологическая роль Мn+2 и соединения марганца, применяемые в медицине.
8. Элементы VIII группы. Семейство железа. Характерные степени окисления для железа, никеля, кобальта. Свойства соединений железа со степенью окисления +2, +3, +6. Характерные комплексные соединения для Fe+2, Fe+3. Биологическая роль Fe+2, Fe+3 и Co+3. Препараты железа, используемые в медицине. Механизм цитотоксического действия соединений платины.
9. Общая характеристика d-элементов1 Б группы. Электронные формулы и степени окисления для меди, серебра и золота. Координационные числа, тип гибридизации атомных орбиталей, структура соединений. Биологическая роль Сu+2. Оксигеназы и гидроксилазы. Церуллоплазмин. Их роль в биохимических процессах.
10. Общая характеристика d-элементов II Б группы. Электронные формулы для цинка, кадмия и ртути. Характерные степени окисления. Изменение кислотно-основных свойств от цинка к ртути. Строение комплексных соединений. Гидроксиды данных элементов и их свойства. Биологическая роль Zn+2. Карбоангидраза, строение активного центра металлофермента, биологическая роль. Карбоксипепсидаза. Механизм участия карбоксипепсидазы в реакциях гидролиза пептидных связей. Токсическое действие на организм Hg+2, Cd+2. Соединения цинка и ртути, применяемые в медицине.
Ответ
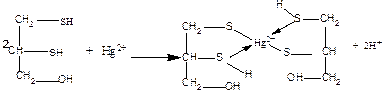
Задача 6. Сколько изомеров существует у иона [Co(H2N-CH2-CH2-NH2)2Cl2]+ ? Ответ обоснуйте и проиллюстрируйте.
Ответ: Существует 2 изомера транс (а)- и цис- изомер (б).
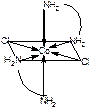
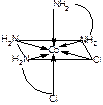
а- транс-изомер б –цис-изомер
Упражнения для самостоятельной работы
1. Определите степень окисления комплексообразователя, назовите комплексное соединение и выразите константу нестойкости:
K3[Fe(CN)6] [Co(H2O)6]Cl3 K4[Fe(CN)6] KFe[Fe(CN)6]
2. Отразите химизм взаимодействия унитиола (2,3-димеркаптопропансульфоната натрия) с солями Hg+2.
3. Из предложенных ниже молекул и ионов составьте комплексные соединения анионного, катионного и нейтрального типа (Pt+2, NН3, К+, С1-, Сu+2).
Назовите их.
4. В аналитической и медицинской практике используется ЭДТА (этилендиаминтетрауксусная кислота) и его соль Na2H2Т (трилон Б) С какими катионами: Со3+ (kн=2,51×10-41), Мg2+ (kн=7,59×10-10), Fe2+ (kн=6,31×10-15), Fe3+ (kн=5,89×10-25) он образует менее прочное комплексное соединение? Расположите комплексы по убыванию их прочности.
5. Укажите, в состав каких ферментов входит кобальт:
1) карбоангидразы; 2) витамина В12 3) цитохромов
4) супероксиддисмутазы; 5) ксантиноксидазы
6. При отравлениях ляписом (нитрат серебра) желудок промывают 2%-ным раствором хлорида натрия. Рассчитайте массу AgCl, которая получится при взаимодействии 0,1 г нитрата серебра с избытком хлорида натрия.
Ответ: m(AgCl)=0,084г
7.Сульфат цинка ZnSO4 применяется в виде 0,25% раствора, как глазные капли. Сколько нужно добавить воды к 25г раствора ZnSO4 c массовой долей 2%, чтобы приготовить глазные капли?
Ответ: 175 г воды.
8. Массовая доля цинка, входящего в состав яда кобры (ценное лекарство!), равно 0,5%. Сколько атомов цинка потребуется кобре для производства 1 капли (30мг) яда?
Ответ: N (Zn)=1,38×1018 атомов
Тестовые вопросы
1). Медь содержащий белок плазмы крови человека называется:
1) гемоглобин 2) цитохром 3) альбумин 4) церрулоплазмин
2) Какой микроэлемент входит в состав фермента ксантиноксидазы:
1) железо 2) серебро 3) кобальт 4) молибден
3) Какой металл входит в состав гемоглобина:
1) медь (II) 2) железо (II) 3) кобальт (III) 4) железо (III)
4) Какое эндемическое заболевание возникает при избытке Мо6+ в воде и почве?
1) кариес 2) подагра 3) эндемический зоб 4) анемия
Зав. кафедрой общей и
Занятие № 7
Методические указания для студентов
ТЕМА: Химия элементов d-блока. Лигандообменные процессы. Строение металлоферментов, биокомплексных соединений.
ЦЕЛЬ: Изучить положение d-элементов в периодической системе, их свойства и биологическое действие. На основе знаний координационной теории Вернера сформировать представление о ферментах как биокомплексных соединениях, их свойствах и роли в жизнедеятельности организма.
Теоретические вопросы:
1. Химия элементов d-блока. Электронные структуры атомов и катионов. Наиболее важные биогенные элементы d-блока.
2. Общая характеристика d- элементов. Изменение химической активности d-элементов вподгруппах в направлении сверху вниз. Степень окисления, закономерности изменения кислотно-основных и окислительно-восстановительных свойств d- элементов в зависимости от степени окисления. Роль d- элементов в организме. Характерные степени окисления для d-элементов, встречающихся в организме.
3. Классификация и номенклатура комплексных соединений. Координационная теория Вернера. Получение комплексных соединений. Природа химической связи в комплексных соединениях. Геометрическая форма комплексных соединений и гибридизация атомных орбиталей комплексообразователя (sp-, sp3-, sp3d2-, dsp2-). Поляризующая способность лигандов. Внутриорбитальные и внешнеорбитальные комплексы.
4. Представления о строении металлоферментов и других биокомплексных соединений: (гемоглобин, цианкобаламин, каталаза, цитохромы). Физико-химические принципы транспорта кислорода гемоглобином.
5. Метало-лигандный гомеостаз и причины его нарушения. Механизм токсического действия тяжёлых металлов и мышьяка. Термодинамические принципы хелатотерапии.
6. Общая характеристика d- элементов VI Б группы. Электронные формулы для хрома, молибдена, вольфрама и наиболее устойчивые их степени окисления. Характер соединений хрома в степени окисления +2, +3, +6. Биологическая роль Сг+3, Мо+6. Ксантиноксидаза и альдегидоксидаза - ферменты, содержащие Мо+6.
7. Общая характеристика элементов VII Б группы. Электронные формулы для марганца, технеция, рения. Наиболее устойчивые степени окисления для них. Изменение химической активности в ряду указанных элементов. Соединения марганца в степени окисления +2, +4, +6, +7. Окислительная активность перманганат- иона в зависимости от среды. Биологическая роль Мn+2 и соединения марганца, применяемые в медицине.
8. Элементы VIII группы. Семейство железа. Характерные степени окисления для железа, никеля, кобальта. Свойства соединений железа со степенью окисления +2, +3, +6. Характерные комплексные соединения для Fe+2, Fe+3. Биологическая роль Fe+2, Fe+3 и Co+3. Препараты железа, используемые в медицине. Механизм цитотоксического действия соединений платины.
9. Общая характеристика d-элементов1 Б группы. Электронные формулы и степени окисления для меди, серебра и золота. Координационные числа, тип гибридизации атомных орбиталей, структура соединений. Биологическая роль Сu+2. Оксигеназы и гидроксилазы. Церуллоплазмин. Их роль в биохимических процессах.
10. Общая характеристика d-элементов II Б группы. Электронные формулы для цинка, кадмия и ртути. Характерные степени окисления. Изменение кислотно-основных свойств от цинка к ртути. Строение комплексных соединений. Гидроксиды данных элементов и их свойства. Биологическая роль Zn+2. Карбоангидраза, строение активного центра металлофермента, биологическая роль. Карбоксипепсидаза. Механизм участия карбоксипепсидазы в реакциях гидролиза пептидных связей. Токсическое действие на организм Hg+2, Cd+2. Соединения цинка и ртути, применяемые в медицине.
Обучающие задачи и упражнения
Задача 1. Определите степень окисления комплексообразователя в комплексном соединении [Cо(NH3)5Br]SO4
Решение: Внешняя сфера SO4 2-, имеет заряд -2, значит внутренняя сфера [Cо(NH3)5Br] имеет заряд +2. [Cо(NH3)5Br]2+
Поскольку заряд внутренней сферы определяется как алгебраическая сумма заряда комплексообразователя и лигандов, можно определить степень окисления комплексообразователя, т.е. кобальта. Зная, что заряд NH3 равен 0, а для Br-1, степень окисления Со будет равна +3.
Ответ: +3
Задача 2. Определите заряд комплексного иона и тип гибридизации атомных орбиталей комплексообразователя в данном соединении: [Cu+2(H2O)4]x
Решение: Заряд лиганда Н2О равен 0, тогда заряд комплексного иона равен 2+ [Cu+2(H2O)4]2+
Координационное число равно 4, что определяет гибридизацию атомных орбиталей по типу sp3 .
Ответ: 2+, sp3 - гибридизация.
Задача 3. Запишите константу нестойкости для следующего соединения: Na2[Zn(OH)4]
Решение: В водном растворе соединение полностью диссоциирует на внешнюю и внутреннюю сферу: Na2[Zn(OH)4] ® 2Na+ + [Zn(OH)4]2-
Данный процесс называется первичной диссоциацией. Внутренняя среда диссоциирует слабо, этот процесс является обратимыми и он характеризуется константой равновесия, называемой константой нестойкости
[Zn(OH)4]2- « Zn+2 + 4OH-
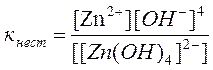
[Zn+2]∙ [OH-]4
К нест. = ¾¾¾¾¾¾¾
[[Zn(OH)4]2-]
Задача 4. Существует два изомера состава CrCl 2 ( NO 2 )( NH 3 )4. Один из них дает осадок с раствором нитрата серебра, другой не образует осадка. Чем можно объяснить это различие в поведении двух изомеров?
Ответ:
1. [Cr(NH3)4 Cl2]NO2 + AgNO3 ¾® [Cr(NH3)Cl(NO2)]NO3 + AgNO2 осадка нет
2. [Cr(NH3)Cl(NO2)]Cl + AgNO3 ¾¾¾® [Cr(NH3)Cl(NO2)]NO3 + AgCl¯
выпадает осадок, т.к. в комплексном соединении хлорид-ион находится во внешней сфере.
Задача 5. Британский антилюизит (БАЛ) используется как антидот при отравлении солями ртути. Запишите уравнение взаимодействия солей ртути с БАЛ в качестве лечебного средства.
Ответ
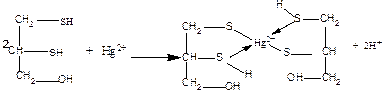
Задача 6. Сколько изомеров существует у иона [Co(H2N-CH2-CH2-NH2)2Cl2]+ ? Ответ обоснуйте и проиллюстрируйте.
Ответ: Существует 2 изомера транс (а)- и цис- изомер (б).
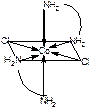
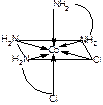
а- транс-изомер б –цис-изомер
Упражнения для самостоятельной работы
1. Определите степень окисления комплексообразователя, назовите комплексное соединение и выразите константу нестойкости:
K3[Fe(CN)6] [Co(H2O)6]Cl3 K4[Fe(CN)6] KFe[Fe(CN)6]
2. Отразите химизм взаимодействия унитиола (2,3-димеркаптопропансульфоната натрия) с солями Hg+2.
3. Из предложенных ниже молекул и ионов составьте комплексные соединения анионного, катионного и нейтрального типа (Pt+2, NН3, К+, С1-, Сu+2).
Назовите их.
4. В аналитической и медицинской практике используется ЭДТА (этилендиаминтетрауксусная кислота) и его соль Na2H2Т (трилон Б) С какими катионами: Со3+ (kн=2,51×10-41), Мg2+ (kн=7,59×10-10), Fe2+ (kн=6,31×10-15), Fe3+ (kн=5,89×10-25) он образует менее прочное комплексное соединение? Расположите комплексы по убыванию их прочности.
5. Укажите, в состав каких ферментов входит кобальт:
1) карбоангидразы; 2) витамина В12 3) цитохромов
4) супероксиддисмутазы; 5) ксантиноксидазы
6. При отравлениях ляписом (нитрат серебра) желудок промывают 2%-ным раствором хлорида натрия. Рассчитайте массу AgCl, которая получится при взаимодействии 0,1 г нитрата серебра с избытком хлорида натрия.
Ответ: m(AgCl)=0,084г
7.Сульфат цинка ZnSO4 применяется в виде 0,25% раствора, как глазные капли. Сколько нужно добавить воды к 25г раствора ZnSO4 c массовой долей 2%, чтобы приготовить глазные капли?
Ответ: 175 г воды.
8. Массовая доля цинка, входящего в состав яда кобры (ценное лекарство!), равно 0,5%. Сколько атомов цинка потребуется кобре для производства 1 капли (30мг) яда?
Ответ: N (Zn)=1,38×1018 атомов
Тестовые вопросы
1). Медь содержащий белок плазмы крови человека называется:
1) гемоглобин 2) цитохром 3) альбумин 4) церрулоплазмин
2) Какой микроэлемент входит в состав фермента ксантиноксидазы:
1) железо 2) серебро 3) кобальт 4) молибден
3) Какой металл входит в состав гемоглобина:
1) медь (II) 2) железо (II) 3) кобальт (III) 4) железо (III)
4) Какое эндемическое заболевание возникает при избытке Мо6+ в воде и почве?
1) кариес 2) подагра 3) эндемический зоб 4) анемия
Дата: 2018-12-28, просмотров: 398.