а) 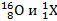 ; б)
; б) 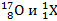 ;
;
в) 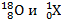 ; г)
; г) 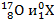 .
.
8**.Корпускулярно-волновой дуализм микрочастиц описывает уравнение Луи де Бройля (1924):
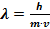 .
.
Для физических величин, входящих в это уравнение, соотнесите:
Обозначение величины:
1) 𝛌; 2) 𝘩; 3) 𝑚; 4) 𝑣;
Название величины:
а) постоянная Планка; б) скорость микрочастицы;
в) масса микрочастицы; г) длина волны.
9**. По уравнению Луи де Бройля рассчитайте длину волны нейтрона, имеющего массу 1,67 ∙ 10-27 кг, движущегося со скоростью 2,5 ∙ 105 м/с ( 𝘩 = 6,626 ∙ 10-34 Дж ∙ с):
а) 1,626 ∙ 10-12 м; б) 0,1587 ∙ 10-13м;
в) 1,587 ∙ 10-2м; г) 1,587 ∙ 10-12 м.
Работа 2 . Б. Состояние электрона в атоме.
Вариант 1.
1. Тип орбитали, имеющий форму объемной восьмерки:
а) s; б) р; в) d; г) f.
Какой набор орбиталей соответствует второму энергетическому уровню?
а) Одна s и одна р; б) две s и две р;
в) одна s и три р; г) три s одна р.
3. Число энергетических уровней атома равно:
а) номеру группы, в которой расположен элемент;
б) заряду атомного ядра;
в) номеру периода, в котором расположен элемент;
г) числу электронов в атоме.
Сколько подуровней имеет третий энергетический уровень?
а) два; б) три; в) четыре; г) пять.
5.Число орбиталей на энергетическом уровне (n) можно рас читать по формуле:
а) 2n2; б) 2n; в) 4n2; г) n2.
Сколько энергетических уровней имеет атом натрия?
а) Один; б) два; в) три; г) четыре.
7. Укажите главное квантовое число, соответствующее энергетическому уровню, на котором могут располагаться только два электрона:
а) 1; б) 2; в) 3; г)4.
Работа 2 . Б. Состояние электрона в атоме.
Вариант 2
1. Тип орбитали, имеющий форму шара:
а) s; б) р; в) d; г) f.
2. Главное квантовое число n обозначает:
а) порядковый номер элемента;
б) число электронов в атоме;
в) номер энергетического уровня;
г) заряд ядра атома.
Сколько подуровней имеет второй энергетический уровень?
а) Два; б) три; в) четыре; г) пять.
4. Максимальное число электронов, которые могут находиться на энергетическом уровне n, можно рассчитать по формуле:
а) 2n2; б) 2n; в) 4n2; г) n2.
Сколько орбиталей и какого типа соответствует третьему энергетическому уровню атома?
а) Одна s и три р; б) одна s, три р и пять d;
в) одна s, две р и три d; г) одна s , три р и семь d.
6. Сколько энергетических уровней у атома хлора?
а) Один; б) два; в) три; г) семь.
7. Укажите главное квантовое число энергетического уровня, на котором электрон имеет минимальную энергию:
а) 1; б) 2; в) 3; г)4.
Работа 2 . Б. Состояние электрона в атоме.
Вариант 3
Сколько орбиталей составляет d-подуровень?
а) одну; б) три; в) пять; г) семь.
2.* Укажите главное квантовое число, соответствующее энергетическому уровню L :
а) 1; б) 2; в) 3; г) 4.
3. Пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона, называется:
а) подуровнем; б) энергетическим уровнем;
в) орбиталью; г) слоем.
Сколько энергетических уровней имеет элемент с порядковым номером 35?
а) один; б) два; в) три; г) четыре.
Дата: 2018-12-28, просмотров: 591.