Коксовый газ получают при производстве кокса, а доменный газ – при производстве чугуна. Коксовый газ содержит много углеводородов и используется для получения углеводородов и водорода. Доменный газ содержит много пыли. Оба газа являются ядовитыми и взрывоопасными.
В компрессорах сжимаются также такие газы, как пропилен, пирогаз и.т.д.
Природный газ.
Природные газы чисто газовых месторождений по сравнению с газами, сопутствующими нефти, содержат, как правило, меньше тяжёлых углеводородов. Основными компонентами природного газа являются метан (42 ÷ 98% по объему), этан, пропан, бубан, а также примеси более тяжёлых углеводородов иарафинового газа. Воспламеняется при содержании в воздухе в пределах (4,5 ÷ 17)%, t воспламенения = 610°С.
Коксовый газ.
| Водород Н2 | 50% по объему |
| Метан CH4 | 25% |
| Окись углерода СО | 7,0% |
| Азот N2 | 10% |
Доменный газ.
| Углекислота СО2 | 8% по объему. |
| Окись углерода СО | 28% |
| Водород Н2 | 4% |
| Азот N2 | 60% |
Основы термодинамики сжатия.
Уравнение состояния.
Физические величины, определяющие в совокупности состояние газа, называются координатами или ρ параметрами состояния. За такие величины принимают γ [км/м3], U[м3/кг], Р[МПа] и Т0/К.
Параметры идеального газа связаны уравнением состояния:
 (1).
(1).
Где: R (Dж/кг. К) – газовая постоянная. (R =848/ М, где М – молекулярный вес газа).
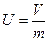 - удельный объём газа; [м3 / кг].
- удельный объём газа; [м3 / кг].
P (МПа) – давление.
Т – абсолютная температура, К.
Умножив обе части уравнения (1) на m получим:
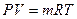 (2).
(2).
С точки зрения молекулярно – кинетической теории идеальный газ представляет собой совокупность молекул, совершающих хаотическое движение. Силы взаимного притяжения между молекулами отсутствуют, а объём самих молекул мал в сравнении с объёмом, занимаемым газом.
В природе идеальных газов нет, а все реальные газы дают отклонения от уравнения состояния идеального газа. Однако большинство газов (азот, водород, кислород и т. д.) при давлениях не выше 100 ата и положительных температурах дают незначительные отклонения от уравнения состояния и
для технических расчетов можно этим уравнением пользоваться.
Уравнение процесса.
В процессе изменения состояния газа изменяются его параметры. Закон изменения параметров выражается уравнением процесса, которое для идеальных газов будет
PVn = const, (3)
где P,V – давление и объем данного количества массы газа.
N – показатель политропы, величина которого характеризует процесс
изменения состояния газа. Это уравнение так же для идеального газа, но им можно пользоваться в тех же пределах для реального, что и для уравнения состояния.
Если n = 1 – изотермический процесс.
к>n>1 – политропический с частичным отводом тепла.
n = к – адиабатический процесс.
n>к – политропический процесс с подводом тепла.
Процессы в диаграмме PV.

Дата: 2018-12-21, просмотров: 632.