Наука о веществе основывается на современных знаниях об атомах – мельчайших частицах элементов и молекулах – мельчайших частицах химических соединений. Атомы имеют размер порядка 10~8см (одного ангстрема). Крупные молекулы, содержащие тысячи атомов, имеют размер около 10~6см. Характер движения молекул и атомов, их взаимодействие определяют, в каком агрегатном состоянии находится вещество – в твердом, жидком или газообразном.
Молекулы могут совершать поступательное, вращательное и колебательное движение. Если вещество находится в газообразном или жидком состоянии, то возможны все три вида этих движений. Если же вещество затвердевает, преобладающей формой движения молекул и атомов становятся колебания.
При изучении состояния вещества стремятся найти взаимосвязь между давлением, при котором находится вещество, его плотностью и температурой. Если обозначить давление p, плотность ρ, а обратную ей величину – удельный объем вещества V и температуру Т, то состояние вещества будет характеризоваться соотношением р, V и Т или, как принято в термодинамике, 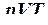 -соотношением. Наиболее просто это соотношение выглядит для состояния вещества, при котором молекулы совершают поступательное движение в период между столкновениями друг с другом, а межмолекулярные силы заметно не проявляются. Такое состояние вещества характерно для достаточно разреженных газов. Вещество, находящееся в этом состоянии, называют идеальным газом. Для идеальных газов согласно уравнению Клапейрона – Менделеева
-соотношением. Наиболее просто это соотношение выглядит для состояния вещества, при котором молекулы совершают поступательное движение в период между столкновениями друг с другом, а межмолекулярные силы заметно не проявляются. Такое состояние вещества характерно для достаточно разреженных газов. Вещество, находящееся в этом состоянии, называют идеальным газом. Для идеальных газов согласно уравнению Клапейрона – Менделеева
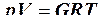 , (2.27)
, (2.27)
 где – давление, Па;
где – давление, Па;  – объем газа, м3,
– объем газа, м3,  – масса газа, кг;
– масса газа, кг;  – газовая постоянная, Дж/(кг • К);
– газовая постоянная, Дж/(кг • К);  – абсолютная температура, К.
– абсолютная температура, К.
Газовая постоянная численно равна работе расширения 1 кг идеального газа в изобарическом процессе при увеличении температуры газа на 1 К.
При высоком сжатии газа его параметры уже не будут описываться уравнением состояния идеального газа. Ван-дер-Ваальсом были введены в уравнение состояния идеального газа (2.27) поправки: величина b, учитывающая объем самих молекул, и величина a/v2, учитывающая взаимодействие между молекулами. В результате было получено уравнение состояния «реального газа» (уравнение Ван-дер-Ваальса) в следующем виде:
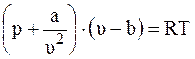 . (2.28)
. (2.28)
Сложность применения уравнения (2.28) для практических расчетов заключается в том, что в газонефтепромысловом деле встречаются, как правило, смеси газов, для которых уравнение Ван-дер-Ваальса применимо с трудом.
Хорошее согласование с экспериментальными данными для газов, плотность которых не превышает двух третей от плотности газа при критических условиях, получают по уравнению Битти-Бриджмена
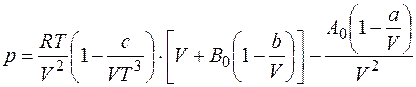 , (2.29)
, (2.29)
где а, Ь, с, Ао и Во — постоянные для данных компонентов природного газа, которые вычисляются на основании экспериментальных данных.
Коэффициент сверхсжимаемости. При большом числе компонентов расчеты по приведенным формулам становятся трудоемкими. Поэтому для расчета состояния реальных газов обычно пользуются обобщенным газовым законом в виде уравнения Клапейрона, в которое вводится поправка (коэффициент сверхсжимаемости), учитывающая отклонение реальных газов от законов сжатия и расширения идеальных газов.
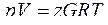 , (2.30)
, (2.30)
где z – коэффициент сверхсжимаемости; 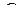 – масса газа в кг; р – давление в Па; V –объем газа в м3; R – газовая постоянная в Дж/(кг*град); Т — абсолютная температура в К.
– масса газа в кг; р – давление в Па; V –объем газа в м3; R – газовая постоянная в Дж/(кг*град); Т — абсолютная температура в К.
Характер изменения коэффициента сверхсжимаемости z, который показывает отношение объема реального газа к объему идеального при одних и тех же условиях, с изменением температуры и давления можно установить, учитывая отличия реальных газов от идеальных. В последних молекулы занимают незначительный объем (по сравнению с объемом газа) и не испытывают сил притяжения друг к другу. Молекулы же реальных газов обладают определенными размерами, массой и взаимодействуют друг с другом. Поэтому реальный газ приближается к идеальным при низких давлениях, когда число молекул в единице объема невелико. Следовательно, при низких давлениях величина коэффициента сжимаемости должна быть близка к единице. С повышением давления молекулы газа сближаются и силы притяжения между молекулами начинают помогать внешним силам, сжимающим газ. Вследствие этого реальные газы должны сжиматься сильнее, чем при тех же условиях сжимаются идеальные газы. Следовательно, с ростом давления коэффициент сжимаемости z должен вначале уменьшаться. Когда углеводородный газ сжат до такой степени, что он приближается по свойствам к жидкостям, межмолекулярные расстояния уменьшаются настолько, что начинают проявляться взаимоотталкивающие силы между молекулами, препятствующие дальнейшему уменьшению объема газа. В этих условиях углеводородный газ должен сжиматься меньше, чем при малых давлениях, т. е. значения z вновь возрастают при увеличении давления.
С приближением давления и температуры к их критическим значениям свойства газовой и жидких фаз становятся одинаковыми, поверхность раздела между ними исчезает и плотности их уравниваются.
Критическая температура (Ткр) – максимальная температура, при которой газ и жидкость могут ещё сосуществовать в равновесии (табл. 2.4).
Критическое давление – давление паров вещества при критической температуре (табл. 2.3), а объём вещества при данных Ткр и pкр, отнесённый к 1 молю или к единице массы вещества, называется критическим удельным объёмом.
Упругость насыщенных паров углеводородов, это давление, при котором газ начинает конденсироваться и переходить в жидкое состояние, повышается с ростом температуры и она тем выше, чем ниже плотность углеводорода.
Таблица 2.4 Критические давления и температуры компонентов нефтяных газов
| № п./п. | Компонент | Относит. моляр. масса | РКРi, МПа | ТКРi, К |
| 1 | Метан, СН4 | 16,04 | 4,63 | 190,55 |
| 2 | Этан, С2Н6 | 30,07 | 4,87 | 305,45 |
| 3 | Пропан, С3Н8 | 44,09 | 4,26 | 369,82 |
| 4 | изо-Бутан, i-С4Н10 | 58,12 | 3,65 | 408,13 |
| 5 | н-Бутан, n-С4Н10 | 58,12 | 3,797 | 425,16 |
| 6 | изо-Пентан, i-С5Н12 | 72,15 | 3,381 | 460,4 |
| 7 | н-Пентан, n-С5Н12 | 72,15 | 3,369 | 469,6 |
| 8 | н-Гексан, С6Н14 | 86,17 | 3,031 | 507,4 |
| 9 | н-Гептан, С7Н16 | 100,20 | 2,736 | 640,61 |
| 10 | Азот, N2 | 28,02 | 3,399 | 126,25 |
| 11 | Двуокись углерода, СО2 | 44,01 | 7,387 | 304,15 |
| 12 | Сероводород, Н2S | 34,08 | 9,01 | 373,55 |
Приведенные параметры газов. Коэффициент сжимаемости газов z, обычно определяют по экспериментальным графикам. Чтобы избежать построения графиков для каждого газа или их смесей, на основе экспериментальных данных составлен график изменения коэффициента z в зависимости от приведенной температуры и приведенного давления для метана (рис.2.2), который на основании закона соответственных состояний с достаточной точностью может быть использован для определения z, всех газов, состоящих на 95—96% из метана. Коэффициенты сжимаемости на этом графике поставлены в зависимость от приведенного давления p пр и приведенной температуры Tпр, которые определяются по формулам
 |  |
, (2.31)
где р и Т — давление и температура газа; рКрi и Tкрi — критические давление и абсолютная температура i-го компонента; 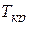 =
= 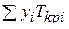 и
и 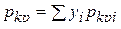 – среднекритические (псевдокритические) абсолютная температура и давление; уi — мольная концентрация i-го компонента в газе.
– среднекритические (псевдокритические) абсолютная температура и давление; уi — мольная концентрация i-го компонента в газе.
Таким образом, рпр и Tпр выражают давление и абсолютную температуру в долях от соответствующих критических величин.
Дата: 2018-12-21, просмотров: 620.