Контрольная работА
Учебная дисциплина Естествознание
Раздел 2. Химия с элементами экологии
Раздел 3. Биология с элементами экологии
по специальностям 071801 Социально – культурная деятельность (по видам)
071501 Народное художественное творчество (по видам)
Омск 2014 г.
Составитель: преподаватель Ижойкина Л.В.
Одобрена методическим объединением педагогических работников
общеобразовательных, общегуманитарных и общепрофессиональных дисциплин
БОУСПО «Омский областной колледж культуры и искусства»
Протокол № ___ « ____» _____________ 201 года
Руководитель МО ______________ ( ___________ )
Рассмотрена на заседании методического совета БОУСПО
«Омский областной колледж культуры и искусства»
Протокол № ___ « ____» _____________ 201 года
Председатель методического совета ______________ ( ___________ )
ВВЕДЕНИЕ
Цель изучения учебной дисциплины:
- освоение знаний о современной естественнонаучной картине мира и методах естественных наук; знакомство с наиболее важными идеями и достижениями естествознания, оказавшими определяющее влияние на развитие техники и технологий;
- овладение умениями применять полученные знания для объяснения явлений окружающего мира, восприятия информации естественнонаучного и специального (профессионально значимого) содержания, получаемой из СМИ, ресурсов Интернета, специальной и научно-популярной литературы;
- развитие интеллектуальных, творческих способностей и критического мышления в ходе проведения простейших исследований, анализа явлений, восприятия и интерпретации естественнонаучной информации;
- воспитание убежденности в возможности познания законов природы и использования достижений естественных наук для развития цивилизации и повышения качества жизни;
- применение естественнонаучных знаний в профессиональной деятельности и повседневной жизни для обеспечения безопасности жизнедеятельности; грамотного использования современных технологий; охраны здоровья, окружающей среды.
В результате освоения дисциплины обучающийся должен уметь:
- ориентироваться в современных научных понятиях и информации естественнонаучного содержания;
- работать с естественнонаучной информацией: владеть методами поиска, выделять смысловую основу и оценивать достоверность информации;
- использовать естественнонаучные знания в повседневной жизни для обеспечения безопасности жизнедеятельности, охраны здоровья, энергосбережения.
В результате освоения дисциплины обучающийся должен знать:
- основные науки о природе, их общность и отличия;
- естественнонаучный метод познания и его составляющие, единство законов природы во Вселенной;
- взаимосвязь между научными открытиями и развитием техники и технологий;
- вклад великих ученых в формировании современной естественнонаучной картины мира.
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
2.1 Требования к оформлению работы
Работа выполняется печатным способом с использованием компьютера и принтера на одной стороне листа формата А4 через полтора (1,5) интервала. Тип шрифта (гарнитура) - Times New Roman, кегль (размер) шрифта - 14. В работе не допускается использование шрифта разных гарнитур.
Абзацы в тексте следует начинать с отступа, равного 12,5 мм.
Названия разделов и подразделов выделяются жирным шрифтом. Название раздела располагается посередине строки, а подраздела – от абзаца. Выравнивание по ширине.
Объем контрольной работы строго не регламентирован, но не должен превышать 10 печатных страниц. Таблицы и графики оформляются или в тексте, или в приложении.
2.2. Методические рекомендации к выполнению контрольной работы
1. Работу выполняйте в соответствии с техническими требованиями.
2. Отвечайте на вопросы конкретно, логично, по теме, с выводами и обобщением.
3. В конце контрольной работы укажите используемую литературу.
4. Содержание контрольной работы должно строго соответствовать тематике выданной преподавателем!!!
ВАРИАНТЫ КОНТРОЛЬНОЙ РАБОТЫ
ВАРИАНТ 1.
Тема 1. Вода, растворы
Задание 1. С какими из перечисленных веществ вода вступает во взаимодействие: СО2, SO2, CаО, SiO2, Cl2, Fe, F2.
Задание 2. Почему не получают ожога, если кратковременно касаются горячего утюга мокрым пальцем? Обоснуйте ответ.
ВАРИАНТ 2.
Тема 1. Вода, растворы
Задание 1. Напишите уравнения реакций при помощи которых можно осуществить следующие превращения
 MgO Mg(OH)2
MgO Mg(OH)2

 Н2 Н2О LiOH
Н2 Н2О LiOH
O2
Задание 2. Перечислите важнейшие физические свойства воды.
Задание 3. Охарактеризуйте причины загрязнения гидросферы.
Задание 4.
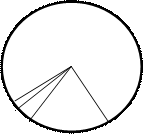
Отметьте на диаграмме химический состав атмосферы
 |
Задание 5. Заполните таблицу
Химический состав воздуха
| Элемент | Кем и когда открыт | Химические свойства | Значение |
ПРИЛОЖЕНИЕ 1
ТЕКСТ 1
Состав атмосферы:
N2 – 78%,
O2 – 21%,
Ar и др. инертные газы– 0,9%,
CO2 – 0,03%
 Шееле Шееле
|  Пристли Пристли
|  Лавуазье Лавуазье
|
Кислород.
Кислород был открыт почти одновременно и независимо друг от друга в 70-х годах XVIII века тремя исследователями: Д.Пристли, получившим его нагреванием оксида ртути с помощью солнечных лучей (1770), К.Шееле, разложившим нитрат магния, селитру и другие вещества (1772), и А.Лавуазье (1774 – 1775), который и дал название этому элементу. Название «кислород» - рождающий кислоту – отражает ошибочную точку зрения А.Лавуазье, считавшего этот газ «кислотообразующим началом». Это название было принято Парижской Академией наук в 1797г
Строение молекулы кислорода условно можно представить так: O = O. Энергия, требуемая для разрыва молекулы на атомы, велика и составляет 491,4кДж/моль. Молекулы кислорода при температуре около 200С ведут себя как сравнительно малоактивные частицы, поэтому кислород при невысоких температурах имеет шансы сохраниться в течение длительных промежутков времени, вот почему встречается в виде простого вещества в составе воздуха.
Кислород в обычных условиях – бесцветный газ. Увидеть кислород воочию можно, лишь охладив его до -182,90С. При этой температуре он представляет собой жидкость светло-голубого цвета, которую в теплоизолированных сосудах можно доставить туда, где в данный момент особенно нужен. Если кислород охладить до -218,70С, то жидкий кислород превратиться в красивые синие кристаллы. В воде кислород растворяется плохо (на 100 объёмов воды при 00С – 5 объемов кислорода), но хорошо растворяется в органических растворителях.
Кислород – типичный окислитель. В кислороде горят разные металлы, неметаллы и сложные вещества. Имеются соединения кислорода со всеми элементами таблицы Менделеева, кроме гелия, неона и аргона.
В атмосфере Земли кислорода около 21%, и для горения этого достаточно. А если бы воздух земной атмосферы содержал кислорода меньше 18%, то горение в нем углерода стало бы невозможным, «естественный» (например, от удара молнии) огонь никогда бы не появился. И первобытный человек так и не узнал бы, что огонь можно использовать для своих нужд. Еще хуже, если содержание кислорода в атмосфере было бы больше 30%. В такой газовой среде первый же удар молнии вызвал бы катастрофу – гигантский пожар, а может быть, и взрыв.
Ведь в этих условиях и сырая древесина горит как порох! Вследствие окисления органических остатков (гниение) кислородом воздуха в почве образуются вещества, необходимые для питания растений. С помощью кислорода воздуха осуществляется один из важных жизненных процессов – дыхание. Это окисление кислородом органических веществ пищи, за счет этого процесса в здоровом организме поддерживается постоянная температура (около 370С). Использование кислорода для дыхания открыло новые возможности в развитии и совершенствовании живых организмов. Избыток кислорода отрицательно влияет на клетку, развивается кислородный токсикоз.
Азот был открыт Д.Рутенфордом в 1772г. В том же году азот был выделен из воздуха английским ученым Г.Кавендишем и, по - видимому, также К.Шееле. Название «азот» предложено А.Лавуазье в 1787году, одним из членов комиссии Парижской Академией наук. Члены комиссии производили его от греческих слов «азое» - безжизненный. В 1790 году француз Ж.Шапталь предложил для азота латинское название - «nitrogenium» - рождающий селитру. Азота много в атмосфере в виде простого вещества, сравнительно мало в воде и твердых породах земли – 0,01% по массе. Видимо, азот длительное время «убегал» из земли в атмосферу. И сейчас азот продолжает с вулканическими газами переходить из «тверди земной» в воздух; известны даже места, где из-под земли бьют струи практически чистого азота. Молекула азота N≡N имеет весьма прочное строение – образующие ее два атома азота обобществляют при соединении три пары электронов. Тройная связь из шести электронов сближает атомы азота на маленькое расстояние. Разорвать такую связь достаточно трудно, для этого необходимо затратить 948,3 кДж/моль. Прочность молекулы азота велика, даже при 33000С только одна из тысяч молекул распадается на атомы. Это бесцветный газ, без запаха, немного легче воздуха. Он плохо растворим в воде (на 100 объемов воды – 2 объема азота). Температура плавления -2100С, кипения -195,80С. Свободный азот в обычных условиях инертен к подавляющему большинству веществ. И это химическое спокойствие азота по отношению к окружающим его веществам – полезное свойство.
Азот – «безжизненный». Странное несоответствие, мы живем в атмосфере азота, разбавленным кислородом. Действительно, для дыхания и горения нужен кислород, а не азот, но, как вскоре было показано убедительными опытами, Природа поступила весьма разумно, растворив кислород в азоте. Если в воздухе меньше 16% кислорода, то наступает кислородное голодание, а при вдыхании чистого кислорода в течение нескольких суток даже у совершенно здоровых людей начинается кислородное отравление и наступает отек легких.
Видимо, содержание кислорода по количеству 21% по объему в атмосфере азота делает воздух наиболее подходящей для дыхания газовой смесью. Лишь в условиях повышенного давления, например, при спуске под воду на большие глубины, когда содержание кислорода не должно превышать 2 – 6% по объему, азот перестает быть самым лучшим разбавителем кислорода. Азот, растворенный в крови в больших количествах, становится ядом для живого организма. При рекордных погружениях глубоко под воду азот в искусственном воздухе, которым дышат исследователи подводного мира, заменяют на гелий, неон, водород.
Природа возвращает азот почве двумя необычными способами, призвав на помощь молнии и бактерии. При огромной температуре воздуха в местах, где молния пронзает атмосферу, молекулы кислорода и азота мгновенно распадаются на отдельные атомы, активно реагирующие друг с другом и с водяными парами атмосферы с образованием азотной кислоты и оксидов азота, поглощаемой почвой. В атмосфере Земли ежегодно вспыхивает три с половиной молний! Подсчитано, что благодаря их полезной химической деятельности почва получает до 15кг азота на гектар. В десятки раз больше азота поставляют почве и растениям особые бактерии – азотофиксирующие.
Азот называют элементом «жизни», при определенных условиях он участвует в создании сложных органических соединений – аминокислоты белков, из которых состоят все живые организмы нашей планеты (в составе белков – 17% азота); дезоксирибонуклеиновая кислота, знаменитая ДНК, передающая наследственные признаки от одного существа к другому; хлорофилл, ферменты, гормоны, витамины.
Углекислый газ. В воздухе совсем немного переменных составляющих – углекислого газа, водяных паров, озона, самой разнообразной пыли, но, видимо, из-за изменчивости и непредсказуемости поведения этих составляющих воздушной атмосферы Земли ученые сейчас особенно тщательно исследуют их свойства. Не только форма облаков, цвет неба над головой зависит от некоторых из этих составляющих воздуха. Даже возможность резкого потепления климата, при котором растопится значительная часть полярных льдов и вода морей и океанов зальет большие участки суши, определяется тем, как будет изменяться в ближайшем будущем состав именно этих компонентов атмосферы. И решающее слово здесь – за углекислым газом. В 1752 году молодой английский химик Джозеф Блэк занимался изучением щелочей. Ему удалось установить, что из всех мягких щелочей при прокаливании выделялся один и тот же газ. Блэк изучил это газообразное вещество. Он нашел, что оно не отличается от газа, выделяющегося при дыхании и при брожении. Так как этот газ связывается (фиксируется) едкими щелочами, Блэк назвал его «фиксируемым воздухом». Это был газ, который мы теперь называем углекислым.
Это бесцветный газ, тяжелее воздуха, со слегка кисловатым запахом и вкусом. Под давлением 6·106Па сгущается в жидкость. При комнатной температуре жидкий оксид углерода(IV) находится в равновесии со своим паром (давлении 52·105Па). Поэтому при выпускании жидкого оксида углерода из баллона на воздух часть ее мгновенно испаряется, а другая часть охлаждается за счет испарения и переходит в твердое состояние. Белая рыхлая масса, похожая на снег (сухой лед) продолжает испаряться, и ее температура падает до -790С. Растворяется в воде (в одном объеме воды при 200С растворяется 0,88 объема).
Оксид углерода (IV) – кислотный оксид, ему соответствует двухосновная угольная кислота. С сильными основаниями оксид углерода реагирует с образованием солей угольной кислоты – карбонатов и гидрокарбонатов. Наиболее активные металлы горят в нем. В других отношениях этот газ инертен.
Так углекислый газ (и водяной пар) свободно пропускает на Землю тепловое излучение Солнца и сильно задерживает обратное излучение Земли, уменьшение содержания углекислого газа в атмосфере явилось одной из причин изменение климата земной поверхности. Было вычислено, что при полном исчезновении углекислого газа из атмосферы средняя температура земной поверхности понизилась бы по сравнению с современной на 210С. Напротив, при удвоении содержания углекислого газа она бы повысилась на 40С. Так в минувшие геологические эпохи атмосфера содержала больше углекислого газа (и водяных паров), средняя годовая температура на Земле была выше, чем в настоящее время. Концентрация углекислого газа в атмосфере сейчас увеличилась на 11%, поэтому температура близких к Земле слоев воздуха поднялась на 10С. Если выбросы углекислого газа в атмосферу будут продолжаться, то, по оценкам некоторых ученых, в 21 веке средняя температура воздуха «подпрыгнет» на 120С, то обитателям Земли грозит «всемирный потоп». Правда, другие ученые считают, что это произойдет не очень скоро. Будем все же надеяться, что человечество найдет способ избавления от всемирного потопа.
Химическое поведение углекислого газа не менее противоречиво и интересно, чем его оптические свойства. В небольших концентрациях в воздухе углекислый газ необходим не только растениям для процесса фотосинтеза, но и всем живым организмам: он возбуждает и регулирует процессы дыхания, поддерживает на постоянном уровне кислотность жидких сред организма – крови и лимфы. Но при повышенном содержании углекислого газа во вдыхаемом воздухе – от 3 до 10% - может наступить тяжелое отравление, а при концентрации выше 10% - потеря сознания и остановка дыхания.
Озон. Озон близкий родственник кислорода. Слово «озон» в переводе с греческого языка означает «пахнущий». Люди впервые встретились с ощутимым количеством озона только после изобретения электрических машин. Впервые описал озон даже не химик, а физик – голландец Мартин Ван Марум в 1785 году. Он посчитал, что под действием на кислород электрического разряда (искры) получается особая «электрическая материя».
В газообразном состоянии озон представляет собой газ с характерным запахом «свежести», растворимый в воде лучше, чем кислород. Температура плавления -1920С, температура кипения -1100С. Озон содержит менее прочно связанные электроны, чем кислород. Молекула озона нестойкая, на это указывает его окраска синяя в газообразном, жидком и черно-фиолетовая в твердом состоянии. Для озона характерны резко выраженные свойства окислителя – все металлы, за исключением золота и платины в большей или меньшей степени окисляются озоном, образуя оксиды. Перевести сернистые соединения и аммиак в серную и азотную кислоты, воспламенить спирт, разрушает каучук.
Малые количества озона появляются в воздухе в результате электрических разрядов во время грозы и заполняют все вокруг ароматом свежести. Но если концентрация этого бледно-фиолетового газа начинает превышать одну частицу на миллион других молекул, то возникает головная боль, чувство усталости, при продолжительном вдыхании сильно озонированного воздуха – даже отравление.
В верхних слоях атмосферы молекулы озона образуются из молекул кислорода под влиянием энергичных коротковолновых ультрафиолетовых лучей Солнца с длиной волны менее 0,18 микрометра. Двухатомный кислород расщепляется на отдельные атомы, которые вновь соединяются уже по трое, образуя на высоте 20 – 25км тонкий слой озона, толщиной всего 3-6 мм. Этот процесс играет большую роль в смягчении действия потока ультрафиолетового излучения Солнца на поверхность Земли, слой озона защищает все живое на нашей планете, в особенности растения.
 Озоновый слой
Озоновый слой
|  Марум Марум
|
Инертные газы.
Инертные газы – гелий, неон, аргон, криптон, ксенон, радон – занимают главную подгруппу восьмой группы таблицы Д.И.Менделеева. Инертные газы настолько безразличны в химическом отношении к другим веществам и элементам, что химики хотели одно время создать для них особую нулевую группу в периодической системе. Атомы инертных газов не вступают во взаимодействии друг с другом. Молекулы инертных газов всегда одноатомны.
 В 1962 году в химических журналах появились статьи с описанием свойств полученных, наконец, непревычных соединений ксенона с фтором. С тех пор получено более 150 химических соединений ксенона, криптона и радона – фторидов, хлоридов, оксидов, кислот, солей и даже нитридов. История открытия инертных газов также необычна, как и их свойства. Еще в 1785 году Кавендиш обратил внимание на странный пузырек неизвестного газа, остающийся в стеклянном сосуде с воздухом, который он длительное время «пробивал» электрической искрой. Более 100 лет спустя в 1884 году английские ученые Джон Рэлей и Уильям Рамзай обнаружили в азоте около 1% нового инертного газа. Спектрограф подтвердил: газ, столько «прятавшийся в тени» атмосферного азота, представляет собой самостоятельный элемент. Он получил название «аргон» - от греческого слова «недеятельный». В 1895 году Рамзай выделил из минерала клевеита еще один инертный газ – гелий. Проницательный английский химик и его соратник Морис Траверс, приступили к напряженной работе. Они переработали около ста тонн жидкого воздуха. Им удалось обнаружить еще три инертных газа: неон («новый»), криптон («скрытый»), ксенон («чуждый»). В начале 20 века физики, изучавшие явление радиоактивности, обнаружили, что в результате цепи превращений радия, часто образуется новый радиоактивный газ, получивший название «радон», производное от слова «радий». Рамзай подробно описал свойства радиоактивного газа. За открытие и исследование свойств инертных газов Рамзай, верный последователь Д.И.Менделеева, в 1904 году был удостоен Нобелевской премии. Благородные газы встречаются и в земной коре. Интересно отметить, что промышленные природные месторождения гелия, как правило, находятся там, где в недрах земли залегают запасы природных газов, сопровождающих скопление нефти. По физическим свойствам эти газы представляют собой вещества с очень низкими температурами плавления и кипения. Температура плавления гелия лежит близко от абсолютного нуля (- 272,30С), а у радона – 710С. Уникальны оптические свойства инертных газов. Они рассеивают свет с различной длинной волны, при этом их спектры имеют удивительные цвета: гелий – желтый; неон – желто-оранжевый; аргон – голубой; криптон – бледно-фиолетовый; ксенон – синий. Прохождение солнечных лучей через слой воздушной оболочки зависит не только от оптических свойств ее газовых составляющих и от количества взвешенных в воздухе частиц пыли, но и от размеров самих молекул газов. Свет, оказывается, может рассеиваться, отражаясь от таких малых частиц, как молекулы! Сильнее всего в воздухе рассеиваются видимые лучи с самой короткой длиной волны – голубые и синие. Так цвет неба получил, наконец, строго научное объяснение!
В 1962 году в химических журналах появились статьи с описанием свойств полученных, наконец, непревычных соединений ксенона с фтором. С тех пор получено более 150 химических соединений ксенона, криптона и радона – фторидов, хлоридов, оксидов, кислот, солей и даже нитридов. История открытия инертных газов также необычна, как и их свойства. Еще в 1785 году Кавендиш обратил внимание на странный пузырек неизвестного газа, остающийся в стеклянном сосуде с воздухом, который он длительное время «пробивал» электрической искрой. Более 100 лет спустя в 1884 году английские ученые Джон Рэлей и Уильям Рамзай обнаружили в азоте около 1% нового инертного газа. Спектрограф подтвердил: газ, столько «прятавшийся в тени» атмосферного азота, представляет собой самостоятельный элемент. Он получил название «аргон» - от греческого слова «недеятельный». В 1895 году Рамзай выделил из минерала клевеита еще один инертный газ – гелий. Проницательный английский химик и его соратник Морис Траверс, приступили к напряженной работе. Они переработали около ста тонн жидкого воздуха. Им удалось обнаружить еще три инертных газа: неон («новый»), криптон («скрытый»), ксенон («чуждый»). В начале 20 века физики, изучавшие явление радиоактивности, обнаружили, что в результате цепи превращений радия, часто образуется новый радиоактивный газ, получивший название «радон», производное от слова «радий». Рамзай подробно описал свойства радиоактивного газа. За открытие и исследование свойств инертных газов Рамзай, верный последователь Д.И.Менделеева, в 1904 году был удостоен Нобелевской премии. Благородные газы встречаются и в земной коре. Интересно отметить, что промышленные природные месторождения гелия, как правило, находятся там, где в недрах земли залегают запасы природных газов, сопровождающих скопление нефти. По физическим свойствам эти газы представляют собой вещества с очень низкими температурами плавления и кипения. Температура плавления гелия лежит близко от абсолютного нуля (- 272,30С), а у радона – 710С. Уникальны оптические свойства инертных газов. Они рассеивают свет с различной длинной волны, при этом их спектры имеют удивительные цвета: гелий – желтый; неон – желто-оранжевый; аргон – голубой; криптон – бледно-фиолетовый; ксенон – синий. Прохождение солнечных лучей через слой воздушной оболочки зависит не только от оптических свойств ее газовых составляющих и от количества взвешенных в воздухе частиц пыли, но и от размеров самих молекул газов. Свет, оказывается, может рассеиваться, отражаясь от таких малых частиц, как молекулы! Сильнее всего в воздухе рассеиваются видимые лучи с самой короткой длиной волны – голубые и синие. Так цвет неба получил, наконец, строго научное объяснение!
С первых дней открытия инертные газы стали верными помощниками людей в самых разнообразных делах. Появление повышенного количества растворенного гелия и радона в источниках подземных вод за несколько дней до землетрясений, позволяет предсказать приближение этих опасных стихийных бедствий. Купание в радоновых ваннах излечивает многие тяжкие болезни.
ТЕКСТ 2
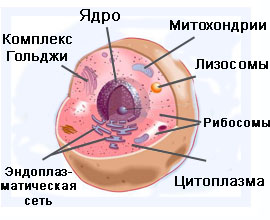
СТРОЕНИЕ КЛЕТКИ
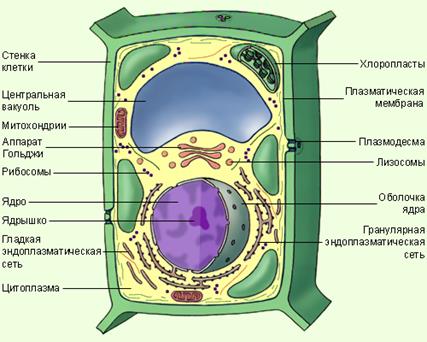
Клетка – сложная физиологическая система, в которой происходят основные процессы жизнедеятельности организма: обмен веществ и преобразование энергии, рост, размножение, раздражение и т.д. В природе существуют как многоклеточные организмы, так и одноклеточные. В зависимости от выполняемых функций клетки отличаются по размерам, формам, количеству и т.д., но все клетки в организме имеют практически одинаковое строение. Общими элементами строения клетки являются:
- наружная мембрана – оболочка, покрывающая клетку. В этой оболочке имеются поры, через которые осуществляется обмен веществами.
- цитоплазма – жидкое наполнение клетки. Этот элемент включает в себя коллоидный раствор и набор структурных образований: рибосомы, митохондрии, комплекс Гольджи и эндоплазматическая сеть. Данные структурные элементы являются общими для всех клеток.
- рибосомы – эти элементы находятся как в цитоплазме, так и в ядре клетки. Они отвечают за синтез белков.
- митохондрии – отвечают за образование энергии, так называемые энергетические центры клетки.
- эндоплазматическая сеть – это совокупность невидимых соединений, которые связывают между собой все части клетки. Внутри эндоплазматической сети осуществляется синтез жиров и углеводов, а по каналам сети внутри клетки происходит обмен веществами
- комплекс Гольджи – выполняет функцию накопления внутри себя ферментов и гормонов.
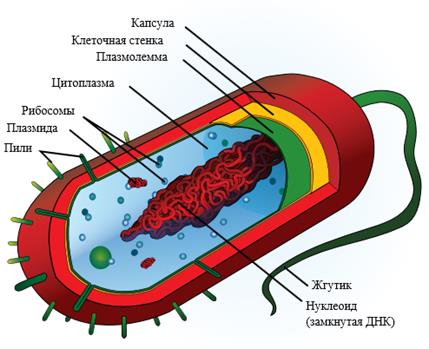
- ядро – обязательный для большинства клеток компонент, главнейший элемент строения клетки. Имеются в природе ряд организмов, в клетках которых не обнаружено структурно оформленного ядра, но в цитоплазме присутствуют все элементы, которые содержатся в ядре. Такими организмами являются некоторые бактерии и вирусы. Ядро играет важную роль в синтезе белков, несет в себе генетическую информацию и в нем заложены процессы формирования индивидуальных особенностей организма. В свою очередь внутри ядра имеются: ядрышко, рибосомы и хроматин. Эти элементы несут в себе генетическую информацию и играют важнейшую роль в делении клетки и преобразовании веществ.
Строению клеток живых организмов характерно наличие в составе лизосом – пузырьков в веществе цитоплазмы, отвечающих за расщепление питательных веществ.
Растительная клетка
Клетка бактерии
ПРИЛОЖЕНИЕ 2.
ТРЕБОВАНИЯ К ВЫПОЛНЕНИЮ РЕФЕРАТИВНОЙ РАБОТЫ
Реферат выполняется на листах формата А4, в редакторе MS Word, шрифтом Times New Roman № 14, поля: левое – 30 мм, правое – 10 мм, верхнее – 20 мм, нижнее – 20 мм, выравнивание текста – по ширине страницы, межстрочный интервал – 1,5, переносы задаются автоматически.
Объем реферата составляет 15–20 страниц, которые должны быть пронумерованы. Нежелательно, если объем будет превышать 20 страниц, так как работа является лишь реферативным изложением поставленного вопроса.
Каждую новую главу следует начинать с новой страницы, равно как и другие основные структурные элементы работы: содержание, список литературы. Не допускается изложение материала сплошным текстом. На каждой странице должны быть как минимум два абзаца. Каждый новый абзац начинается с красной строки.
Страницы нумеруются арабскими цифрами. Титульный лист и содержание включаются в общую нумерацию отчета, но на них номер страницы не ставится.
Перед тем, как сдать работу на проверку, студент обязан исправить имеющиеся орфографические, пунктуационные и стилистические ошибки.
Реферат состоит из введения, основного текста, заключения и списка литературы. Реферат при необходимости может содержать приложение. Каждая из частей начинается с новой страницы.
Титульный лист
Титульный лист является первой страницей реферата, заполняется по строго определенным правилам и оформляется на отдельном листе бумаги (см. образец).
Оглавление
Оглавление размещается после титульного листа. Слово «Оглавление» записывается в виде заголовка (по центру). В оглавлении приводятся все заголовки работы и указываются страницы. Оглавление должно точно повторять все заголовки в тексте.
Введение
Во введении реферата указываются актуальность темы реферата, цель реферата. Кроме того, во введении реферата дается краткая характеристика структуры работы. Объем введения для реферата – 1-1,5 страницы.
Основной текст
Основной текст разделён на главы. Главы реферата нумеруются. Точка после номера не ставится. Если реферат маленький (общий объем – 8-10 стр.), то его можно не разбивать на главы, а просто указывается «Основная часть», которая выступает в качестве заголовка единственной главы. Однако все-таки предпочтительнее, чтобы текст был разбит на главы (хотя бы две). Каждая новая глава начинается с новой страницы. На основную часть реферата приходится 6-16 страниц.
Заключение
В заключении формируются выводы, а также предлагаются пути дальнейшего изучения темы. Здесь необходимо указать, почему важны и актуальны рассматриваемые в реферате вопросы. Заключение должно быть кратким, четким, выводы должны вытекать из содержания основной части.
Список литературы
Список литературы у реферата – 4-12 позиций.
Приложения
Приложения должны нумероваться арабскими цифрами. В правом верхнем углу указывают: «Приложение 1», а с новой строки – название приложения.
Критерии оценки реферата
«Отлично» – выбранная тема раскрыта полно, оформление реферата соответствует всем предъявленным требованиям. Студент хорошо ориентируется в освещаемой теме и полно и грамотно отвечает на поставленные вопросы;
«Хорошо» – выбранная тема раскрыта не достаточно полно, либо студент отвечает на поставленные вопросы верно, но допускает погрешности;
«Удовлетворительно» – студент допускает ошибки при оформлении реферата и слабо раскрывает тему, либо студент испытывает затруднения во время ответов на вопросы преподавателя;
«Неудовлетворительно» – студент не смог раскрыть в работе выбранную тему, оформление работы не соответствует требованиям, предъявляемым к данному виду работ, студент неверно отвечает на вопросы преподавателя, либо отказывается дать ответы на них.
Контрольная работА
Учебная дисциплина Естествознание
Раздел 2. Химия с элементами экологии
Раздел 3. Биология с элементами экологии
по специальностям 071801 Социально – культурная деятельность (по видам)
071501 Народное художественное творчество (по видам)
Омск 2014 г.
Составитель: преподаватель Ижойкина Л.В.
Одобрена методическим объединением педагогических работников
общеобразовательных, общегуманитарных и общепрофессиональных дисциплин
БОУСПО «Омский областной колледж культуры и искусства»
Протокол № ___ « ____» _____________ 201 года
Руководитель МО ______________ ( ___________ )
Рассмотрена на заседании методического совета БОУСПО
«Омский областной колледж культуры и искусства»
Протокол № ___ « ____» _____________ 201 года
Председатель методического совета ______________ ( ___________ )
ВВЕДЕНИЕ
Цель изучения учебной дисциплины:
- освоение знаний о современной естественнонаучной картине мира и методах естественных наук; знакомство с наиболее важными идеями и достижениями естествознания, оказавшими определяющее влияние на развитие техники и технологий;
- овладение умениями применять полученные знания для объяснения явлений окружающего мира, восприятия информации естественнонаучного и специального (профессионально значимого) содержания, получаемой из СМИ, ресурсов Интернета, специальной и научно-популярной литературы;
- развитие интеллектуальных, творческих способностей и критического мышления в ходе проведения простейших исследований, анализа явлений, восприятия и интерпретации естественнонаучной информации;
- воспитание убежденности в возможности познания законов природы и использования достижений естественных наук для развития цивилизации и повышения качества жизни;
- применение естественнонаучных знаний в профессиональной деятельности и повседневной жизни для обеспечения безопасности жизнедеятельности; грамотного использования современных технологий; охраны здоровья, окружающей среды.
В результате освоения дисциплины обучающийся должен уметь:
- ориентироваться в современных научных понятиях и информации естественнонаучного содержания;
- работать с естественнонаучной информацией: владеть методами поиска, выделять смысловую основу и оценивать достоверность информации;
- использовать естественнонаучные знания в повседневной жизни для обеспечения безопасности жизнедеятельности, охраны здоровья, энергосбережения.
В результате освоения дисциплины обучающийся должен знать:
- основные науки о природе, их общность и отличия;
- естественнонаучный метод познания и его составляющие, единство законов природы во Вселенной;
- взаимосвязь между научными открытиями и развитием техники и технологий;
- вклад великих ученых в формировании современной естественнонаучной картины мира.
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
2.1 Требования к оформлению работы
Работа выполняется печатным способом с использованием компьютера и принтера на одной стороне листа формата А4 через полтора (1,5) интервала. Тип шрифта (гарнитура) - Times New Roman, кегль (размер) шрифта - 14. В работе не допускается использование шрифта разных гарнитур.
Абзацы в тексте следует начинать с отступа, равного 12,5 мм.
Названия разделов и подразделов выделяются жирным шрифтом. Название раздела располагается посередине строки, а подраздела – от абзаца. Выравнивание по ширине.
Объем контрольной работы строго не регламентирован, но не должен превышать 10 печатных страниц. Таблицы и графики оформляются или в тексте, или в приложении.
2.2. Методические рекомендации к выполнению контрольной работы
1. Работу выполняйте в соответствии с техническими требованиями.
2. Отвечайте на вопросы конкретно, логично, по теме, с выводами и обобщением.
3. В конце контрольной работы укажите используемую литературу.
4. Содержание контрольной работы должно строго соответствовать тематике выданной преподавателем!!!
ВАРИАНТЫ КОНТРОЛЬНОЙ РАБОТЫ
ВАРИАНТ 1.
РАЗДЕЛ 1. ХИМИЯ С ЭЛЕМЕНТАМИ ЭКОЛОГИИ
Тема 1. Вода, растворы
Задание 1. С какими из перечисленных веществ вода вступает во взаимодействие: СО2, SO2, CаО, SiO2, Cl2, Fe, F2.
Задание 2. Почему не получают ожога, если кратковременно касаются горячего утюга мокрым пальцем? Обоснуйте ответ.
Дата: 2018-12-21, просмотров: 760.