Уравнение состояния идеального газа- это уравнение, которое содержит все три макроскопических параметра,
Макроскопические параметры газа - это величины характеризующие газ как целое (давление, объем, температура).
Давление Р (Па)- величина, обусловленная ударами хаотически движущихся молекул о стенки сосуда.
Объем V ( м3 )- для газа объем определяется объемом сосуда в котором он находится.
Температура Т ( К) –мера нагретости тела.
Уравнение состояния идеального газа – это уравнение, содержащее микроскопические и макроскопические параметры газа.
Уравнение, устанавливающее связь между давлением, объемом и температурой газов, было получено французским физиком Бенуа Клапейроном в виде
P1V1 = P2V2 ИЛИ PV = const
Т 1 Т 2 T
Это уравнение называют уравнением Клапейрона .
Зависимость между давлением , объемом и температурой получил и русский ученый Д.И.Менделеев в виде PV = ν RT
R = 8,31 Дж/моль К – универсальная газовая постоянная
Оба эти уравнения называются уравнением состояния идеального газа, т.к. содержат все три макроскопических параметра, но уравнение Менделеева описывает только одно состояние газа, а уравнение Клапейрона несколько последовательных состояний одного и того же газа.
Тема 12. Изопроцессы в газах.
Многие процессы в газах, происходящие в природе и осуществляемые в технике, можно рассматривать приближенно как процессы, в которых изменяются лишь два параметра из трех.
Изопроцессы – это процессы в газах, происходящие при постоянном одном из параметров.
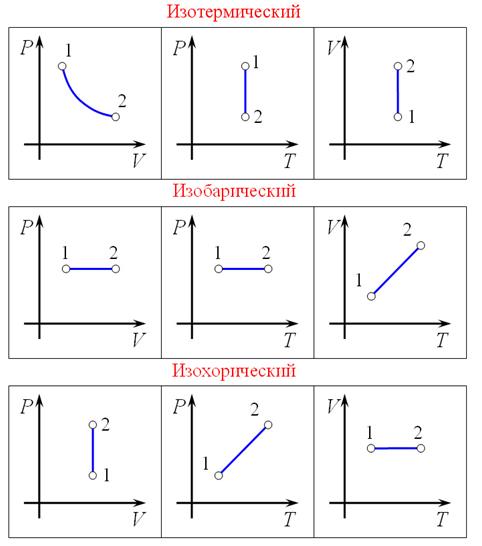
Изотермическим процессом называется процесс, протекающий при постоянной температуре T.
Из уравнения Клапейрона следует, что при постоянной температуре T и неизменных значениях массы газа и его молярной массы М произведения давления p газа на его объем V должно оставаться постоянным: pV = const. или 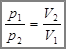
Зависимость между давлением и объемом в этом процессе – обратная. Т.е. при увеличении давления , объем уменьшается.
График изотермического процесса называется и з о т е р м о й.
Как видно из формул, зависимость между давлением и объемом в этом процессе – обратная, т.е. при увеличении давления , объем уменьшается. Изотермический процесс можно осуществить, например, путем изменения объема газа при постоянной температуре. График изотермического процесса называется и з о т е р м о й. Уравнение , устанавливающая связь между давлением и объемом газа при постоянной температуре, было получено из эксперимента в 1662 г. английским физиком Робертом Бойлем и в 1676 г. французским физиком Эдмом Мариоттом . Поэтому это уравнение называют законом Бойля - Мариотта.
Изобарическим процессом называется процесс, протекающий при неизменном давлении p и условии m = const и M = const.
Уравнение для изобарического процесса :
Как видно из уравнений , зависимость между объемом и температурой – прямая. Как изменяется температура , так изменяется и объем.
 Экспериментальное исследование зависимости объема газа от температуры провел в 1802 г. французский физик Жозеф Гей-Люссак (1778 -1850). Поэтому уравнение называется з а к о н о м Г е й -- Л ю с с а к а. Изобарический процесс происходит, например, при нагревании или охлаждении воздуха в стеклянной колбе, соединенной со стеклянной трубкой, отверстие в которой закрыто небольшим столбом жидкости.
Экспериментальное исследование зависимости объема газа от температуры провел в 1802 г. французский физик Жозеф Гей-Люссак (1778 -1850). Поэтому уравнение называется з а к о н о м Г е й -- Л ю с с а к а. Изобарический процесс происходит, например, при нагревании или охлаждении воздуха в стеклянной колбе, соединенной со стеклянной трубкой, отверстие в которой закрыто небольшим столбом жидкости.
Изохорическим процессом называется процесс, протекающий при неизменном объеме V и условии m = const и M = const.
При этих условиях из уравнения состояния идеального газа для двух значений температуры T1 и T 2 следует:
Зависимость между давлением и температурой прямая ( как изменяется температура, так изменяется и давление )
График изохорического процесса называется изохорой.
Экспериментальным путем зависимость давления газа от температуры исследовал французский физик Жак Шарль (1746 - 1823) в 1787 г.
Поэтому уравнение (26.9) называется з а к о н о м Ш а р л я. Изохорный процесс можно осуществить, например, нагреванием воздуха при постоянном объеме( в закрытом сосуде).
Задачи по Основам МКТ
- Кислород массой 80 г находится при давлении 200 кПа и температуре 300 К. Какой объем занимает газ ?
- Найдите концентрацию молекул газа, если при температуре 270 С этот газ оказывает давление 2,5 МПа .
- Объем газа при давлении 500 кПа и температуре 300 К равен 400 л. При какой температуре та же масса газа займет объем 200 л, если давление станет 500 кПа ?
Дата: 2019-12-22, просмотров: 244.