Неблагоприятные эффекты мутагенеза определяются также тем, в клетках какого типа он реализуется: половых, стволовых и делящихся или созревающих и зрелых. Результатом грубых мутации половых клеток и делящихся соматических клеток развивающего плода являются: стерильность особи, врожденная патология у потомства, тератогенез, гибель плода. Мутации * стволовых и делящихся соматических клеток сопровождаются структурно-функциональными
нарушениями тканей с непрерывной физиологической регенерацией (система крови, иммунная система, эпителиальные ткани) и канцерогенезом.
Развитие молекулярной биологии и патологии, рассматривающей заболевания на молекулярном уровне нарушений генных и субклеточных структур, расширяет также задачи и возможности токсикологии. Важное значение приобретают вопросы радиационной и химической генетики (токсикогенетики), тератогенного и бластомогенного действия токсических веществ. Приведем некоторые данные структуры и функций субклеточных образований, необходимые для понимания принципов токсикогенетики.
Наиболее важной составной частью клеточного ядра является ДНК (дезоксирибонуклеиновая кислота), которая соединена с белком гистоном и образует комплекс ДНП (дезоксирибонуклеопротеид). ДНП входит в состав ядерного белка хроматина, из которого образуются хромосомы как аппарат клеточного деления.
ДНК состоит их 4 нуклеотидов (мономеров). Каждый нуклеотид в свою очередь состоит из фосфорной кислоты, углевода - дезоксирибозы и одного из четырех азотистых оснований: пуриновых оснований - А (аденина) и Г (гуанина) и пиримидиновых оснований - Т (Тимина) и Ц (цитозина). Нуклеотиды соединены друг с другом в длинную спиральную нить, а ДНК в целом состоит из двух спиральных нитей, соединенных друг с другом водородными связями оснований. Молекулярная масса ДНК достигает 10 млн. дальтон и более.
В настоящее время можно сщггать установленным, что ДНК является основным носителем наследственных признаков (ген), которые как буквами алфавита закодированы в ДНК путем определенного сочетания азотистых оснований (А, Г, Т, Ц).
Одной из замечательных свойств ДНК является способность к репликации, то есть воспроизведению второй спирали ДНК, абсолютно идентичной исходной, несущей те же генетические признаки организма. Синтез ДНК происходит в период интерфазы жизненного цикла клетки, точнее в фазе S (синтетической фазе), с помощью фермента ДНК-полимеразы из нуклеотидтрифосфатидов. Во время митоза при расщеплении хромосом в каждую из вновь образующихся клеток попадает ДНК со всеми закодированными признаками.
Вторым замечательным свойством ДНК является способность «строить» (синтезировать) РНК (рибонуклеиновую кислоту), которая обеспечивает синтез специфических белков и ферментов, а значит, обеспечивает специфические функции клеток ж. тканей и их
морфообразование (формирование клеток, тканей и органов). «Выдача» соответствующих РНК и синтез необходимых ферментов и белков регулируются генами «регуляторами» и «операторами».
РНК также представляет собой спиралеобразную цепочку, состоящую из нуклеотидов, но отличается от ДНК:
1) в состав РНК в качестве углевода входит рибоза, а не дезоксирибоза (отсюда и название рибонуклеиновая кислота);
2) в качестве азотистых оснований в РНК входят А (аденин), Г (гуанин), Ц (цитозин) и У (урацил вместо тимина);
3) молекулярная масса РНК значительно меньше, чем у ДНК (до 1-2 млн.). Синтез РНК происходит в ядре на матрице ДНК, а потом она выходит и находится в цитоплазме клетки.
Цитоплазма клетки представляет собой сложный коллоидный раствор различных веществ, в котором находятся структурные органеллы клетки: рибосомы, митохондрии, лизосомы, тельца Гольджи и др.
Рибосомы являются своеобразными химическими лабораториями синтеза белков и ферментов. По современным представлениям, синтез белков осуществляется в рибосомах (полирибосомах) из аминокислот при участии различных видов РНК. В рибосомах имеется р- РНК (рибосомная РНК), которая создает условия для синтеза. В цитоплазме находится т-РНК (матричная, или информационная, РНК), которая содержит полученную от ДНК и закодированную азотистыми основаниями информацию о последовательности аминокислот. В цитоплазме же содержится т-РНК (транспортная РНК), являющаяся «подносчиком» соответствующих аминокислот к рибосамам.
Митохондрии играют роль «энергоустановок», где осуществляются окислительные процессы и окислительное фосфорилирование, то есть образование высокоэнергетичных соединений (АТФ и др.), обеспечивающих организм необходимой энергией.
Лизосомы - это образования, богатые гидролитическими и протеолитическими ферментами, расщепляющими белки, жиры, углеводы.
С точки зрения молекулярной патологии и конечного биологического эффекта в действии химических токсических веществ необходимо различать:
- непосредственное общетоксическое действие яда на биоструктуры и физиологические функции макроорганизма, ведущее к нарушению определенных жизненных функций и отравлению организма;
- Токсико-генетическое действие (цитогенетическое), ведущее к нарушениям генетического аппарата соматических и половых клеток, размножения клеток, формирования тканей и органов. Цитогенетическое действие проявляется не только на данные клетки и организм, но и на последующие поколения клеток и организмов.
Цитогенетическое действие может проявляться генетическими нарушениями соматических клеток: нарушения митозов, синтеза белков и ферментов, нарушения иммунитета, злокачественное перерождение клеток (бластомогенное действие), нарушение развития эмбриона и плода (тератогенное действие). Цитогенетические изменения половых клеток могут стать причиной наследственных изменений в последующих поколениях организма.
В настоящее время можно считать установленным, что цитогенетические нарушения вызываются, главным образом, действием химических веществ на элементы ядра - ДНК и хромосомы, а не действием на элементы цитоплазмы.
Мутагенное действие. Действие на ядро и ДНК является причиной различных хромосомных мутаций. Мутации могут быть генные (точковые), обычно связанные с действием яда на азотистые основания, и хромосомные аберрации, связанные с разрывами хромосом и неправильными склейками их (делеции, инверсии, транслокации и др.). Причем в организме мутагенные вещества в наибольшей степени проявляют свое действие в отношении тех тканей, в которых происходит усиленное размножение клеток (кроветворная ткань, желудочно- кишечный тракт и т.д.). Имеется некоторое сходство с действием ионизирующей радиации, также оказывающей мутагенное действие на недифференцированные размножающиеся клетки и ткани организма.
Известно большое количество химических мутагенных веществ.
Многие химические токсические вещества оказывают тератогенное действие на эмбрион и плод у беременных женщин. Широкую известность получила трагедия с талидомидом. Известные десятки лекарственных веществ, оказывающих тератогенное действие на беременных женщин (все алкилирующие агенты, аминазин, аминоптерин, б-меркаптопурин, толбутамид, актиномицин, колхицин и др.)
К бластомогенным (канцерогенным) веществам относятся полициклические углеводороды (3-4-бензпирен и др.), ароматические амины и анилиновые красители, иприты, некоторые неорганические соединения (хрома, никеля, селена) и др. Причем тератогенное и бластомогенное действие проявляется при таких малых, но длительно применяющихся (или даже при однократном применении) дозах, которые не вызывают клинических признаков отравления организма. Механизмы их действия еще недостаточно изучены, но, очевидно, они, как и все мутагенные вещества, вызывают генетические нарушения клеточного ядра, синтеза РНК и морфогенных ферментных систем.
Tоксикодинамика — раздел токсикологи, в рамках которого изучается и рассматривается механизм токсического действия, закономерности развития и проявления различных форм токсического процесса. ~1
Механизм токсического действия
Взаимодействие на молекулярном уровне токсиканта с организмом, приводящее к развитию токсического процесса, называется механизмом токсического действия.
В основе механизма действия могут лежать физико-химические и химические реакции взаимодействия токсиканта с биологическим субстратом.
Токсический процесс, инициируемый физико-химическими эффектами, как правило, обусловлен растворением токсиканта в определенных компартментах клетки, ткани, организма. При этом существенно изменяются их физико-химические свойства. Так, неполярные молекулы ряда ксенобиотиков: предельных углеводородов, спиртов, эфиров, галогенированных углеводородов, низкомолекулярных циклических углеводородов — накапливаются в липидных бислоях возбудимых биологических мембран. При этом изменяются удельный объем, вязкость, проницаемость мембран для ионов и тем самым модифицируются их физиологические свойства. Кислоты, щелочи, растворяясь в водной фазе клетки, ткани, изменяют pH среды. При интенсивном воздействии это может привести к денатурации макромолекул, их разрушению.
Особенность данного типа эффектов — отсутствие специфичности в действии токсиканта. Токсичность определяется физико-химическими свойствами вещества (величиной коэффициента распределения в системе масло — вода, константы диэлектрической проницаемости, константы диссоциации и т. д.).
Чаще в основе токсичности лежат химические реакции токсиканта с определенными субстратами — компонентами живой системы.
В токсикологии (как и фармакологии) любой структурный элемент живой (биологической) системы, с которым вступает в химическое взаимодействие токсикант (лекарство), обозначают термином «рецептор» В таком прочтении это понятие ввел в химиобиологию в начале XX в. Пауль Эрлих (1913).
Спектр энергетических характеристик рецептор-лигандного взаимодействия необыкновенно широк: от образования слабых, легко разрушающихся связей до формирования необратимых комплексов (см. ниже). Характер взаимодействия и структура сформировавшегося комплекса зависят не только от строения токсиканта, конформации рецептора, но и от свойств среды: pH, ионной силы и т. д. В соответствии с законом действующих масс количество образовавшихся комплексов вещество-рецептор определяется энергией Взаимодействия (сродством) и содержанием обоих компонентов реакции (вещества и рецептора к нему) в биологической Системе.
Рецепторы могут бьгть «немыми» и активными. «Немой» рецептор — это Структурный компонент биологической системы, взаимодействие которого с веществом не приводит к формированию ответной реакции (например, связывание мышьяка белками, входящими в состав волос, ногтей, или растворение ДДТ в липидах вакуолей жировых клеток сальника и подкожной клетчатки). Активный рецептор — структурный компонент биологической системы, взаимодействие которого с токсикантом инициирует токсический процесс (например, активный центр цитохромоксидазы, взаимодействие которого с синильной кислотой приводит к острому отравлению).
Как известно, в биологии термин «рецептор» используется еще и для обозначения структур, способных избирательно взаимодействовать с эндогенными молекулами- биорегуляторами (нейромедиаторами, гормонами, субстратами и т. д.) и принимающих непосредственное участие в восприятии и передаче регуляторных сигналов.
для того чтобы избежать терминологических трудностей, для обозначения структурных элементов организма, взаимодействуя с которыми токсикант инициирует токсический процесс, вместо термина «рецептор» в настоящее время часто используют термин «структура-мишень.
Мишенями (рецепторами) для токсического воздействия могут быть:
- структурные элементы межклеточного пространства;
- структурные элементы клеток организма;
- структурные элементы систем регуляции клеточной активности.
Любая клетка, ткань, орган содержит огромное количество потенциальных рецепторов (структур-мишеней) различных типов (запускающих различные биологические реакции), с которыми могут вступить во взаимодействие химические вещества. Поэтому связывание токсиканта на рецепторе какого-то одного типа является избирательным лишь в определенном диапазоне его концентраций во внутренней среде. Увеличение концентрации токсиканта в биосистеме приводит не только к увеличению числа связанных рецепторов одного типа, но и к расширению спектра типов рецепторов, с которыми он вступает во взаимодействие, а следовательно, к изменению его биологической активности. Это одно из фундаментальных положений токсикологии, доказанное многочисленными наблюдениями.
Принимаются постулаты:
- токсическое действие вещества выражено тем сильнее, чем большее количество активных рецепторов (структур-мишеней) вступило во взаимодействие с токсикантом;
- токсичность вещества тем выше, чем меньшее его количество связывается с немыми» рецепторами, чем эффективнее оно действует на активные рецепторы (структуры-мишени), чем большее значение имеет рецептор и повреждаемая биологическая система для поддержания гомеостаза целостного организма.
Наиболее часто токсический процесс развивается в результате воздействия химических веществ на белки (повреждение структурных белков, нарушение активности энзимов), нуклеиновые кислоты, липиды биомембран, селективные рецепторы эндогенных биорегуляторов.
В результате такого воздействия клетки либо повреждаются (цитотоксическое действие), либо нарушаются механизмы регуляции их функций.
Химизм реакции токсикант — рецептов
Взаимодействие токсиканта со структурами-мишенями подчиняется тем же закономерностям, что и любая химическая реакция, протекающая ex vivo, и, следовательно, во многом зависит от свойств вещества. Большинство высокотоксичных соединений — инертные в химическом отношении молекулы. Химически активные соединения при контакте с покровными тканями немедленно вступают с ними во взаимодействие и, вызывал лишь местные повреждения, не проникают во внутренние среды организма.
Сила межмолекулярного взаимодействия между токсикантом, проникшим во внутренние среды организма, и биологической молекулой-мишенью действует, как правило, локально; образующаяся связь способна к диссоциации. Высвободившаяся из связи с токсикантом биомишень часто восстанавливает исходные свойства. В подобных 9лучаях достаточно элиминировать несвязавшуюся часть токсиканта из организма для того, чтобы сдвинуть химическое равновесие в сторону разрушения комплекса «токсикант — мишень» и тем самым устранить действие яда. Например, обратимо взаимодействуют со структурами-мишенями летучие неполярные растворители (гексан, толуол и др.), ингаляция которых сопровождается нарушением сознания, развитием наркотического эффекта.
Некоторые токсиканты образуют с молекулами-мишенями прочные комплексы, разрушить которые возможно только с помощью других средств, образующих с ядом еще более прочную связь. В частности, для восстановления активности ацетилхолииэстеразы, ингибированной фосфорорганическими соединениями (ФОС), применяют вещества из группы оксимов, вступающие во взаимодействие с токсикантами и вызывающие тем самым дефосфорилирование активного центра энзима.
Иногда в процессе метаболизма ксенобиотика в клетках образуются весьма активные в химическом отношении промежуточные продукты. При действии на биомолекулы они образуют с ними чрезвычайно прочные связи, разрушить которые практически невозможно: биомишень повреждается необратимо. Таким образом, например, иприт взаимодействует с пуриновыми основаниями нуклеиновых кислот.
Взаимодействие токсикантов с белками
Основными функциями белков являются: транспортная, структурная, энзиматическая. Токсический эффект может развиваться при нарушении каждой из этих функций. Особое значение имеет ингибиторное действие токсикантов на энзимы.
Угнетение активности энзимов происходит различными путями, зависящими от строения токсиканта. Возможны:
денатурация (изменение конформации) белковой части фермента;
· блокада активных центров ферментов;
· конкуренция с коэнзимом (его связывание, истощение запасов);
· взаимодействие с аллостерическим центром;
· взаимодействие с субстратом;
· связывание активаторов ферментативной активности.
К числу веществ, денатурирующих белки, относятся крепкие щелочи, кислоты, окислители, ионы тяжелых металлов. В основе денатурации лежит нарушение внутрибелковых связей, стабилизирующих- вторичную, третичную, четвертичную структуру апофермента. Наиболее часто токсиканты взаимодействуют с СООН-, ТН-, ОН-, SH-группами белков. Многочисленные токсиканты, взаимодействующие с SH-группами, называются тиоловыми ядами (мышьяк, ртуть, люизит).
Целый ряд высокотоксичных соединений, структурно напоминая субстрат, способны взаимодействовать с активными «центрами» энзимов, угнетая их активность. К таким веществам относятся ингибиторы холинэстеразы (ФОС, карбаматы к т. д.), ингибиторы аконитазы (метаболиты фтор-, хлоруксусной кислоты). Многие токсиканты, взаимодействуя с простетической группой энзимов, блокируют их активность. Таким способом, например, сульфиды и цианиды ингибируют цитохромокс!4дазу, ряд других энзимов, простетической группой которых являются железосодержащие порфириновые структуры.
Примерами токсикантов, взаимодействующих с субстратами с образованием продуктов, ингибирующих активность энзимов, являются гидразин (взаимодействие с пиридоксалем, образование пир14доксальгиаразо нов, ингибиторов пиридоксалькигназы), мышьяковистая кислота (взаимодействует с фосфоглицероальдегидом — продукт ингибирует гликолиз).
Известно, что целый ряд ферментов «работает» лишь в присутствии активаторов. К числу последних часто относятся ионы металлов: Mg, Mn, Со, Zп, Си, Са и т. д. Удаление указанных ионов из среды сопровождается существенным снижением активности ферментов. Представителями веществ, реализующих токсическое действие по этому механизму, являются хелатирующие агенты. Наиболее токсичные представители — производные гицроксиизохинолина и дитиокарбаматы. дитиокарбаматы связывают ион Си, активизирующий важнейший энзим метаболизма спиртов — альдегид дегидрогеназу. Некоторые производные дитиокарбаматов, образующие комплексы с Мп, Со, используются в качестве фунгицидов.
Поскольку подавляющее большинство процессов, протекающих в организме, имеет ферментативную природу, угнетение активности ферментов — наиболее частая причина развития интоксикаций, имеющих самые разнообразные проявления.
Взаимодействие токсикантов нуклеиновыми кислотами
Дезоксирибонуклеиновые кислоты — основной компонент хромосомного аппарата клеток. Рибонуклеиновые кислоты в клетках образуют три пула —- информационной, транспортной, рибосомальной РНК. Их функция — участие в синтезе белка.
К числу веществ, вступающих в химическое взаимодействие с нуклеиновыми кислотами, относятся нитриты, сернистый, азотистый кислородный иприты, этиленоксид, этиленимин, гидразин и его производные, гидроксиламин, нитрозамины, ареноксиды, полициклические углеводороды, метаболиты афлатоксинов, соединения мышьяка, золота и многие другие вещества. Эти токсиканты образуют ковалентные связи с аминогруппами пуриновых и пиримидиновых оснований и с углеводно-фосфатной основой молекул нуклеиновых кислот. При этом происходит нарушение их свойств.
Многие ксенобиотики образуют нековалентные связи с ДНК. При этом меняется конформация макромолекул. Так, известно высокое сродство к нуклеиновым кислотам производных акридина, которые, встраиваясь в молекулу ДНК между соседними парами оснований (интеркалация), изменяют ее структуру. Таков же, вероятно, механизм действия этидиумбромида, профлавина и др. Антрациклин, хлорахин, актиномиции и некоторые другие антибиотики также изменяют конформацию нуклеиновых кислот, не образуя с ними ковалентных связей.
Последствия повреждения ДИК и РНК зависят от дозы токсиканта и сопровождаются нарушениями процессов синтеза белка, клеточного деления и передачи наследственной информации.
Взаимодействие токсикантов с липидами мембран
Липиды — инертные в химическом отношении молекулы, поэтому их взаимодействие с токсикантами в основном носит физико-химический характер. Важнейшая функция липидов — формирование биологических мембран. Вещества, разрушающие, изменяющие структуру липидов, нарушающие взаимодействие между молекулами липидов (гидрофобные связи), повреждают биологические мембраны и поэтому называются мембранотоксикантами. К числу таких относятся многие спирты, предельные и галогенированные углеводороды, бензол, толуол (неэлектролиты), детергенты (поверхностно-активные вещества: мыла, сапонины), окислители, щелочи и другие денатурирующие агенты, а также яды, обладающие фосфолипазной активностью (яды змей и т. д.). В результате нарушения структурной целостности мембран развиваются деформация, лизис клеток и их гибель. При действии сапонинов на мембраны эритроцитов развивается гемолиз, действуя в малых дозах на возбудимые мембраны нервных клеток ЦИС, органические растворители, спирты вызывают седативно-гипнотический эффект.
Взаимодействие реактивными структурами возбудимых мембран
Реактивные структуры возбудимых мембран — это ионные каналы и селективные рецепторы для эндогенных биологически активных веществ (нейромедиаторов, гормонов и т. д.). Они представляют собой определенным образом организованный комплекс белковых молекул, встроенных в структуру биологической мембраны. Ионные каналы и рецепторные структуры в ряде случаев функционируют как единая система.
Выделяют следующие типы селективных рецепторов мембран:
· непосредственно формирующие ионные каналы;
· связанные с Й-протеинами • обладающие тирозинкиназной активностью;
· образующие межрецепторные сети.
8. Рецепторы, формирующие ионные каналы. К числу известных каналообразующих рецепторов относятся никотинчувствительный рецептор ацетилхолина (Н-холинорецептор), ГАМК-ергический, глицинергический рецепторы. Первый из упомянутых является каналом для ионов Na+, два других — для ионов С1-. Известно большое количество веществ, действующих на эти рецепторы. Например, курарин, никотин, анабазин (действуют на ходинорецепторы), бициклофосфаты, норборнан, пикротоксинин (действуют на ГАМК-рецепторы), стрихнин (действует на рецепторы к глицину).
К этой же группе рецепторов можно отнести Na+, К+, Са2+каналы возбудимых мембран, для которых пока не найдены эндогенные химические агонисты. Тем не менее ионные каналы имеют рецепторную область связывания высокотоксичных ядов животного происхождения, таких как тетродотоксин, сакситоксин, батрахотоксин и др.
2, Рецепторы, связанные с б-протеинами. Особый вариант передачи регуляторных сигналов в организме на молекулярном уровне представлен механизмом взаимодействия эндогенных лигандов с рецепторами, ассоциированными с 4-протеинами (регуляторными протеинами). К числу рецепторов такого типа относятся, в частности, мускаринчувствительные холинергические рецепторы (М-холинорецепторы), адренорецепторы и т. д.
Токсиканты могут нарушать передачу сигнала на любом из этапов его проведения, действуя на рецептор, аденилатциклазу и т. д. Например, холерный и коклюшный токсины вызывают АДФ-рибозилирование ё-протеина (белка превращающего гуанозинтрифосфат в гуанозиндифосфат) после его связывания с молекулой ГТФ. В итоге развивается стойкая активация аденилатциклазы и перевозбуждение соответствующих клеток слизистых оболочек.
В настоящее время известно огромное количество веществ, синтетических и естественного происхождения, избирательно взаимодействующих с рецепторами данного типа. Среди них многочисленные лекарственные средства (холинергические, катехоламинергические, серотонинергические препараты), интоксикация которыми развивается как при перевозбуждении, так и блокаде рецепторов. Сюда же относится большая группа веществ, обладающих психодислептической активностью (диэтиламид лизергиновой кислоты, псилоцин, псилоцибин, буфотенин, мескалин, хинуклкдинилбензилат — В2 и т. д.).
3, Рецепторы, с тирозинкиназной активностью. К рецепторам данного типа относятся, в частности, рецепторы к инсулину и гормону роста. Пусковым сигналом процессов, приводящих к активации клетки, является развивающееся фосфорилирование внутриклеточных белков по молекуле тирозина. Токсиканты, избирательно действующие на данный тип рецепторов, пока не известны.
4, Рецепторы, образующие межрецепторные сети. Наилучшим образом в группе рецепторов данного типа изучены рецепторы к Fc-фрагменту антител (иммуноглобулинов). С действием на рецепторы данного типа связывают экзоцитоз биологически активных веществ, и в частности, гистамина из тучных клеток, лежащий в основе анафилактических реакций на химические вещества, обладающие антигенными свойствами.
Общие механизмы цитотоксичности
Часто в основе токсического действия веществ лежит повреждение клеток, сопровождающееся их функциональными либо структурно—функциональными изменениями, разнообразие формирующихся при этом эффектов со стороны целостного организма обусловлено сложностью организации клеток, многообразием клеточных форм, составляющих организм. Сформировавшиеся в процессе эволюции особенности структуры и функции отдельных клеточных типов, формирующих различные органы и ткани, настолько существенны, что чувствительность различных клеток к токсикантам может отличаться в тысячи раз. Тем не менее живое объединено общностью фундаментальных свойств, а это позволяет выделит 1 и некоторые общие механизмы, лежащие в основе цитотоксического действия ксенобиотиков. К числу важнейших можно отнести следующие:
· нарушение энергетического обмена;
· активация свободно-радикальных процессов в клетке;
9. повреждение клеточных мембран;
· нарушение гомеостаза внутриклеточного кальция;
· нарушение процессов синтеза белка и клеточного деления.
Необходимо отметить, что все эти механизмы тесно связаны друг с другом. Порой один из них является пусковым, но в дальнейшем особую значимость для судьбы поврежденной клетки приобретают другие. Очень часто два или несколько из упомянутых механизмов связаны между собой по типу «порочного круга».
Повреждение мембранных структур
Помимо непосредственного действия на липидный бислой (см. выше) возможны и иные механизмы повреждения токсикантами биомембран. К числу важнейших откосятся:
- активация перекисного окисления липидов;
-активация фосфолипаз.
Активация перекисного окисления липидов. Благодаря высокому содержанию ненасыщенных связей в углеводородной цепи жирных кислот, фосфолипиды клеточных мембран наиболее предрасположены к реакции окисления, инициируемой свободными радикалами, образующимися в клетке (см. выше). Этому способствует то обстоятельство, что молекулярный кислород в 7—8 раз лучше растворяется в липидной фазе, чем в воде и гидрофильных сайтах клетки. Атака активных форм кислорода на ненасыщенные связи жирных кислот приводит к образованию пероксидных радикалов (перекисиое окисление липидов.) и разрушению биологических мембран. Процесс перекисного окисления сопровождается также образованием из липидов высоко реакционноспособных и легко диффундирующих карбонильных радикалов, которые могут обусловливать неблагоприятные процессы, развивающиеся в клетках далеко за пределами места своего образования — не только клетки, но и органа. Хорошо кровоснабжающиеся и насыщенные кислородом ткани (легкие, сердце, головной мозг) являются более чувствительными к повреждающему действию пирооксидантов.
Активация фосфолипаз. Важным механизмом повреждения биологических мембран является гидролиз фосфолипидов, наступающий вследствие активации фосфолипаз (особенно фосфолипазы А2). Активация энзима происходит в результате прямого или опосредованного (гипоксия, нарушение гомеостаза внутриклеточного кальция и т. д.) действия многих токсикантов на клетки организма.
В результате действия фосфолипазы А2 на липиды биологических мембран высвобождается арахидоновая кислота. Последняя является, в свою очередь, субстратом энзима циклооксигеназы. Превращение арахидоновой кислоты под влиянием энзима приводит к образованию эйкозаноидов (простагландинов, тромбоксанов, простациклинов) — веществ, активирующих воспалительные процессы в тканях. Под влиянием другого энзима 5липоксигеназы арахидоновая кислота превращается в лейкотриены и эйкозатетраеноевые кислоты — химиоатрактанты нейтрофилов, вещества, регулирующие сосудистую проницаемость.
Еще одним продуктом энзиматического расщепления липидов мембран является фактор агрегации тромбоцитов (ФАТ) — клон биологически активных веществ (более 150 аналогов) близкого строения. ФАТ — чрезвычайно токсичные вещества (1050 для кролика — 0,005 мг/кг; для собаки — 0,07 мг/кг), вызывающие при внутривенном введении шокоподобное состояние (острый, некупируемый коллапс, бронхоспазм и др.).
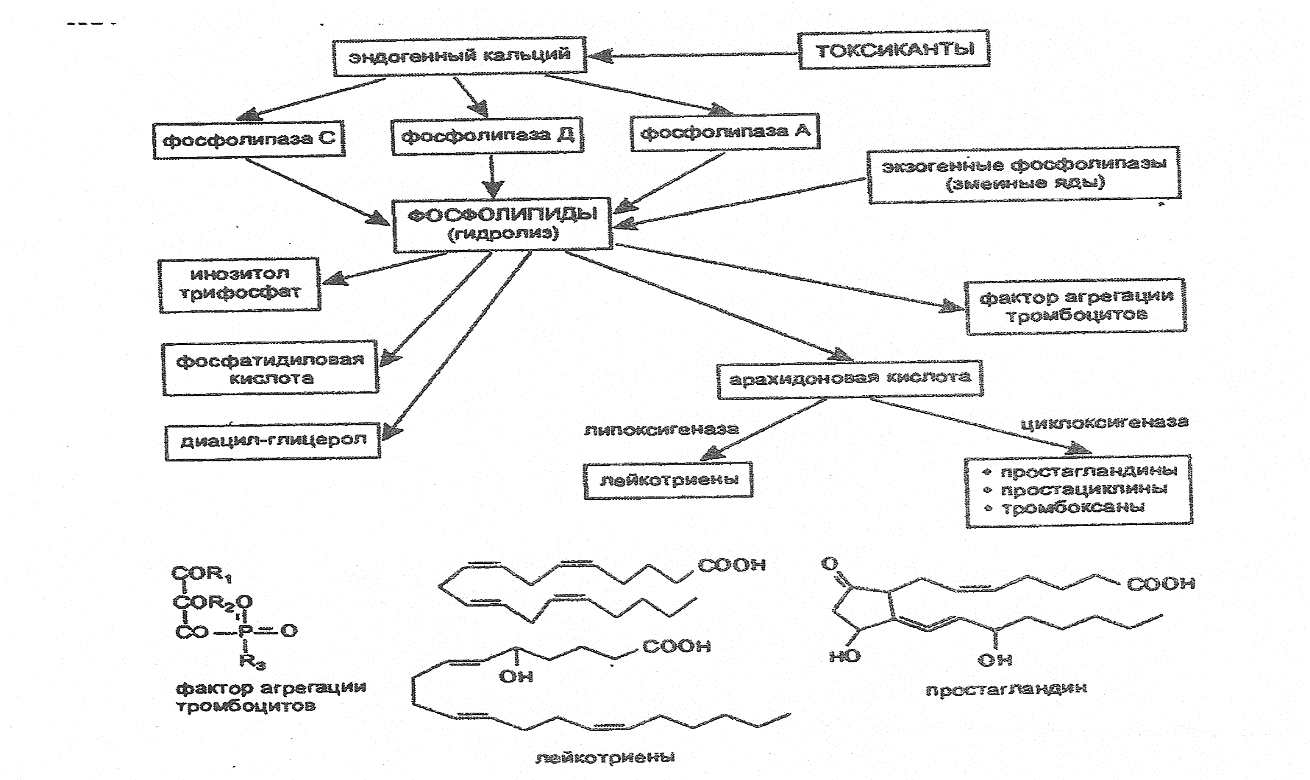
Образование биологически активных веществ при участии фосфолипаз, активируемых в ходе токсического процесса
Поскольку система внутриклеточных мембран также является мишенью для действия многочисленных токсикантов, среди них можно выделить группу митохондриальных ядов, повреждающих различные звенья процессов биоэнергетики, — веществ, действующих на шероховатый (нарушение процессов синтеза белка) и гладким эндоплазматический ретикулум (индукция или угнетение метаболизма ксенобиотиков), лизосомальные мембраны (провоцируют аутолиз клеток) и др.
Повреждение процессов синтеза белка и клеточного деления
В основе нарушения процессов синтеза белка, клеточного деления и передачи наследственной информации лежит повреждение токсикантами молекул ДНК, РНК и ферментов, участвующих в их синтезе и репарации.
Возможные точки приложения повреждающего действия токсикантов на процессы синтеза белка и клеточного деления
1, Синтез ДНК. Репликация
· изменение структуры (конформации) ДНК
- нарушение процесса полимеризации ДНК
» нарушение синтезе нуклеотидов
« нарушение процесса репарации ДНК
· нарушение механизмов регуляции синтеза ДНК
2, Синтез РНК. Транскрипция
-разрушение РНК
- нарушение полимеризации РНК
- нарушение процессии РНК
-нарушение синтеза нуклеотидов
- нарушение механизмов регуляции синтеза РНК
3. Синтез белка. Трансляция
- нарушение организации и процессии рибосом и полисом
-нарушение полимеризации аминокислот
-нарушение образования аминоацетил-РНК
нарушение формирования конформации белка и его третичной и четвертичной структур
- нарушение механизмов регуляции трансляции
Существуют и другие способы токсического повреждения процессов. Так, в фазе приготовления к митозу возможно повреждение центриолей и угнетение синтеза митотического аппарата, образующего клеточное веретено. Веретено формируется SH- содержащими протеинами (тубулином), которые благодаря - S-S-связям образуют нитевидные структуры. Естественно, токсиканты, взаимодействующие с SH-группами, способны повреждать митотическое веретено и тем самым нарушать клеточное деление. Примерами таких токсикантов являются мышьяк, ртуть и их соединения, колхицин, подофилотоксин и др.
Повреждающее действие химических веществ на ДНК называется генотоксическим. Результатом генотоксического действия ксенобиотиков нередко является мутагенез.
Мутации — это наследуемые изменения генетической информации, хранящейся в ДНК клеток. Химические вещества, способные вызывать мутации, называются мутагенами.
Все клетки организма находятся в одной из фаз клеточного цикла:
1, Покоя: клетка функционирует или покоится (большинство соматических не делящихся клеток).
2, Синтеза клеточных компонентов, необходимых для последующего синтеза ДНК: идет накопление необходимого количества пуриновых и пиримидиновых оснований и других химических компонентов ДНК. В делящейся клетке процесс занимает до 40% общего времени цикла клеточного деления.
3,Синтеза ДНК: осуществляется сборка» новой молекулы ДНК из наличествующих в клетке компонентов. Процесс занимает до 39% времени клеточного цикла.
4, Синтеза клеточных компонентов для митоза. В частности, синтезируются мономеры и полимер тубулина и Т. д. Процесс занимает около 19% времени цикла делящейся клетки.
5, Митоза: разделение генетического материала между вновь образующимися дочерними клетками; клеточное деление. Процесс занимает 2% времени.
Некоторые химические вещества способны вызывать мутации лишь тех клеток, которые находятся в определенной фазе цикла, это так называемые цикло-специфичные вещества. Другие действуют на генетический аппарат не зависимо от того, в каком периоде клеточного цикла находится клетка (цикло-неспецифичные). Такая особенность определяется механизмом токсического действии веществ (см. выше). К числу цикло-неспецифичных принадлежат мутагены, способные вызывать химическое повреждение ДНК (алкилирующие агенты и химические модификаторы нуклеотидов). Все остальные мутагены являются циклоспецифичными.
Основными видами мутаций, вызываемых химическими веществами, являются:
1) точечная мутация, связанная с модификацией одного нуклеотида в структуре ДНК (замещение нуклеотида, выпадение нуклеотида из цепи, включение дополнительного нуклеотида в цепь);
2) хромосомные аберрации, т. е. изменение структуры хромосом (разрывы молекул ДНК, транслокации фрагментов ДНК) или числа хромосом в клетке.
Далеко не всякая модификация молекулы ДНК (мутация) является опасной для организма.
Клетки обладают способностью корректировать и устранять повреждения ДНК. Вследствие этою лишь небольшое число мутаций, инициированных токсикантом, сохраняется в процессе репликации молекулы. Однако если мутация не распознана, извращенная информация транскрибируется в РНК, а затем экспрессируется в форме неполноценного протеина.
Последствия этого для клетки могут быть либо несущественны, либо критичны, в зависимости от функций, выполняемых протеином.
Неблагоприятные эффекты мутагенеза определяются также и тем, в клетках какого типа он реализуется: половых или соматических, стволовых и делящихся или созревающих и зрелых. Результатом грубых мутаций половых клеток и делящихся клеток развивающегося плода являются: стерильность особи, врожденная патология у потомства, тератогенез, гибель плода. Мутации стволовых и делящихся соматических клеток сопровождаются структурно- функциональными нарушениями тканей с непрерывной физиологической регенерацией (система крови, иммунная система, эпителиальные ткани) и канцерогенезом. Повреждение токсикантом ДНК зрелой соматической клетки не приводит к пагубным последствиям для организма.
Последствия повреждения ДНК зависят от дозы токсиканта. Высокие дозы вызывают цитостатический эффект (гибель пула делящихся клеток), дистрофические изменения в клетке, более низкие — канцерогенное, тератогенное действие.
Существует представление, согласно которому проникновение в организм даже единственной молекулы генотоксиканта (в отличие от токсикантов с иным механизмом токсического действия) может привести к пагубным последствиям, дело в том, что химическое повреждение единичной молекулы ДНК в единичной клетке макроорганизма, при стечении обстоятельств, может стать причиной образования целого клона клеток с измененным геномом. Вероятность такого события бесконечно мала, но теоретически возможна. Такой характер действия веществ на биосистемы называется беспороговым.
Дата: 2019-04-23, просмотров: 156.