Они состоят из одной а-субъединицы, формирующей канал, и двух β-субъединиц, модулирующих ионную проницаемость и кинетику инактивации натриевых каналов (рис. 6).
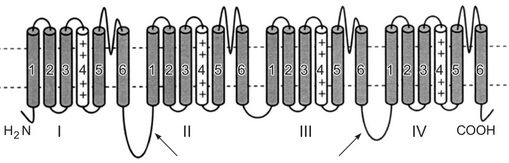
Рис. 6. Двухмерная структура а-субъединицы потенциал-зависимого натриевого канала. Описание в тексте
Как видно из рис. 6, а-субъединица представлена четырьмя однотипными доменами, состоящими из шести спирализованных трансмембранных сегментов, соединенных аминокислотными петлями. Петли, соединяющие 5-й и 6-й сегменты, окружают пору канала, а в составе 4-го сегмента содержатся положительно заряженные аминокислоты, которые являются сенсорами разности потенциалов на мембране и управляют положением воротного механизма при сдвигах трансмембранного потенциала.
В потенциалзависимых натриевых каналах имеются два воротных механизма, один из них — активационный (при участии 4-го сегмента) обеспечивает открытие (активацию) канала при деполяризации мембраны, а второй (при участии внутриклеточной петли между 3-м и 4-м доменами) — его инактивацию при перезарядке мембраны. Поскольку оба этих механизма быстро изменяют положение ворот канала, то потенциалзависимые натриевые каналы являются быстрыми ионными каналами и имеют определяющее значение для генерации потенциалов действия в возбудимых тканях и для их проведения по мембранам нервных и мышечных волокон.
Эти каналы локализуются в цитоплазматических мембранах аксонного холмика нейронов, в дендритах и аксонах, в мембране околосинаптичсской области нервно-мышечного синапса, в сарколемме волокон поперечно-полосатых мышц и сократительного миокарда. Плотность распределения натриевых каналов в этих структурах различна. В миелинизированных нервных волокнах они сосредоточены главным образом в области перехватов Ранвье, где их плотность достигает около 10 000 каналов на квадратный микрон площади, а в немиелинизированных волокнах каналы распределены более равномерно с плотностью около 20 каналов на ту же площадь. Эти каналы практически отсутствуют в структуре мембран тела нервной клетки, в мембране нервных окончаний, непосредственно формирующих сенсорные рецепторы, и в постсинаптических мембранах эффекторных клеток.
Среди потенциалзавиеимых натриевых каналов различают уже более девяти подтипов, отличающихся свойствами а-субъединиц, имеющих определенную тканевую принадлежность и отличающихся различной чувствительностью к действию блокаторов. Так, например, подтип канала, образованного каналообразующим белком, синтез которого контролируется геном SCN4A, имеется в сарколемме полностью дифференцированных и иннервированных скелетных мышц и его блокагорами являются тетродотоксин, сакситоксин и ц-конотоксины. В большинстве случаев а-субъединицы чувствительны к действию тетродотоксина, который в микромолярных концентрациях блокирует поры и тем самым вход в натриевые каналы.
Известны токсины натриевых каналов, вызывающие замедление скорости их инактивации. Например, токсин морской анемоны (АТХ) и а-токсин скорпиона (ScTX) вызывают замедление инактивации, связываясь с аминокислотными остатками петли S3-S4 4-го сегмента.
Синтезированы и широко используются в медицине для блокады быстрых потенциалзависимых натриевых каналов вещества, получившие название анестетиков (новокаин, дикаин, лидокаин, совкаин, прокаин и др.). Анестезия при блокаде ими натриевых каналов достигается за счет устранения возможности генерации нервных импульсов в афферентных нервных волокнах и тем самым блокады проведения сигналов от сенсорных болевых рецепторов в ЦНС.
Обнаружено, что изменение структуры натриевых каналов может вести к развитию ряда заболеваний. Так, например, изменение структуры канала, контролируемого геном SCNlb, ведет к развитию генерализованных форм эпилепсии и судорог при повышении температуры тела (фебрильных судорог).
Многие микроорганизмы образуют в организме человека токсины — вещества, под действием которых в поражаемых клетках блокируются ионные каналы, что может сопровождаться нарушением ионного баланса и гибелью клетки. Другие микроорганизмы, наоборот, своими токсинами (перфоринами) формируют в мембране клетки ионные каналы. В частности, токсин палочки сибирской язвы, вызывающей у человека особо опасную инфекцию, атакуя клетку, образует в ее мембране новые поры (каналы), через которые в клетку проникают другие токсины. Действием этих токсинов обусловлена гибель атакованных клеток и высокая смертность при этом заболевании. Учеными синтезировано вещество β-циклодекстрин, близкое по пространственной структуре к форме образующегося канала. Это вещество блокирует каналы, образуемые токсином микроорганизма, предотвращает поступление токсинов в клетки и спасает от гибели экспериментальных животных, зараженных палочкой сибирской язвы.
Калиевые каналы
Существуют потенциалзависимые и потенциалнечувствительные калиевые каналы. Среди последних выделяют пассивные, лигандзависимые и другие типы калиевых каналов. Как правило, калиевые каналы имеются в мембранах тех же клеток и тканей, в которых содержатся натриевые каналы. Одной из причин такого параллелизма в расположении этих ионных каналов является то, что ионы Na+ и К+ являются важнейшими катионами, от характера распределения и перемещения которых зависит возникновение и изменение электрических потенциалов как одной из важнейших форм передачи информационных сигналов в организме.
Существует целое суперсемейство калиевых ионных каналов, которые подразделяются но особенностям структуры, месту локализации и свойствам каналов на отдельные семейства, типы и подтипы. Описано более трех десятков калиевых каналов, и дать их подробную характеристику не представляется возможным. Поэтому в качестве примеров будут приведены описания тех семейств и типов ионных каналов, которые имеют отношение прежде всего к сигнальным путям и механизмам контроля нервных и мышечных процессов.
Дата: 2019-04-22, просмотров: 624.