Разность потенциалов, измеренная между внутренней и наружной поверхностями клеточной мембраны в состоянии физиологического покоя клетки, называется потенциалом покоя.
Потенциал покоя у разных клеток имеет величину от 50 до 100 мВ. Согласно современным взглядам, потенциал покоя по своей природе является мембранным потенциалом. Наличие мембраны приводит к возникновению потенциалов клеток, как в покое, так и при возбуждении. Причина их возникновения - неравномерное распределение ионов калия и натрия между содержимым клеток и межклеточной средой.Концентрация ионов калия внутри клеток в 20—40 раз превышает их содержание в окружающей клетку жидкости. Напротив, концентрация натрия в межклеточной жидкости в 10—20 раз выше, чем внутри клеток. Такое неравномерное распределение ионов обусловлено активным переносом ионов—работой натрий-калиевого насоса.
В 1905 г Бернштейн выдвинул гипотезу возникновения мембранного потенциала в покое. Он утверждал, что разность потенциалов на мембране обусловлена:
1. наличием разности концентраций ионов К+ и Na+ в цитоплазме клетки и снаружи.
2. В покое мембрана проницаема только для ионов К+.
В связи с этим был выведен равновесный калиевый потенциал, который определяется из уравнения Нернста
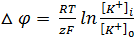
или
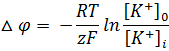
Исходя из гипотезы Бернштейна для мышечных волокон мембранный потенциал равен (-110) мВ, а экспериментальные данные давали (-90) мВ. Причина в расхождении в том, что гипотеза Бернштейна не учитывала проницаемость мембраны для других ионов, таких как Na+ и Cl-.
Для более точного вычисления потенциала покоя необходимо учитывать не только диффузию ионов калия, но и диффузию натрия и хлора. Уравнение Нернста позволяет описывать мембранный потенциал только в первом приближении; для более точного определения потенциала применяют обобщенное уравнение Гольдмана-Ходжкина-Хаксли:
Е = (RT/ z F)·ln[( Рк·[K.]i + PNa·[Na]i + PCl·[Cl]e) / ( Рк·[K.]e + PNa·[Na]e + PCl·[Cl]i)
где Pk, PNa, PCl — коэффициенты проницаемости мембраны для ионов калия, натрия и хлора; [К], [Na], [Cl] — их активности внутри (i) и вне (е)клетки. Уравнение Гольдмана-Ходжкина-Хаксли позволяет определять мембранный потенциал не только в состоянии покоя, но и при возбуждении клетки. Для этого необходимо знание коэффициентов проницаемости для ионов. По данным Ходжкина и Катца (1949), для аксона кальмара в состоянии покоя отношение коэффициентов проницаемости Рк: Рnа : РCl= 1 : 0,04 : 0,45.
30. Потенциал действия. Изменение проницаемости мембраны для ионов Na+ и К+ при генерировании потенциала действия.
Потенциал действия – это скачкообразное изменение постоянного мембранного потенциала с отрицательной поляризации на положительную и обратно.
Потенциал действия — это возбуждение клетки, быстрое колебание мембранного потенциала вследствие диффузии ионов в клетку и из клетки.
В основе потенциала действия лежат последовательно развивающиеся во времени изменения ионной проницаемости клеточной мембраны.
Как отмечалось, в состоянии покоя проницаемость мембраны для калия превышает ее проницаемость для натрия. Вследствие этого поток К'+ из цитоплазмы во внешний раствор превышает противоположно направленный поток Na+ Поэтому наружная сторона мембраны в покое имеет положительный потенциал по отношению к внутренней.
При действии на клетку раздражителя проницаемость мембраны для Na+ резко повышается и в конечном итоге становится примерно в 20 раз больше проницаемости для К'+. Поэтому поток Na+ из внешнего раствора в цитоплазму начинает превышать направленный наружу калиевый ток. Это приводит к изменению знака (реверсии) мембранного потенциала: внутреннее содержимое клетки становится заряженным положительно по отношению к ее наружной поверхности. Указанное изменение мембранного потенциала соответствует восходящей фазе потенциала действия (фаза деполяризации).
Повышение проницаемости мембраны для Na+ продолжается лишь очень короткое время. Вслед за этим проницаемость мембраны для Na+ вновь понижается, а для К+возрастает.
Процесс, ведущий к понижению ранее увеличенной натриевой проницаемости мембраны, назван натриевой инактивацией. В результате инактивации поток Na+ внутрь цитоплазмы резко ослабляется. Увеличение же калиевой проницаемости вызывает усиление потока К+ из цитоплазмы во внешний раствор. В итоге этих двух процессов и происходит реполяризация мембраны: внутреннее содержимое клетки вновь приобретает отрицательный заряд по отношению к наружному раствору. Этому изменению потенциала соответствует нисходящая фаза потенциала действия (фаза реполяризации).
Одним из важных аргументов в пользу натриевой теории происхождения потенциалов действия был факт тесной зависимости его амплитуды от концентрации Na+ во внешнем растворе. Опыты на гигантских нервных волокнах, перфузируемых изнутри солевыми растворами, позволили получить прямое подтверждение правильности натриевой теории. Установлено, что при замене аксоплазмы солевым раствором, богатым К+, мембрана волокна не только удерживает нормальный потенциал покоя, но в течение длительного времени сохраняет способность генерировать сотни тысяч потенциалов действия нормальной амплитуды. Если же К+ во внутриклеточном растворе частично заменить на Na+ и тем самым снизить градиент концентрации Nа+ между наружной средой и внутренним раствором, амплитуда потенциала действия резко понижается. При полной замене К+ на Na+ волокно утрачивает способность генерировать потенциалы действия.
Эти опыты не оставляют сомнения в том, что поверхностная мембрана действительно является местом возникновения потенциала как в покое, так и при возбуждении. Становится очевидным, что разность концентраций Nа+ и К+ внутри и вне волокна является источником электродвижущей силы, обусловливающей возникновение потенциала покоя и потенциала действия.
На рис. 6 показаны изменения натриевой и калиевой проницаемости мембраны во время генерации потенциала действия в гигантском аксоне кальмара. Аналогичные отношения имеют место в других нервных волокнах, телах нервных клеток, а также в скелетных мышечных волокнах позвоночных животных. В скелетных мышцах ракообразных животных и гладких мышцах позвоночных в генезе восходящей фазы потенциала действия ведущую роль играют ионы Са2+. В клетках миокарда начальный подъем потенциала действия связан с повышением проницаемости мембраны для Nа+, а плато потенциала действия обусловлено повышением проницаемости мембраны и для ионов Са2+
31. Потенциал-зависимые ионные каналы мембраны для К+ и Na+. Структура, особенности функционирования. Изменения проницаемости мембраны для К + и Na+ в различные фазы потенциала действия.
Состояние проницаемости клеточных мембран для различных веществ и, в частности, для минеральных ионов имеет исключительно важное значение в жизнедеятельности клетки и особенно в механизмах восприятия, преобразования, передачи сигналов от клетки к клетке и на внутриклеточные структуры.
Определяющую роль в состоянии проницаемости мембран клетки имеют их ионные каналы, которые формируются каналообразующими белками. Открытие и закрытие этих каналов могут контролироваться величиной разности потенциалов между наружной и внутренней поверхностями мембраны, множеством сигнальных молекул (гормонов, нейромедиаторов, сосудоактивных веществ) вторичными посредниками передачи внутриклеточных сигналов, минеральными ионами.
Ионный канал — несколько субъединиц (интегральных мембранных белков, содержащих трансмембранные сегменты, каждый из которых имеет а-спиральную конфигурацию), обеспечивающих перенос ионов через мембрану.
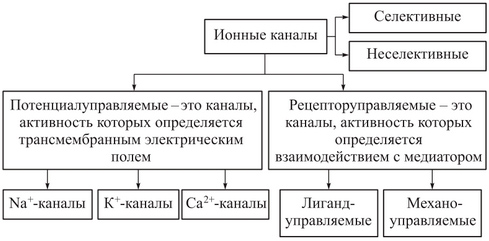
Рис. 1. Классификация ионных каналов
Современные представления о строении и функции ионных каналов стали возможными благодаря разработке методов регистрации электрических токов, протекающих через изолированный участок мембраны, содержащий одиночные ионные каналы, а также благодаря выделению и клонированию отдельных генов, контролирующих синтез белковых макромолекул, способных формировать ионные каналы. Это позволило искусственно модифицировать структуру таких молекул, встраивать их в мембраны клеток и изучать роль отдельных пептидных участков для выполнения функций каналов. Оказалось, что каналообразующие белковые молекулы всех ионных каналов имеют некоторые общие признаки строения и обычно представлены большими трансмембранными белками с молекулярными массами выше 250 кД.
Они состоят из нескольких субъединиц. Обычно важнейшие свойства каналов определяются их а-субъединнней. Эта субъединица принимает участие в формировании ионоселективной норы, сенсорного механизма трансмембранной разности потенциалов — ворот канала и имеет места связывания для экзогенных и эндогенных лигандов. Другие субъединицы, входящие в структуру ионных каналов, играют вспомогательную роль, модулирующую свойства каналов (рис. 2).
Каналообразующая белковая молекула представлена внемембранными аминокислотными петлями и внутримембранными спирализованными участками-доменами, образующими субъединицы ионных каналов. Белковая молекула сворачивается в плоскости мембраны так, что между контактирующими друг с другом доменами и формируется собственно ионный канал (см. рис. 2, внизу справа).
Каналообразующая молекула белка располагается в цитоплазматической мембране так, что ее трехмерная пространственная структура формирует устья канала, обращенные к наружной и внутренней сторонам мемораны, пору, заполненную водой, и «ворота». Последние образуются участком пептидной цепи, который может легко изменять свою конформацию и определять открытое или закрытое состояние канала. От размеров поры и ее заряда зависят селективность и проницаемость ионного канала. Проницаемость канала для данного иона определяется также его размерами, величиной заряда и гидратной оболочкой.
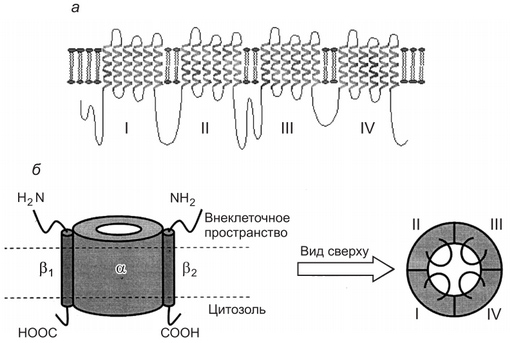
Рис. 2. Строение Na+ -ионного канала клеточной мембраны: а — двухмерное строение а-еубъединицы ионного канала клеточной .мембраны; б — слева — натриевый канал, состоящий из а-субъединнцы и двух Р-субъединнн (вид сбоку); справа — вил натриевого канала сверху. Цифрами I. II. III. IV отмечены домены а-субъединицы
Типы ионных каналов
Описано более 100 разновидностей ионных каналов, для классификации которых используют различные подходы. Один из них основан на учете различий в строении каналов и в механизмах функционирования. При этом ионные каналы можно разделить на несколько типов:
§ пассивные ионные каналы, или каналы покоя;
§ каналы щелевых контактов;
§ каналы, состояние которых (открытое или закрытое) контролируется влиянием на их воротный механизм механических факторов (механочувствительные каналы), разности потенциалов на мембране (потенциалзависимые каналы) или лигандов, связывающихся с каналообразующим белком на внешней или внутренней стороне мембраны (лигандзависимые каналы).
Натриевые каналы
В клетках организма широко представлены потенциалзависимые, потенциалнезависимые (лигандзависимые, механочувствительные, пассивные и др.) натриевые каналы.
Дата: 2019-04-22, просмотров: 1273.