Лекции
По химии для заочников
Лекция №1.
1. ВВЕДЕНИЕ
Химия – одна из фундаментальных естественных наук, изучающая химическую форму движения материи, наука о веществах и их превращениях. Познание химии необходимо для формирования научного мировоззрения. Глубокое понимание законов химии позволяет совершенствовать существующие и создавать новые процессы, машины, установки, приборы. Изучение химии играет важную роль в развитии образного мышления, в творческом росте будущих специалистов.
Основой подготовки бакалавров и инженеров по химии является общий курс химии, включающий в себя следующие разделы:
· Строение атома и молекулы;
· Химическая связь;
· Химическая термодинамика;
· Положения химической кинетики;
· Дисперсные системы;
· Основы электрохимии.
Целью курса общей химии является усвоение студентами знаний на основе углубленного изучения современных представлений в области химии, в частности по строению и взаимодействию веществ, с формированием у студентов целостного естественно-научного мировоззрения, поскольку без знания химии невозможно решение экологических, сырьевых и энергетических проблем, которые стоят перед человечеством.
Задача дисциплины – углублять и расширять современные представления в области химии.
В результате выполнения данной программы бакалавр и инженер
должен знать:
-основные химические системы и процессы;
-взаимосвязь между свойствами химических систем, природой веществ и их реакционной способностью;
-методы химической идентификации.
знать и уметь использовать:
-основные фундаментальные понятия химии;
-методы теоретического и экспериментального исследования в химии;
-основные понятия о химических системах;
-химическую термодинамику и химическую кинетику;
-данные о реакционноспособности веществ;
- результаты химической идентификации.
иметь навыки:
-применения знаний о строении вещества к описанию свойств химического элемента и его соединений;
- проведения термодинамического и кинетического анализа химической системы;
-составления уравнений реакций различных химических процессов (электролитическая диссоциация, гидролиз, электролиз, комплексообразование, оксилительно-восстановительные реакции и др.).
-решения различных расчетных задач, в частности по процессам в растворах, в случаях электрохимических и коррозионных явлений и др.
ОБЩИЕ РЕКОМЕНДАЦИИ СТУДЕНТУ ЗАОЧНОЙ ФОРМЫ ОБУЧЕНИЯ ПО РАБОТЕ НАД КУРСОМ ХИМИИ
Основной формой обучения студента заочной формы обучения является самостоятельная работа над учебным материалом, которая состоит из следующих элементов: изучение материала по учебникам, решение задач, самопроверка, выполнение контрольных работ. В помощь студентам заочной формы обучения организуются чтение лекций, практические занятия. Кроме того, студент может обращаться к преподавателю с вопросами для получения консультации. Указания студенту по текущей работе даются также в процессе проверки контрольных работ. Однако студент должен помнить, что только при систематической и упорной самостоятельной работе помощь преподавателей будет достаточно эффективной. Завершающим этапом изучения отдельных частей курса химии является сдача зачетов и экзаменов в соответствии с учебным планом.
ЛИТЕРАТУРА, используемая для изучения курса химии
1. Коровин Н.В. Общая химия.М.: Высшая школа, 2000г.
2. Глинка Н.Л. Общая химия. М.: Интеграл-пресс,2005 г.
3. Глинка Н.Л. Общая химия. М.: изд.Химия,1974 г.
4. Фролов В.В. Химия. М.:Высшая школа, 1985г.
5. Амирханова Н.А., Алябьев А.С., Беляева Л.С. и др. Сборник задач по общей химии./ Амирханова Н.А., Алябьев А.С., Беляева Л.С. ,Уфа: УГАТУ,2009 г.
6. Глинка Н.Л. Задачи и упражнения по общей химииМ.:Интеграл-пресс,2005 г.
7. Амирханова Н.Л., Беляева Л.С., Невьянцева Р.Р., Исламова Р.С. Практикум по химии для студентов заочного обучения : по курсу «Химия»/ Амирханова Н.Л., Беляева Л.С., Невьянцева Р.Р., Исламова Р.С. Уфа: УГАТУ,2005.
8.
Введение в предмет «Химия»
.
Свойство материи - движение. Формы движения материи изучаются разными естественными науками: физикой, химией, биологией.
Химия изучает химическую форму движения материи, т.е. превращение одних веществ в другие. При химических процессах происходит обмен атомами между различными веществами, перераспределение электронов между атомами, разрушение одних соединений и возникновение других. В результате химических процессов возникают новые вещества с новыми химическими и физическими свойствами. Таким образом, химия – это наука о веществах и законах их превращений.
Строение атомов
Понятие «атом» в переводе от греческого «неделимый возникло и оформилось в работах древнегреческих философов в 500-200 гг. до н.э. Левкипп утверждал, что мир состоит из мельчайших частиц и пустоты. Демокрит назвал эти частицы атомами (неделимый) и считал, что они вечно существуют и способны перекатываться.
Затем в течение почти 20 столетий учение об атомном строении окружающего мира не получило развития.
В начале XIX века были открыты основные законы химии.
Закон постоянства состава. Французский химик Пруст (1801-1808 г.) сформулировал, что каждое химическое соединение всегда имеет один и тот же состав независимо от способа получения. Закон сыграл большую роль и имеет большое значение, но 1912-13 гг. Н.С.Курнаков установил, что существуют соединения переменного состава, которые он предложил назвать бертоллидами.
Закон эквивалентов. В результате работ И.Рихтера (1792-1800) был открыт закон эквивалентов: все вещества реагируют в эквивалентных отношениях.
Закон кратных отношений. Закон, предложенный Дж.Дальтоном (1803) гласит, если 2 элемента образуют между собой несколько соединений, то на одну и ту же массу одного из них приходится такие массы другого, которые относятся между собой как простые целые числа.
В начале XIX века Дж. Дальтон основываясь на выше приведенных законах химии возродил атомистическую теорию. Дальтон установил, что атомы одного и того же химического элемента имеют одинаковые свойства, а разным элементам соответствуют разные атомы. Были введены понятия атомная масса, относительные значения которых были определены для ряда химических элементов. Однако атом по-прежнему считался неделимой частицей.
В конце XIX и в начале XX века появились экспериментальные данные доказательства сложной структуры атома. Это:
явление фотоэффекта (испускание металлом электронов под воздействием падающего на него света);
катодные лучи – поток отрицательно заряженных частиц (электронов) в вакуумной трубке, содержащей катод и анод;
рентгеновские лучи – электромагнитное излучение;
радиоактивность – явление самопроизвольного превращения одного химического элемента в другого, сопровождающееся испусканием электронов.
Таким образом, было установлено, что атом состоит из отрицательно и положительно заряженных частиц, сильно взаимодействующих между собой. Возник вопрос, как же устроен атом?
Название частицы
Символ
Заряд
Масса покоя
Атом электронейтральная частица. Положительный заряд ядра нейтрализуется суммарным отрицательным зарядом электронов, которые движутся вокруг ядра. Число электронов в ядре равно числу протонов и соответственно заряду ядра.
Главное квантовое число, n
Общий запас энергии электрона в атоме определяет главное квантовое число. Оно может принимать целые значения от 1 до бесконечности.
Наименьшей энергией обладает электрон с n=1. С увеличением значения главного квантового числа n энергия электрона возрастает. Электроны, которые характеризуются одним и тем же значением главного квантового числа, имеют электронные облака примерно одного размера и близкие по значению энергии. Поэтому можно сказать, что электроны в атоме образуют электронные слои или энергетические уровни, которым соответствует определенное значение n. Эти уровни обозначаются цифрами в соответствии со значением главного квантового числа или буквами латинского алфавита (табл.1.2):
Таблица 1.2. Энергетические уровни
| n | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Буквенные обозначения уровня | К | L | M | N | O | P | Q |
Если, например n=4, то электрон находится на четвертом энергетическом уровне, или на N уровне. Электроны внешнего энергетического уровня обладают максимальным запасом энергии и наименьшей связью с ядром. Максимальное количество электронов, которое может находиться на том или ином уровне, определяется по формуле: N=2n2, где N – максимальное число электронов на уровне; n – номер энергетического уровня.
На внешнем энергетическом уровне может находиться не более восьми электронов, а на первом не более двух.
Энергетическая диаграмма АО
| - - - 4p - - - - -3d - 4s - - - 3p -3s - - - 2p -2s - 1s |
Рис.1.4. Энергетическая диаграмма АО
Пример1. Электронная конфигурация атома натрия.
1s22s22p63s1.
| ↑ |
3s1
| ↑↓ | ↑↓ | ↑↓ |
2p6
Последний электрон натрия характеризуется следующими квантовыми числами:
n=3
l=0
m=0
ms=+1/2
Атомные радиусы
В расчетах используется эффективный или кажущийся радиус, т.к. атомы не имеют строго определенных границ. Это обусловлено волновой природой электронов. Чем больше радиус, тем слабее удерживаются внешние электроны в атомах и, наоборот, с уменьшением радиуса электроны больше притягиваются к ядру.
Лекция №2
Химическая связь
Вопросы:
1. Типы химической связи;
2. Механизм образования ковалентной связи;
3. Свойства ковалентной связи: насыщаемость, гибридизация и т.д.
4. Кратность связи: двойная, тройная связь
5. σ, π,δ – связи
6. Пространственная конфигурация молекул
7. Линейные, угловые, пирамидальные, тетраэдрические молекулы
8. Энергия и длина связи
9. Полярная связь
10. Дипольный момент связи молекул
11. Гибридизация: sp1 ,sp2, sp3
12. Метод валентных связей и метод молекулярных орбиталей
13. Ионная связь
14. Межмолекулярные взаимодействия
15. Разновидности ковалентной связи: водородная донорно-акцепторная
16. Комплексные соединения
Химическая связь представляет собой взаимодействие между положительно заряженными ядрами и отрицательно заряженными электронами, а также электронов друг с другом. Существует 5 типов химической связи:
1. ковалентная
2. ионная
3. металлическая
4. водородная
5. межмолекулярные взаимодействия (вандер-ваальсовы взаимодействия)
Существуют различные теории, описывающие образование химической связи:
1. Метод валентных связей (ВС)
2. Метод молекулярных орбиталей (МО)
3. Электростатическая теория кристаллического поля
Химическая связь
↓ ↓
 |
| Ковалентная | ионная | металлическая |  водородная водородная
| Силы Ван-дер-Ваальса |
↓
| Неполярная |
| полярная |
Рис. 3.1. Виды химической связи
Ковалентная связь
Связь, образованная путем обобществления электронной пары.
При рассмотрении ковалентной связи, нужно обратиться к электронной теории валентности Дж. Льюиса и В.Коссель,1916 г., которая гласит, что при образовании химической связи атомы стремятся приобрести электронную конфигурацию благородного газа за счет:
· потери или приобретения электронов;
· обобществления электронов
· Правило октета. Каждому атому элемента второго периода требуется для создания устойчивой электронной конфигурации восемь электронов.
Рассмотрим для примера образование ковалентной связи в молекуле водорода. При сближении атомов водорода с антипараллельными спинами происходит проникновение их электронных облаков друг в друга, которое называется перекрыванием электронных облаков (Рис.3.2).
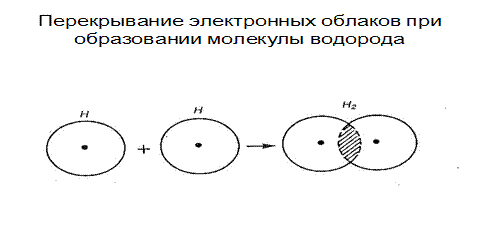
Рис. 3.2. Перекрывание электронных облаков при образовании молекулы водорода
Электронная плотность между ядрами возрастает. Ядра притягиваются друг к другу. Вследствие этого снижается энергия системы (Рис. 3.2). При приближении атомов с параллельными спинами энергия возрастает и не происходит образования молекул.
Таким образом, ковалентная связь образуется 2-мя электронами с противоположными спинами, за счет перекрывания электронных орбиталей, происходит обобществление электронов.
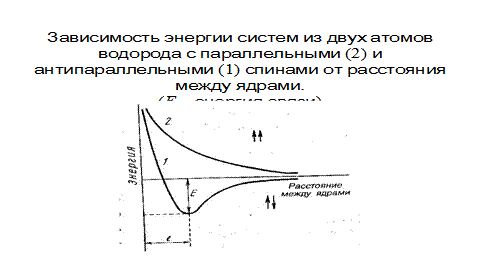
Рис. 3.3. Зависимость энергии систем из двух атомов водорода с параллельными (2) и антипараллельными (1) спинами от расстояния между ядрами. (Е – энергия связи)
Однако, при очень большом сближении атомов возрастает отталкивание ядер. Поэтому имеется оптимальное расстояние между ядрами я (длина связи l св) при котором система имеет минимальную энергию. При таком состоянии выделяется энергия
Метод ВС базируется на следующих основных положениях:
· химическая связь образуется как результата перекрывания АО с образованием электронных пар
· атомы, вступающие в химическую связь, обмениваются между собой электронами, которые образуют связывающие пары. Энергия обмена электронами между атомами вносит основной вклад в энергию химической связи. Дополнительный вклад вносит кулоновские силы взаимодействия частиц.
· Химическая связь в соответствии с принципом Паули лишь при взаимодействии электронов с антипараллельными спинами.
· Характеристика химической связи (энергия, длина, полярность) определяется типом перекрывания АО.
Донорно-акцепторный механизм образования ковалентной связи
Обменный механизм метода ВС не может объяснить образования химических связей в некоторых соединениях. Например, у иона аммония NH4+ образует 4 ковалентные связи с водородом, хотя у азота всего 3 неспаренных электрона.
4-ая ковалентная связь появляется по донорно-акцепторному механизму, согласно которому общая электронная пара появляется за счет неподеленной пары электронов одного атома (донора) и вакантной орбитали (акцептора).
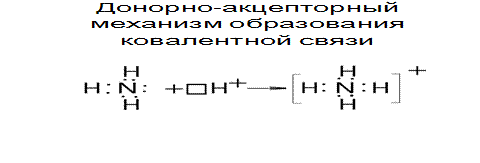
Рис.3.4. Донорно-акцепторный механизм образования ковалентной связи
Таким образом, в ионе аммония азот проявляет валентность, равную 4.
Четвертая ковалентная связь, образованная по донорно-акцепторному механизму, характеризуется теми же параметрами что и остальные три ковалентные связи, т.е. в ионе аммония все ковалентные связи равноценны.
Особенностями ковалентной связи являются направленность и насыщаемость.
Так как атомные орбитали пространственно ориентированы, то перекрывание электронных облаков происходит по определенным направлениям, что и обусловливает направленность ковалентной связи (стремление атомов к образованию наиболее прочной связи за счет возможно большей электронной плотности между ядрами). Количественно направленность выражается в виде валентных углов между направлениями химической связи в молекулах.
Насыщаемость ковалентной связи вызывается ограничением числа электронов, находящихся на внешних оболочках, которые могут участвовать в образовании ковалентной связи. Число связей обычно в пределах от 1 до 6. Общее число валентных орбиталей в атоме (которые могут быть использованы для образования химических связей), определяет максимально возможную валентность элемента. Число уже использованных для этого орбиталей определяет валентность элемента в данном соединении.
Полярность ковалентной связи.
Если ковалентная связь образована одинаковыми атомами, например, Н-Н, О=О, то обобществленные электроны равномерно распределены между ними. Такая связь называется ковалентной неполярной связью. Если же один из атомов сильнее притягивает электроны, то электронная пара смещается в сторону этого атома. В этом случае возникает полярная ковалентная связь. Критерием способности атома притягивать электрон может служить электроотрицательность. Чем выше ЭО у атома, тем более вероятно смещение электронной пары в сторону данного атома. Поэтому разность электроотрицательности атомов характеризует полярность связи.
Вследствие смещения электронной пары к одному из ядер повышается плотность отрицательного заряда у данного атома и соответственноатом получает заряд, называемый эффективным зарядом атома δ-.У второго атома повышается плотность положительного заряда δ+. Вследствие этого возникает диполь, представляющий собой электрически нейтральную систему с двумя одинаковыми по величине положительным и отрицательным зарядами, находящимися на определенном расстоянии (длина диполя) lд друг от друга. Мерой полярности связи служит электрический момент диполя μсв, равный произведению эффективного заряда на длину диполя.
μсв =δ lд
Электрический момент диполя имеет единицу измерения кулон на метр (Кл м). Как видно из таблицы 1 , электрический момент диполя растет с увеличением разности ЭО.
Таблица 1. Электрический момент диполя химической связи в молекулах.
Ионная химическая связь
Ионная химическая связь представляет собой электростатическое взаимодействие отрицательно и положительно заряженных ионов в химическом соединении. Такая связь возникает между атомами с лишь при случае большой разности ЭО атомов, например, между катионами s-металлов первой и второй групп периодической системы и анионами неметаллов V и VI групп (NaF, KCl).
Для ионной связи не характерна направленность, она не насыщена. Для молекул характерна ионная кристаллическая решетка.
Водородная связь
Металлическая связь
Металлическая связь –связь между положительными ионами в кристаллах металлов, осуществляемая за счет притяжения электронов, свободно перемещающихся по кристаллу.
У большинства металлов на внешней электронной оболочке имеется значительное число вакантных орбиталей и малое число электронов. Поэтому энергетически более выгодно, чтобы электроны не были локализованы, а принадлежали всему металлу. В результате свободного перемещения электронов, одни атомы будут терять свои электроны, переходя в положительно заряженные ионы, а образующиеся ионы, могут принимать электроны.
В узлах решетки металла находятся положительно заряженные ионы, между ионами не локализованные свободные электроны.
Характерными особенностями металлической связи являются ее ненаправленность и меньшая прочность по сравнению с ковалентной.
Комплексные соединения
Сложные соединения, у которых имеются ковалентные связи, образованные по донорно-акцепторному механизму, получили название комплексных соединений.
CuSO4 +4NH3 =[Cu(NH3)4 ]SO4
Комплексные соединения состоят из двух сфер: внутренней и внешней. В приведенном выше примере внешней сферой является SO42-. Внутренняя сфера, называемая комплексом, включает центральный атом, называемый комплексообразователем, координирует вокруг себя ионы и молекулы, называемые лигандами. При записи внутреннюю сферу заключают в квадратные скобки. Число лигандов, координируемых комплексообразователем называется координационным числом. В зависимости от заряда различают анионные и катионные комплексы.
Комплексообразователями служат атомы или ионы, имеющие вакантные орбитали. Наиболее распространенные комплексообразователи – это ионы d-элементов.
Лиганды. К числу лигандов относятся простые анионы
(CN-, Cl-), молекулы, имеющие неподеленные электронные пары.
Связь между внешней и внутренней сферой ионная, между комплексообразователем и лигандами – донорно-акцепторная.
Диссоциация комплексов
 К4[Fe(CN)6 ] 4К+ +[ Fe(CN)6 ]-3
К4[Fe(CN)6 ] 4К+ +[ Fe(CN)6 ]-3
Типы комплексных соединений
· Катионные – [Cu(NH3)4 ]SO4
· Анионные – К4[Fe(CN)6 ]
· Нейтральные – [Pt(NH 3)2 Cl7 ]
Лекция №3
Химическая термодинамика
Химическая термодинамика изучает энергетику химических процессов, направление и пределы их самопроизвольного протекания, состояние химического равновесия. Каждый химический процесс сопровождается тепловым эффектом, реакции протекающие с выделением тепла называются экзотермическими, с поглощением тепла – эндотермическими. Уравнения химических реакций в которых указан тепловой эффект называются термохимическими.
Термодинамическая система. Предмет исследования в термодинамике называется термодинамической системой. Это любой макроскопический материальный объект, выделенный из внешней среды с помощью реально существующей или воображаемой поверхности раздела. Системой может быть образец вещества, тепловая машина, электромагнитное поле в ограниченном пространстве.
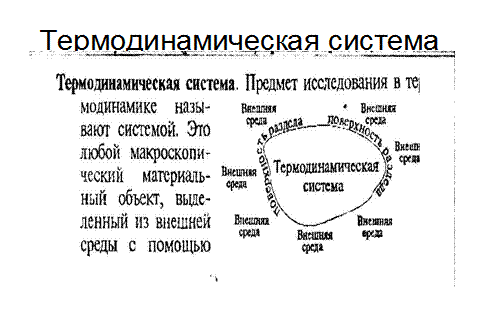
Рис. 5.1. Термодинамическая система
Фаза – совокупность всех однородных частей системы, одинаковых по физическим и химическим свойствам, ограниченных от других частей системы поверхностью раздела.
Гомогенная система – система состоящая из одной фазы.
Гетерогенная система – система состоящая из 2-х или более фаз. Система неоднородна.
Изолированные системы – это системы, у которых через поверхность раздела не может происходить обмен с внешней средой ни энергией, ни веществом.
Неизолированные системы могут быть закрытыми и открытыми.
Закрытые изолированные такие системы, у которых через поверхность раздела может происходить обмен с внешней средой только энергией. Веществом системы не обмениваются.
Открытые системы через поверхность раздела может происходить обмен с внешней средой и энергией веществом.
Закон Гесса
Тепловой эффект реакции (Энтальпия реакции) при
V-const, р-const не зависит от пути процесса (от числа промежуточных стадий), а определяется только начальным и конечным состоянием системы.

Рис.5.2. Закон Гесса
Следствие из закона Гесса
Тепловой эффект процесса (энтальпия химического процесса) равен разности между суммой энтальпий образования конечных продуктов и суммой энтальпий образования исходных веществ.
∆Н0реакции =∑∆Н0 (конечных продуктов) - ∑∆Н0 (исх. веществ)

Рис.5.3. Следствие из закона Гесса
Тепловой эффект химических реакций. Тепловой эффект при постоянном давлении будем ∑∆Н0 (Если исходные вещества и продукты реакции находятся в стандартном состоянии, то тепловой эффект называется стандартной энтальпией реакции и обозначается ∆Н0. Если в результате реакции теплота выделяется, т.е. энтальпия системы понижается (∆Н0 <0), то реакция называется экзотермической. Реакция, протекающая с поглощением тепла, т.е. с повышением энтальпии (∆Н0 >0), называется эндотермической.
Тепловой эффект зависит (хотя и относительно мало) от температуры, поэтому в индексе указывается температура ∆Н0т ∆Н0298
Термохимические уравнения. Раздел химии, изучающий тепловые эффекты химических реакций и фазовых превращений получил название термохимии. В термохимических уравнениях указывают тепловые эффекты реакций, записывают рядом с уравнением. Обычно тепловой эффект относят к одному молю вещества и указывают агрегатное состояние вещества. С термохимическими уравнениями можно оперировать как с алгебраическими уравнениями.

Рис.5.4. Термохимические уравнения
Задача:
S+NO2 →SO2 +1|2 N2 ∆ H -?
1. 1|2 N2 + O2 →NO2 ∆Н0=34 кДж/моль
2. S+O2 →SO2 ∆Н0=- 298 кДж/моль
Чтобы вычислить ∆ H , от уравнения (2) отнимаем уравнение (1),
S+O\2 - 1|2 N2 - O\2 = SO2 - NO2
S+NO2 →SO2 +1|2 N2 ∆H =-298-34=-332.
Энтальпия (теплота) образования. Тепловой эффект образования 1 моль вещества из простых веществ, устойчивых при 298 К и давлении 100кПА, называют энтальпией образования и обозначают ∆Н0обр,В или ∆Н0f,В для вещества В. Энтальпию образования простых веществ принимают равной нулю.
Лекция №6
Реакции нулевого порядка
СаСО3(тв) → СаО (тв) +СО2 (г)
n=0
Vпр= kпр const =k.
Скорость данной гетерогенной реакции не зависит от концентрации, такие реакции называются реакциями нулевого порядка.
Реакции первого порядка
Скорость реакции первого порядка характеризуется кинетическим уравнением
Vпр= kпр c
Vпр= -dc|dt
-dc|dt =kс -dc|с =kdt lnc=-kt +lnc0 ==lnc0 - kt
Концентрация реагентов и скорость реакции первого порядка изменяется по экспоненциальному закону.
Реакции второго порядка
n =2
Н2(г) + J2(г)↔2 НJ(г)
Vпр= kпр c2
Реакции третьего порядка
2NO+O2→NO2
Vпр= kпр c2 *с зависимость скорости реакции от температуры
Правило Вант-Гоффа. Повышение температуры ускоряет большинство химических реакций. Согласно правилу Вант-Гоффа при повышении температуры на 10 градусов скорость многих реакций увеличивается в 2-4 раза
V 2 = V 1 γ (Т2-Т1)/10, где V2, V1 – скорости реакций при температурах Т2 и Т1, γ – коэффициент, значение которого для эндотермической реакции выше, чем для экзотермической реакции
( γ энд >γ экз). Для многих реакций γ лежит в пределах 2-4.
Пример. Т2=90º
Т1=20º γ=3 V90=V20 390-20|10= V20 37
Уравнение Аррениуса. В 1889 г шведский ученый С. Аррениус на основании экспериментов вывел уравнение, которое носит его имя.
k = k 0 e ( E a / RT ) , где k – константа скорости реакции; k0 – предэкспоненциальный множитель; e – основание натурального логарифма; Еа – постоянная, называемая энергией активации, определяемая природой реакции. Значения Еа-для химических реакций лежит в пределах 40-400 кДж/моль.
Энергия активации
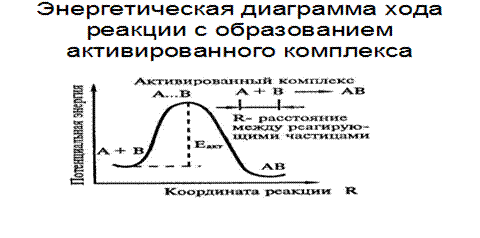
Рис.6.4. Энергетическая диаграмма реакции с образованием активированного комплекса
Каталитические реакции. Катализаторы – это вещества, изменяющие скорость реакции, но сами в реакцию не вступают, т.е. в конце раекции они остаются целыми. Изменение скорости реакции под действием катализаторов называется катализом. Вещества увеличивающие скорость реакции называются катализаторами , уменьшающие ингибиторами.
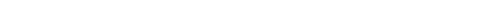
Рис. 6.5. Путь реакции
Таким образом, при участии катализатора энергия реакции уменьшается. Катализ может быть гомогенным и гетерогенным. Гомогенный катализ при котором все находится в одной фазе, гетерогенный катализ когда реагирующие вещества находятся в разных фазах.
Химическое равновесие
аА+ вВ ↔ сС+ dD - реакция обратима
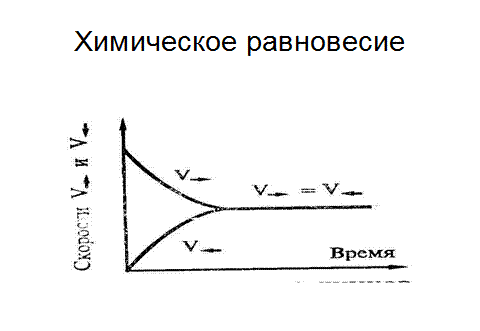
Рис. 6.6. Химическое равновесие
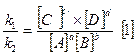 - закон действующих масс
- закон действующих масс
lnКравн = 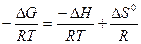
Принцип Ле-Шателье. Если на систему, находящуюся в равновесии оказать внешнее воздействие, то равновесие смещается в таком направлении которое ослабляет внешнее воздействие:
· при увеличении концентрации исходных веществ равновесие смещается в сторону образования продуктов реакции.
· при увеличении давления всей системы равновесие смещается в сторону меньшего числа молей газа.
· при увеличении продуктов реакции равновесие смещается в сторону обратной реакции, т.е. исходных веществ.
· для экзотермических процессов для смещения равновесия в сторону прямой реакции необходимо понизить температуру.
· для эндотермических реакций для смещения равновесия в сторону прямой реакции необходимо повысить температуру.
Примеры.
I. Mg CO3(т) ↔MgO(т) + СО2 (г)
∆ H0 =117,4 кДж/моль
Написать выражение для:
1) Vпр реакции
2) Vобр. реакции
1) Vпр реакции =kпр [1]
2) Vобр реакции =kобр [СО2]
Кравн = 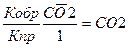
При повышении температуры равновесие смещается вправо
II. Н2 (г) + ½ О2 (г)↔ Н2О(ж)
Q=285,5 кДж/моль
∆ H0 =-285,5 кДж/моль
1) Vпр реакции =kпр [Н2]*[О2]1/2
2) Vобр реакции =kобр [Н2О]
Кравн = 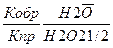
К= 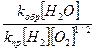
· Увеличиваем концентрацию в 2 раза – во сколько раз увеличится скорость?
Vпр реакции =kпр [2]*[2]1/2 =2*1,4=2,8
· Увеличиваем объем всей системы в 3 раза, концентрация уменьшается в 3 раза
Vпр реакции =kпр [3]*[3]1/2 =3*1,73=5,2 т.е. скорость уменьшится в 5,2 раза
· Повышаем температуру, равновесие смещается в обратную сторону.
N2(г) + Н2 (г) ↔2NH3 + Q ∆ H< 0
Рис.6.7. Зависимость скорости реакции от давления
Лекция №7
Дисперсные системы
Дисперсные системы состоят из дисперсной фазы и дисперсионной среды. В зависимости от размеров дисперсной фазы дисперсные системы делят на группы:
1)взвеси (суспензии, эмульсии), у которых частицы имеют размер 1000 нм(10-6 м) и более;
2)коллоидные системы, размер частиц которых лежит в пределах от 1 до 500 нм (10-9 до5*10-7 м).
Дисперсные системы также классифицируются по агрегатным состояниям дисперсной фазы и дисперсной среды.
Таблица 7. Типы дисперсных систем
| Тип дисперсной системы | Фазовое состояние | Примеры | |
| Дисперсионной среды | Дисперсной фазы | ||
| Аэрозоль | Газ | Жидкость | Туман и облака |
| Аэрозоль | Газ | Твердая | Дым и пыль |
| Пена | Жидкая | Газ | Взбитые сливки, мыльная пена |
| Эмульсия | Жидкая | Жидкая | Молоко, майонез |
| Золь | Жидкая | Твердая | Краска |
| Твердая эмульсия | Твердая | Жидкая | Масло |
| Гель | Твердая | Жидкая | Желе, агар-агар |
| Твердая пена | Твердая | Газ | Лава, пемза |
| Твердая эмульсия | Твердая | Жидкость | Жемчуг, опал |
| Твердая золь | Твердая | Твердая | Некоторые драгоценные камни (бриллиант, рубин) |
Коллоидные растворы. Коллоидное состояние характерно для многих веществ, если их частицы имеют размер от 1 до 500нм. Суммарная поверхность этих частиц громадна. Если предположить, что частица имеет форму шара диаметром 10 нм, то при общем объеме этих частиц 1 см3 они будут иметь площадь поверхности 100м2. Поверхность коллоидных частиц обладают способностью адсорбировать те или иные частицы, в том числе ионы из раствора. Характерной особенностью коллоидных частиц является наличие заряда на их поверхности. Коллоидная частица имеет сложное строение. Она включает в себя ядро, адсорбированные ионы, противоионы и растворитель.
Существуют лиофильные (гидрофильные) коллоиды, в которых растворитель взаимодействует с ядрами частиц, и лиофобные (гидрофобные) коллоиды, в которых растворитель не не взаимодействует с ядром частиц.
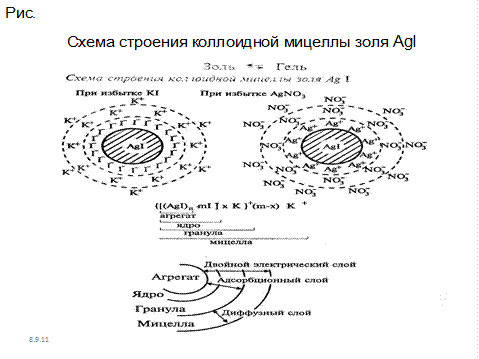
Рис.7.1. Схема строения коллоидной мицеллы золя AgI
Как видно из рисунка, ядро состоит из электронейтрального агрегата частицы с адсорбированными ионами элементов, входящих в состав ядра (в данном случае Ag+ и I-. Кроме этого коллоидная частица имеет противоионы и молекулы растворителя. Вокруг частиц находится диффузный слой ионов, заряд которых равен заряду коллоидной частицы. Коллоидная частица и диффузный слой образуют электронейтральную мицеллу.
Оптические свойства коллоидных растворов. Если рассматривать путь светового луча, проходящего через совершенно прозрачный коллоидный раствор, сбоку на темном фоне, то он становится видимым. Этот оптический эффект называется конусом Тиндаля (рис. 33/ )
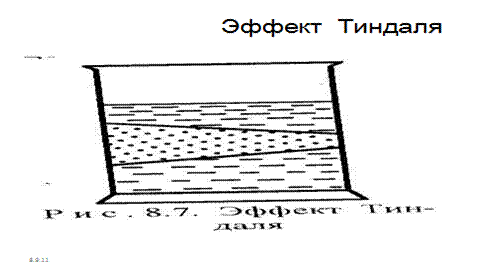
Рис. 7.2. Эффект Тиндаля.
Эффект Тиндаля можно наблюдать в темноте при прохождении луча света через запыленное и прокуренное помещение.
Кинетические свойства коллоидных частиц. Для коллоидных растворов характерно движение частиц дисперсной фазы, вызываемое беспорядочными ударами со стороны молекул среды, находящихся в тепловом движении. Его впервые наблюдал шотландский ботаник Броун. Именно поэтому движение частиц дисперсной фазы в дисперсионной среде называется броуновским.
Изучение броуновского движения показало, что кинетические свойства коллоидных частиц близки к кинетическим свойствам истинных растворов. Однако скороти перемещения частиц в коллоидных растворах меньше, чем в истинных.
Электрические свойства коллоидных растворов. В 1909 г. профессор Московского университета Ф.Ф. Рейсс наблюдал воздействие постоянного электрического тока на диспергированную в воде глину и описал электрические свойства коллоидных растворов. Частицы дисперсной фазы (глина) перемещалась к аноду, где вследствие их большого скопления наблюдалось помутнение раствора. Частицы дисперсионной среды (воды) перемещались к катоду, где наблюдалось повышение уровня прозрачной жидкости (рис.34).
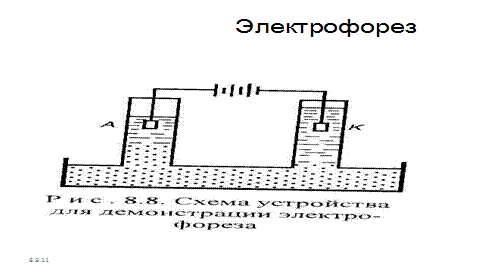
Рис. 7.3. Схема устройства для демонстрации электрофореза
Движение частиц дисперсной фазы к одному из электродов при пропускании через золь постоянного тока получило название электрофореза, а движение частиц дисперсионной среды – электроосмоса .
Электрофорез и электроосмос обусловлены наличием разноименного заряда у частиц дисперсной фазы и дисперсионной среды. На границе раздела возникает двойной электрический слой ( рис ), состоящий из тонкой адсорбционной части и протяженной диффузной части. Между фазами возникает разность потенциалов, называемая электротермодинамическим потенциалом (фи). Часть скачка потенциала, обусловленная диффузным слоем, называется электрокинетическим или ξ (дзета)- потенциалом (рис.7.4).

Рис. 7.4. Двойной электрический слой
Ионное произведение воды.
[H+][OH-] =10-14
[H+]=[OH-] =10-7 моль – нейтральная среда
Диссоциация воды.
H 2 O жидк .↔ Н+раств.+ОН-раств.
КН2О= 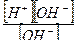
[Н2О]= 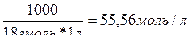
Водородный показатель.
рН=- lga н +
рН =-lg[H+]
| Нейтральный раствор | ан+=аон-=10-7 рН=7 |
| Кислый раствор | ан+>аон-=10-7 рН<7 |
| Щелочной раствор | ан+<аон-=10-7 рН+>7 |
Определение рН.
· с помощью индикаторов
· потенциометрическим методом
Индикаторы – слабые кислоты и основания, окраска которых различна в различных средах.
Hind ↔ H + + ind -
Kp = 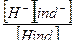
Таблица 9- Значение рН различных биожидкостей и тканей организма человека.
| Биожидкость | рН (в норме) |
| Сыворотка крови | 1,4±0,05 |
| Слюна | 6,35-6,85 |
| Моча | 4,8-7,5 |
| Влага глаза | 7,4±0,1 |
Лекция №8,9
Основы электрохимии
Окислительно-восстановительные реакции.
Валентность атома определяется числом электронов, идущих на образование общих электронных пар, при этом не учитывается полярность образующихся связей.
Степень окисления элемента - это условный заряд атома в молекуле, который определяется исходя из предположения, что молекула состоит из ионов.
· Степень окисления простых веществ равна нулю.
· Степень окисления кислорода в соединениях равна -2.
· Степень окисления водорода равна +1.
Пример:
Определить степень окисления углерода n в следующих соединениях:
х
СН4 х + 4(+1)=0; х = -4
х
СН3ОН х + 3(+1)+(-2)+1 = 0; х = -2
х
НСООН (+1)+х +2(-2) +1 =0; х = +2
х
СО2 х +2(-2) = 0; х = +4
Валентность углерода во всех этих соединениях равна 4.
К +1Мn +7О4-2 - молекула в целом электронейтральна.
К2 +1 Сr2 +6 О7-2
Реакции, которые сопровождается изменением валентности называется окислительно-восстановительными реакциями.
5Na2 S2O3 + 2 KMnO4 →5Na2SO4 +2 MnSO4 + K2SO4 + 3H2O
(MnO4)- +5e- +8H+ →Mn+2 +4H2O
( SO3)-2 -2e- + H2O→( O4)-2 +H
KClO3
Лекции
По химии для заочников
Лекция №1.
1. ВВЕДЕНИЕ
Химия – одна из фундаментальных естественных наук, изучающая химическую форму движения материи, наука о веществах и их превращениях. Познание химии необходимо для формирования научного мировоззрения. Глубокое понимание законов химии позволяет совершенствовать существующие и создавать новые процессы, машины, установки, приборы. Изучение химии играет важную роль в развитии образного мышления, в творческом росте будущих специалистов.
Основой подготовки бакалавров и инженеров по химии является общий курс химии, включающий в себя следующие разделы:
· Строение атома и молекулы;
· Химическая связь;
· Химическая термодинамика;
· Положения химической кинетики;
· Дисперсные системы;
· Основы электрохимии.
Целью курса общей химии является усвоение студентами знаний на основе углубленного изучения современных представлений в области химии, в частности по строению и взаимодействию веществ, с формированием у студентов целостного естественно-научного мировоззрения, поскольку без знания химии невозможно решение экологических, сырьевых и энергетических проблем, которые стоят перед человечеством.
Задача дисциплины – углублять и расширять современные представления в области химии.
В результате выполнения данной программы бакалавр и инженер
должен знать:
-основные химические системы и процессы;
-взаимосвязь между свойствами химических систем, природой веществ и их реакционной способностью;
-методы химической идентификации.
знать и уметь использовать:
-основные фундаментальные понятия химии;
-методы теоретического и экспериментального исследования в химии;
-основные понятия о химических системах;
-химическую термодинамику и химическую кинетику;
-данные о реакционноспособности веществ;
- результаты химической идентификации.
иметь навыки:
-применения знаний о строении вещества к описанию свойств химического элемента и его соединений;
- проведения термодинамического и кинетического анализа химической системы;
-составления уравнений реакций различных химических процессов (электролитическая диссоциация, гидролиз, электролиз, комплексообразование, оксилительно-восстановительные реакции и др.).
-решения различных расчетных задач, в частности по процессам в растворах, в случаях электрохимических и коррозионных явлений и др.
ОБЩИЕ РЕКОМЕНДАЦИИ СТУДЕНТУ ЗАОЧНОЙ ФОРМЫ ОБУЧЕНИЯ ПО РАБОТЕ НАД КУРСОМ ХИМИИ
Основной формой обучения студента заочной формы обучения является самостоятельная работа над учебным материалом, которая состоит из следующих элементов: изучение материала по учебникам, решение задач, самопроверка, выполнение контрольных работ. В помощь студентам заочной формы обучения организуются чтение лекций, практические занятия. Кроме того, студент может обращаться к преподавателю с вопросами для получения консультации. Указания студенту по текущей работе даются также в процессе проверки контрольных работ. Однако студент должен помнить, что только при систематической и упорной самостоятельной работе помощь преподавателей будет достаточно эффективной. Завершающим этапом изучения отдельных частей курса химии является сдача зачетов и экзаменов в соответствии с учебным планом.
ЛИТЕРАТУРА, используемая для изучения курса химии
1. Коровин Н.В. Общая химия.М.: Высшая школа, 2000г.
2. Глинка Н.Л. Общая химия. М.: Интеграл-пресс,2005 г.
3. Глинка Н.Л. Общая химия. М.: изд.Химия,1974 г.
4. Фролов В.В. Химия. М.:Высшая школа, 1985г.
5. Амирханова Н.А., Алябьев А.С., Беляева Л.С. и др. Сборник задач по общей химии./ Амирханова Н.А., Алябьев А.С., Беляева Л.С. ,Уфа: УГАТУ,2009 г.
6. Глинка Н.Л. Задачи и упражнения по общей химииМ.:Интеграл-пресс,2005 г.
7. Амирханова Н.Л., Беляева Л.С., Невьянцева Р.Р., Исламова Р.С. Практикум по химии для студентов заочного обучения : по курсу «Химия»/ Амирханова Н.Л., Беляева Л.С., Невьянцева Р.Р., Исламова Р.С. Уфа: УГАТУ,2005.
8.
Электронное строение атома и систематика химических элементов
1.3.1. Основные сведения о строении атома, модели атома (Морозова, Резерфорда, Бора)
1.3.2. Квантово-механические представления и их применение к строению атома.
1.3.3. Дискретность изменения внутренней энергии атома. Выводы из теории строения атома водорода. Свойства электрона (волновые и корпускулярные). Атомные спектры и их значение в развитии квантовой механики.
1.3.4. Волновые свойства электронов. Понятие о волновой функции и описание состояния электрона в атоме. Принцип неопределенности.
1.3.5. Квантовые числа и их физический смысл, структуры электронных оболочек, многоэлектронных оболочек и принцип периодичности при их формировании.
1.3.6. Периодическая система Д.И.Менделеева. Структура системы (короткая, длиннопериодичная). Периодичность свойств элементов – атомных и ионных радиусов, потенциалов ионизации, сродства к электрону, электроотрицательностей, окислительно-восстановительные свойства элементов. Периодическая система как выражение периодического закона.
Введение в предмет «Химия»
.
Свойство материи - движение. Формы движения материи изучаются разными естественными науками: физикой, химией, биологией.
Химия изучает химическую форму движения материи, т.е. превращение одних веществ в другие. При химических процессах происходит обмен атомами между различными веществами, перераспределение электронов между атомами, разрушение одних соединений и возникновение других. В результате химических процессов возникают новые вещества с новыми химическими и физическими свойствами. Таким образом, химия – это наука о веществах и законах их превращений.
Дата: 2018-12-28, просмотров: 415.