Известно, что в обычных условиях многие окислительно-восстановительные реакции, которые используются микроорганизмами в качестве энергетического источника, протекают крайне медленно. К этим реакциям относится реакция окисления закисного железа до окисного. Химически железо (II) при рН<3 почти не окисляется, в присутствии бактерий скорость его окисления увеличивается почти в 200 тысяч раз.
При окислении железа кислород выступает в роли акцептора, реакцию его окисления можно представить в виде
Fe2+= Fe3+ + e (33)
O2 + 4H- + 4e = 2H2O (34)
4Fe2++4H++O2= 4Fe3++2H2O (35)
Энергия Гиббса этой химической реакции равна G = -38,3ккал, а потенциал
Е= 0,771+0,09lg (Fe3+/Fe2+) (36)
Энергетический метаболизм, т.е. реакции, сопровождающиеся мобилизацией энергии и запасами ее в форме АТФ, используемой клетками А.ferrooxidans при биосинтезе, заключается в превращении химической реакции восстановленных химических соединений в биологически доступную энергию макроэргических связей. Донорами электронов в этом энергетическом процессе является неорганическое вещество, в частности закисное железо, акцептором - молекулярный кислород.
С учетом имеющихся экспериментальных данных по ферментативной кинетике биохимическое или биокаталитическое окисление железа можно объяснить с использованием основных положений хемиоосмотической гипотезы Ингледью. Первичным акцептором электронов при окислении железа (II) является медьсодержащий белок-рустицианин, который стабилен при рН 2 и способен взаимодействовать с железом. Этот белок восстанавливается на внешней стороне мембраны, где находятся цитохромы С (рисунок 15 ).
Хемиоосмотическиий механизм биохимического окисления Fe2+ ,
Бактериями А. ferrooxidans
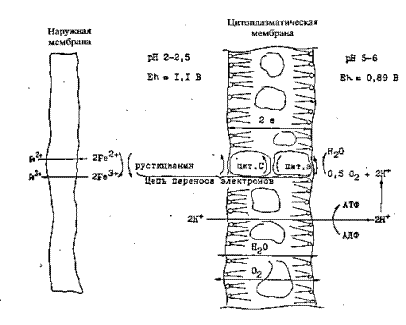
Рисунок 15
Далее электрон переносится по цитохромной цепи на кислород. Восстановление кислорода осуществляется уже на внутренней стороне цитоплазматической мембраны. Таким образом, реакция окисления железа (II) происходит на внешней стороне мембраны, причем Fe2+ , Н+ и О2 поступают из внешней фазы, а продукты окисления Fe3+ и Н2О возвращаются в нее. Причем Fe3+ возвращается в раствор в виде хелатных соединений с ферментами, часть его разрушается, а около 50% его постоянно присутствует в растворе в виде отрицательно заряженного комплекса.
При переносе электронов по цитохромной цепи от железа на кислород создается протонный потенциал и выделяется достаточное количество энергии для того, чтобы синтезировать 1 молекулу АТФ на два прошедших электрона. Для этого необходимо чтобы величина Еh была равна 0,33 В. На внутренней стороне мембраны, где происходит восстановление кислорода, потенциал пары 0,5 O2/H2O при рН 5-6 равен 0,89 В, в то время как на внешней стороне мембраны при рН 2 этот потенциал составляет 0,22 В. Эта разница образуется в основном за счет градиента рН и только 0,12 В поступает от дыхательной цепи клетки.
Таким образом, основная часть энергии при окислении Fe2+ бактериями генерируется при передаче ионов Н+ в результате хемиоосмотической АТФ-фазной реакции, протекание которой обеспечивается градиентом рН и мембранным или протонным потенциалом. Потребление протона на внутренней стороне цитоплазматической мембраны при окислении железа приводит к подщелачиванию среды внутри клетки до рН 5,5-6 по реакции
2Fe2+ + 0,5O2+2H+= 2Fe3+ +H2O (37)
Окисление железа (II) происходит на внешней стороне цитоплазматической мембраны, когда электроны посредством цитохромной системы проходят через мембрану и поступают в клетку, где кислород, принимая электроны, окисляется до воды, и получаемая при этом энергия идет для синтеза АТФ, используемой бактериями для фиксации углекислоты в процессе хемосинтеза и роста клеток.
Сера, как известно, входит в состав сульфидных минералов в виде S2-. При бактериальном окислении сульфидов окисление сульфидной серы до элементной происходит при электрохимической реакции окисления сульфидной поверхности и под действием бактерий, например:
FeS2 + Fe2(SO4)3 = 3FeSO4+2S (38)
при участии ферментов- сульфидооксидазы и полисульфидооксидазы . Окисление этой серы бактериями сопряжено также с генерацией АТФ.
Образующаяся элементная сера является единственным твердым продуктом окисления таких сульфидных минералов, как арсенопирит, пирит, пирротин, халькопирит и др. Элементная сера переходит в пульпу при выщелачивании в виде отдельных агрегатов, а также покрывает поверхность минералов. На этой сере происходит адгезия минеральных клеток, которые при таком непосредственном контакте осуществляют ее окисление до сульфат-ионов. Следует учитывать, что при бактериальном окислении таких хорошо окисляющихся минералов, как пирротин, образуется большое количество элементной серы, которая является хорошим субстратом для бактерий А. thiooxidans. Поэтому в жидкой фазе пульпы количество этих бактерий увеличивается до 109-1010 кл/мл.
Общая схема бактериального окисления сульфидной серы может быть представлена в виде:
S2- ® Sоb ® SO32-® SO42- (39)
Ромбическая элементная сера перед окислением ее ферментами должна быть в таком состоянии, при котором возможно ее растворение липидами и фосфолипидами микробного синтеза. Поэтому при бактериальном окислении сульфидной серы образуется элементная сера b-модификации, которая хорошо растворяется в таких органических растворителях как липиды и фосфолипиды. Сера b-модификации, растворенная компонентами мембраны клеток, транспортируется в периплазматическое пространство клетки, где окисляется на наружной стороне цитоплазматической мембраны и на ее инвагинатах при участии ферментов
Дата: 2019-07-30, просмотров: 272.